Урок №5. Тиск газу. Рівняння стану ідеального газу (конспект)
Урок №5. Тиск газу. Рівняння стану ідеального газу
Мета: з'ясувати механізм тиску ідеального газу та його залежність від мікропараметрів.
Тип уроку: Комбінований урок.
Обладнання: комп'ютер, презнтація (електронний додаток ППЗ «Фізика 10. Основи
МКТ»).
Демонстрації:
1. Модель тиску газу.
2. Фрагмент відеофільму «Молекули й молекулярний рух».
3. ОК-4.
План викладення нового матеріалу.
1. Основне рівняння МКТ ідеального газу.
2. Зв'язок тиску із середньою кінетичною енергією молекул
Урок №5. Тиск газу. Рівняння стану ідеального газу
Мета: з'ясувати механізм тиску ідеального газу та його залежність від мікропараметрів.
Тип уроку: Комбінований урок.
Обладнання: комп’ютер, презнтація (електронний додаток ППЗ «Фізика 10. Основи МКТ»).
Демонстрації:
1. Модель тиску газу. 2. Фрагмент відеофільму «Молекули й молекулярний рух».
3. ОК-4.
План викладення нового матеріалу.
1. Основне рівняння МКТ ідеального газу.
2. Зв'язок тиску із середньою кінетичною енергією молекул МПЗ: математика, фізика 8, 10 клас.
План.
|
Етапи уроку |
Методи й форми роботи з класом |
|
I. Організаційний етап. Перевірка домашнього завдання. |
Якісні запитання. Фізичний диктант |
|
II. Повідомлення теми, мети й завдань уроку; мотивація навчальної діяльності учнів. |
Повідомлення нового матеріалу – презентація учителя, запис в зошити. |
|
III. Застосування набутих знань. |
Розв’язування задач. |
|
IV. Підведення підсумків уроку та повідомлення домашнього завдання. |
Коментар учителя, домашнє експериментальне завдання. |
Фізичний диктант.
|
1в |
2в |
3в |
|
|
1.Формула молярної маси через Мr М=Мr·10-3кг/моль |
M |
Кількість речовини число молекул і Авогадро N A |
через число |
|
2.Концентрація молекул N
V |
|
число молекул в тілі m
M |
|
|
3.Основне рівняння МКТ
p 0 3 |
Середня кінетична енергія (зв'язок
з абсолютною температурою) |
Основне рівняння МКТ (зв'язок з температурою) р=nkT |
|
|
4.Універсальна газова стала R=8,31Дж/моль·К |
Число Авогадро NА=6,02·10231/моль |
Стала Больцмана k=1,38·10-23Дж/К |
|
|
5.Температура – міра середньої кінетичної енергії. |
Основні макроскопічні параметри, що характеризують ідеальний газ: р, Т, V |
Зв'язок температури t з абсолютною температурою: Т=t+273(К) |
|
|
6.Молярна маса |
Моль |
Кількість речовини |
|
|
7.Осмос |
Дифузія |
Броунівський рух |
|
Викладання нового матеріалу.
. Основне рівняння МКТ.
Припущення: 1) газ ідеальний, тобто зіткненнями нехтуємо;
2) швидкості молекул приблизно однакові;
3) усі напрями у просторі (напрями руху молекул) рівноймовірні.
Дозволяє: знайти тиск газу р, якщо відомі маса молекули газу m0, середнє значення
![]() 2 квадрата швидкості молекул та
концентрація молекул n.
2 квадрата швидкості молекул та
концентрація молекул n.
Виводиться за допомогою законів механіки.
В результаті кожного зіткнення між молекулами і молекул із стінками швидкості молекул можуть змінюватися по модулю і по напряму; на інтервалах часу між послідовними зіткненнями молекули рухаються рівномірно і прямолінійно. В моделі ідеального газу припускається, що всі зіткнення відбуваються по законах пружного удару, тобто підкоряються законам механіки Ньютона.
Використовуючи модель ідеального газу, обчислимо тиск газу на стінку посудина. В процесі взаємодії молекули із стінкою посудина між ними виникають сили, що підкоряються третьому закону Ньютона. В результаті проекція υх швидкості молекули, перпендикулярна стінці, змінює свій знак на протилежний, а проекція υy швидкості, паралельна стінці, залишається незмінною (рис. 15).
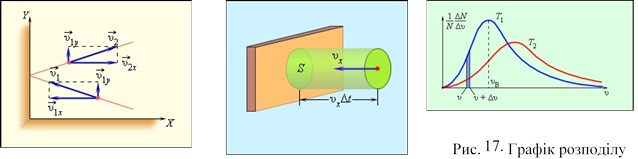
Рис. 15. Проекції швидкостей Рис. 16. Визначення тиску молекул
Тому зміна імпульсу молекули буде рівна 2m0υх, де m0 – маса молекули.
Виділимо на стінці деякий площу S (рис. 16). За час Δt з цією площею зіткнуться всі молекули, що мають проекцію швидкості υх, направлену у бік стінки, і що знаходяться в циліндрі з підставою площі S і заввишки υхΔt.
Хай в одиниці об'єму посудини містяться n молекул; тоді число молекул в об'ємі циліндра рівно nSυхΔt. Але з цього числа лише половина рухається у бік стінки, а інша половина рухається в протилежному напрямі і із стінкою не стикається. Отже, число ударів молекул об площу S за час Δt дорівнює
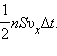
Оскільки кожна молекула при зіткненні із стінкою змінює свій імпульс на величину 2m0υх, та повна зміна імпульсу всіх молекул, що зіткнулися за час Δt з площею S, дорівнює
![]()
За законами механіки ця зміна імпульсу всіх що зіткнулися із стінкою молекул відбувається під дією імпульсу сили FΔt, де F – деяка середня сила, діюча на молекули з боку стінки на площу S. Але по 3-му закону Ньютона така ж по модулю сила діє з боку молекул на площу S. Тому можна записати:
![]()
Розділивши обидві частини на SΔt, отримаємо:
![]()
де p – тиск газу на стінку судини.
При висновку цього співвідношення передбачалося, що всі n молекул, що містяться в одиниці об'єму газу, мають однакові проекції швидкостей на вісь Ох. Насправді це не так.
В результаті численних зіткнень молекул газу між собою і з стінками в судині, що містить велике число молекул, встановлюється деякий статистичний розподіл молекул по швидкостях. При цьому всі напрями векторів швидкостей молекул виявляються рівноправними (рівноімовірними), а модулі швидкостей і їх проекції на координатні осі підкоряються визначеним закономерностям. Розподіл молекул газу по модулю швидкостей називається розподілом Максвела, який у 1860 р. вивів закон розподілу молекул газу по швидкостях, виходячи з основних положень молекулярно-кінетичної теорії. На рис. 17 представлені типові криві розподілу молекул по швидкостях. По осі абсцис відкладений модуль швидкості, а по осі ординат – відносне число молекул, швидкості яких лежать в інтервалі від υ до υ +Δυ. Це число дорівнює площі виділеного на рис. 17 стовпчика.
Характерними параметрами розподілу Максвела є найвірогідніша швидкість υв, відповідна максимуму кривої розподілу, і середньоквадратична швидкість
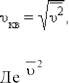 – середнє значення квадрата
швидкості.
– середнє значення квадрата
швидкості.
Із зростанням температури максимум кривої розподілу зміщується у бік великих швидкостей, при цьому υв і υкв збільшуються.
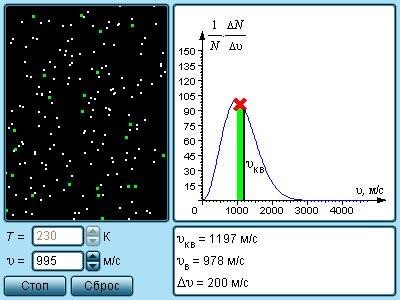
Модель. Розподіл Максвела
Щоб уточнити формулу для тиску газу
на стінку судини, припустимо, що всі молекули, що містяться в одиниці об'єму,
розбиті на групи, містить n1, n2, n3 і т. д.
молекул з проекціями швидкостей υx1, υx2, υx3 і т. д. відповідно. При цьому  Кожна група молекул вносить свій
внесок
Кожна група молекул вносить свій
внесок
![]()
в тиск газу. В результаті зіткнень із стінкою молекул з різними значеннями проекцій υxi швидкостей виникає сумарний тиск
![]()
Що входить в цей вираз сума – це сума квадратів проекцій υx всіх n молекул в одиничному
об'ємі газу. Якщо цю суму розділити
на n, то ми отримаємо середнє значення ![]() квадрата проекції
квадрата проекції ![]() швидкості молекул:
швидкості молекул:
 Тепер формулу для тиску газу можна
записати у вигляді
Тепер формулу для тиску газу можна
записати у вигляді
квадратів їх проекцій на координатні осі рівні між собою:
![]()
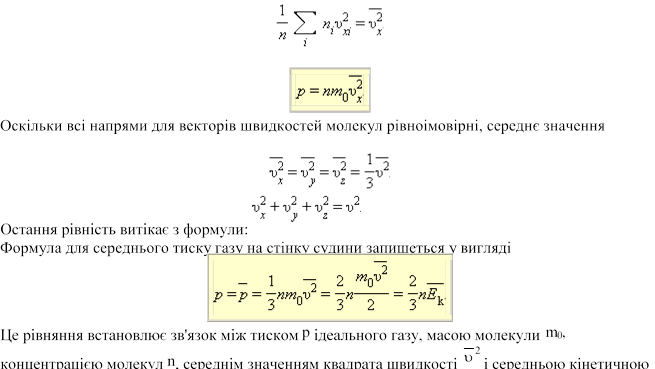
енергією E k поступального руху молекул. Його називають основним рівнянням молекулярнокінетичної теорії газів.
Таким чином, тиск газу рівно двом третинам середньої кінетичної енергії поступального руху молекул, що містяться в одиниці об'єму.
. Зв'язок тиску із середньою кінетичною енергією молекул.
![]() Якщо через
E позначити середню кінетичну енергію
поступального руху молекули
Якщо через
E позначити середню кінетичну енергію
поступального руху молекули ![]() E ,
E ,
2
то ми можемо записати основне рівняння МКТ у вигляді p
![]() 3 2
3 2
Отже, тиск ідеального газу пропорційний добуткові концентрації молекул на середню кінетичну енергію поступального руху молекули.
|
p |
Наслідки основного рівняння МКТ: 1. р~nT, р=knT, або , де k=1,38·10-23Дж/К – стала Больцмана.
2.
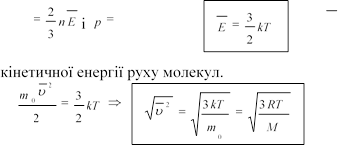 p nkT , отже , Т~
E , значить, температура є мірою
середньої
p nkT , отже , Т~
E , значить, температура є мірою
середньої
3.
, де ![]() с.кв . - середня квадратична швидкість,
с.кв . - середня квадратична швидкість,
де R=8,31Дж/К·моль.
Запитання до учнів у ході викладання нового матеріалу.
1.Як обчислити зміну імпульсу молекули у разі удару її об стінку посудини?
2.Чому можна вважати, що молекули в газі рухаються лише уздовж трьох взаємно перпендикулярних напрямків?
3.Яким є механізм виникнення тиску газу з точки зору молекулярно – кінетичної теорії будови речовини?
Задачі, розв'язувані на уроці.
1.Кисень перебуває у н.у. Обчислити середню квадратичну швидкість молекул газу.

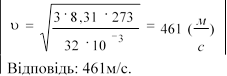
2.Визначити кінетичну енергію хаотичного поступального руху всіх молекул будьякого газу в балоні ємністю 5 л за тиску 1МПа. (7,5 кДж)
3.Чому дорівнює середня кінетична енергія хаотичного руху молекул аргону, якщо
2 кг його, перебуваючи у посудині об'ємом 2м3, чинять тиск 3·105 Па? (6·10-20 Дж)

Домашнє завдання: [1]§41.
ДОДАТКОВА ІНФОРМАЦІЯ
Дослід Штерна.
Вирішальними для доказу МКТ є досліди, у яких безпосередньо виявляються окремі молекули або атоми, а також вимірюються швидкості їхнього руху. Одним із перших експериментів, де були безпосередньо виміряні швидкості руху окремих молекул газу, був дослід О.Штерна, здійснений у 1920р. Здобуте з цього досліду значення середнього квадрата швидкості руху атомів Аргентуму виявилося в межах можливих похибок вимірювань, що збігаються зі значенням швидкості, здобутим теоретичним шляхом.
Збіг експериментально знайдених швидкостей руху молекул газу зі значеннями, що були передбачені МКТ, є одним із найважливіших прямих доказів справедливості МКТ газів.
Можна звернути увагу
Звертаю увагу учнів на одну важливу обставину. У досліді Штерна швидкість молекул визначалася за різних температур за рахунок зміни розжарення волоска, з якого відбувалося випарювання речовини. Виявилося, що у разі підвищення температури швидкість молекул збільшується, а у разі зниження – зменшується. Це експериментально підтверджує молекулярно – кінетичне визначення абсолютної температури.
Молекули срібла вилітають із розжареного стержня і через отвір у циліндрі А потрапляють на циліндр В. Якщо циліндри рухаються зі сталою кутовою швидкістю ω (частотою ν), то на циліндрі В утворюється смужка срібла, зміщена вбік від точки В на
![]() відстань s.
відстань s.![]() . Але t .
Тоді
. Але t .
Тоді
t
T
Швидкість молекул газу (дослід Штерна, 1920)
ω

![]() А м
А м
B B 500 ![]()
s T s s с О
Молекули срібла вилітають із розжареного стержня і через отвір
у циліндрі А потрапляють на циліндр В. s
В Крива розподілу
Максвелла
Середня швидкість теплового руху молекул.
Рівняння
![]() E kT
дає можливість знайти середній квадрат швидкості руху
E kT
дає можливість знайти середній квадрат швидкості руху
молекули. Підставляючи до цього рівняння формулу

![]()
![]() , дістанемо : kT
, звідки : .
, дістанемо : kT
, звідки : .
2 2
Обчислюючи за цією формулою швидкість молекул, наприклад азоту, при t=0ºС,
![]() м дістанемо
. Молекули водню за тієї ж температури мають середню швидкість
м дістанемо
. Молекули водню за тієї ж температури мають середню швидкість
с 1800м/с.
Запитання до учнів у ході викладання нового матеріалу.
1.Як зміниться середня квадратична швидкість руху молекул у разі збільшення температури в 4 рази?
2.Які молекули в атмосфері рухаються швидше: азоту чи кисню?
Задачі, розв'язувані на уроці.
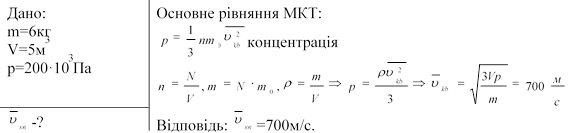
1.Чому дорівнює середня квадратична швидкість руху молекул газу, якщо він має масу 6кг, об'єм 5м3 при тиску 200кПа?
2.У скільки раз зміниться тиск одноатомного газу в результаті зменшення його об'єму в 3 рази і збільшення середньої кінетичної енергії його молекул в 2 рази?
 2
2
![]() Основне рівняння МКТ в даному випадку
p nE
Основне рівняння МКТ в даному випадку
p nE
3
22
Дж .
Дж.
4.Знайти швидкість молекул срібла у досліді Штерна, якщо кутове зміщення їх дорівнює 5,4º при частоті обертання 150с-1. Відстань між циліндрами 2см.
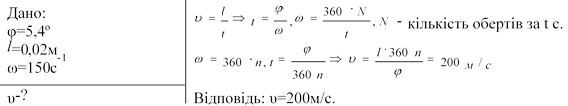
Список використаних джерел
1. Коршак Є. В. Фізика : 10 кл. : [підруч. для загальноосвіт. навч. закл. : рівень стандарту] / Є. В. Коршак, О. І. Ляшенко, В. Ф. Савченко. – К. : «Генеза», 2010. – 192 с. 2. Туманцова О. О. Фізика. 10 клас. Рівень стандарту: Розробки уроків /
О. О. Туманцова. – Х.: «Ранок», 2010. – 320 с.
3. Уроки фізики у 10 класі. Молекулярна фізика і термодинаміка / Руденко А. В., упорядник. – Х.: Вид. група «Основа», 2010. –139 с. – (Б-ка журн. «Фізика в школах України». Вип. 11 (83)).
4. Щербина Т. Чому? Цікаві питання з фізики.10 клас / Т. Щербина. – К. : Ред.
загальнопед. газ., 2003. – 128 с. – (Бібліотека «Шкільного світу»).
5. «Открытая физика.2.6. Часть 1».


про публікацію авторської розробки
Додати розробку
