Урок №4. Властивості газів. Ідеальний газ (конспект)
Урок №4. Властивості газів. Ідеальний газ.
Мета: дати поняття ідеального газу, температури, температурних шкал, розвивати абстрактне мислення учнів, виховувати інтерес до фізики як до науки.
Тип уроку: Урок вивчення нового матеріалу.
Обладнання: комп'ютер, інтерактивна дошка, програмне забезпечення SMART Notebook, презнтація (електронний додаток ППЗ «Фізика 10. Основи МКТ»), плакати, термометри, дидактичний матеріал.
Демонстрації:
1. Вимірювання температури.
2. Фрагмент відеофільму «Молекули й молекулярний рух».
3. ОК-3.
Урок №4. Властивості газів. Ідеальний газ.
Мета: дати поняття ідеального газу, температури, температурних шкал, розвивати абстрактне мислення учнів, виховувати інтерес до фізики як до науки.
Тип уроку: Урок вивчення нового матеріалу.
Обладнання: комп’ютер, інтерактивна дошка, програмне забезпечення SMART Notebook, презнтація (електронний додаток ППЗ «Фізика 10. Основи МКТ»), плакати, термометри, дидактичний матеріал.
Демонстрації:
1. Вимірювання температури. 2. Фрагмент відеофільму «Молекули й молекулярний рух».
3. ОК-3.
План викладення нового матеріалу.
1. Ідеальний газ.
2. Температура й теплова рівновага.
3. Абсолютна температура.
4. Температура – міра середньої кінетичної енергії молекул.
5. Стала Больцмана.
6.Залежність тиску газу від концентрації його молекул і температури.
МПЗ: хімія, математика.
План.
|
Етапи уроку |
Методи й форми роботи з класом |
|
I. Організаційний етап. |
Якісні запитання; комп’ютерне тестування (програма «MyTestX») – 3 варіанти, один з яких тренувальний (самостійна робота №2). |
|
II. Повідомлення теми, мети й завдань уроку; мотивація навчальної діяльності учнів. |
Повідомлення нового матеріалу – презентація учителя, запис в зошити. |
|
III. Застосування набутих знань. |
Розв’язування задач. |
|
IV. Підведення підсумків уроку та повідомлення домашнього завдання. |
Коментар учителя, домашнє експериментальне завдання. |
Актуалізація опорних знань.
1. Чи мають гази власний об’єм?
2. Чи мають гази форму?
3. Чи мають гази текучість?
4. Чи можна стиснути гази?
5. Як розміщені молекули в газах? Як вони рухаються?
6. Що можна сказати про взаємодію молекул у газах?
Виконання тестових завдань (8 запитань, 3 варіанти, один з яких тренувальний). Варіант 1
1. Укажіть автора теорії броунівського руху:
1) Альберт Ейнштейн; 2) Роберт Броун; 3) Жан Перрен; 4) Дмитро Менделєєв.
2. Вкажіть сталу Больцмана:
![]()
![]() 1)
8,31 10 ;
2) 1,38 10 23 Дж ;
1)
8,31 10 ;
2) 1,38 10 23 Дж ;
К
![]()
![]() 3)
1,38 10 23
Дж ; 4) 1,38.
3)
1,38 10 23
Дж ; 4) 1,38.
К
3. Виберіть всі правильні твердження:
1) молекула не може складатися з одного атома;
2) молекули однієї речовини в різних агрегатних станах відрізняються;
3) відстань між молекулами даної речовини в різних агрегатних станах неоднакова; 4) відмінності між агрегатними станами певно речовини пояснюється неоднаковим розміром молекул у різних агрегатних станах цієї речовини;
5) всі молекули даної речовини мають однакові хімічні властивості.
4. У балоні об'ємом 20 л знаходиться 500 г вуглекислого газу (СО2) під тиском 1,8 МПа. Визначте температуру газу:
1) 273 К; 2) 283 К; 3) 300 К; 4) 381 К.
5. При температурі 309 К і тиску 0,7 МПа газ має густину 12 кг/м3. Визначте молярну масу газу та який це може бути газ:
1) 0,044 кг/моль; вуглекислий газ; 2) 0,004 кг/моль; гелій;
3) 0,002 кг/моль; водень; 4) 0,032 кг/моль; кисень; 5) 0,07 кг/моль; хлор.
6. Визначте кількість атомів у 1 см3 срібла:
![]()
![]()
![]()
![]()
![]() 1) 5,8510 20 ; 2) 5,8510 21; 3) 5,8510 22 ; 4) 5,8510 23 ; 5) 5,8510 24.
1) 5,8510 20 ; 2) 5,8510 21; 3) 5,8510 22 ; 4) 5,8510 23 ; 5) 5,8510 24.
7. Знайдіть тиск азота, якщо середня квадратична швидкість його молекул 300 м/с, а його густина 1,35 кг/м3. Відповідь дайте у кПа з точністю до 1. ___________________________
8. Знайдіть тиск газу,концентрація якого при температурі 300 К дорівнювала 1024 м-3. Відповідь дайте у кПа з точністю до 0,1.
___________________________
Відповіді
1) (1 б.) 1; 2) (1 б.) 2; 3) (1 б.) 3; 5; 4) (1 б.) 4; 5) (2 б.) 1; 6) (2 б.) 3; 7) (2 б.): 40; 8) (2 б.): 4,1.
Варіант 2
1. Закінчить речення: «Основне рівняння молекулярно-кінетичної теорії ідеального газу встановлює залежність між...»
1) тиском і масою молекул;
2) тиском і концентрацією молекул, їх масою, температурою;
3) тиском і сталою Больцмана;
4) тиском і концентрацією молекул, їх масою, середньою квадратичною швидкістю.
2. Укажіть формулу, за якою можна визначити середню кінетичну енергію поступального хаотичного руху молекул газу:
1)
![]() E kT ; 3)
E kT ; 3) ![]() E kT ; 4)
E kT ; 4) ![]() E kT .
E kT .
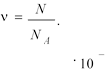
![]()
![]() 3. Укажіть всі формули, за
якими можна визначити кількість речовини: m m
3. Укажіть всі формули, за
якими можна визначити кількість речовини: m m
1) MN ; 3) moN ; 5)
M N
4. Маса атома деякого хімічного елемента дорівнює 3,27 25 кг . З'ясуйте, який це елемент: 1) Гідроген; 2) Неон; 3) Аурум; 4) Ферум.
5. Два гази з молярними масами М1 та М2=5М1, узяті при температурах Т1=1,2Т2 і Т2, мають однакову густину. Обчисліть відношення тисків газів: 1) р1:р2=4,17; 2) р1:р2=6; 3) р2:р1=4,17; 4) р2:р1=0,24.
6. Порівняйте об'єми двох тіл, виготовлених з олова та міді, якщо в них однакова кількість речовини:
1) у міді менше в 2,3 раза; 2) у олова менше в 2,3 раза;
3) у олова менше в 2,7 раза; 4) у олова менше в 3 раза; 5) у міді менше в 2,7 раза.
7. Обчисліть середню квадратичну швидкість атомів гелія при температурі 27°С. Відповідь дайте у м/с з точністю до 1.
__________________________________________ 8. Середня квадратична швидкість молекул деякого газу 450 м/с. Тиск газу 5∙104 Па. Чому дорівнює густина газу. Відповідь дайте у кг/м3 з точністю до 0,01.
___________________________
Відповіді:
1) (1 б.) 4; 2) (1 б.) 3; 3) (1 б.) 5; 4) (1 б.) 3; 5) (2 б.) 2; 6) (2 б.) 1; 7) (2 б.) 1370; 8) (2 б.): 0,74.
Варіант 3 (тренувальний)
1. Укажіть одиницю кількості речовини: 1) кілограм; 2) грам; 3) літр; 4) моль.
2. Виберіть число Авогадро:
![]()
![]()
![]()
![]()
![]()
![]() 1)
6,210 23 моль ;
2) 6,0210 23 моль;
3) 6,2 10 23 моль
; 4) 6,02 10
23 моль.
1)
6,210 23 моль ;
2) 6,0210 23 моль;
3) 6,2 10 23 моль
; 4) 6,02 10
23 моль.
3. Вкажіть формули, за якими можна визначити молярну масу:
1) M ![]() M r ; 2) M
M r ; 2) M ![]() m0N A ;
3) M
m0N A ;
3) M ![]() ; 4) M
; 4) M ![]() ; 5) M
; 5) M ![]() nN A .
nN A .
N A N A
4. У балоні ємністю 5 л міститься 29 г кисню. Визначте концентрацію молекул:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 1) 5,510 26 м; 2) 2,510 26 м; 3) 4,710 25 м; 4) 1,810 26 м; 5) 1,210 26 м. 5. Визначте масу гелію, що
заповнює повітряну кулю об'ємом 90 м3 під тиском
1) 5,510 26 м; 2) 2,510 26 м; 3) 4,710 25 м; 4) 1,810 26 м; 5) 1,210 26 м. 5. Визначте масу гелію, що
заповнює повітряну кулю об'ємом 90 м3 під тиском
![]() 9,810 4 Па
за температури 37°С:
9,810 4 Па
за температури 37°С:
1) 13,7 кг; 2) 18,8 кг; 3) 22,6 кг; 4) 29,4 кг.
6. Тіло містить 1027 молекул. Визначте кількість речовини в цьому тілі:
1) 81,5 моль; 2) 166,7 моль; 3) 830 моль; 4) 1661 моль.
![]() 7.
Визначте абсолютну температуру, за якої середня кінетична енергія молекл
одноатомного газу дорівнює 4,14
10 21 Дж :
7.
Визначте абсолютну температуру, за якої середня кінетична енергія молекл
одноатомного газу дорівнює 4,14
10 21 Дж :
1) 100 К; 2) 200 К; 3) 300 К; 4) 400 К.
8. У балоні об'ємом 10 л знаходиться газ при 27°С. Внаслідок витікання газу тиск у балоні знизився на 4,2 кПа, температура лишилася незмінною. Яка кількість молекул вийшла з балону? Укажіть порядок.
___________________________
Відповіді:
1) (1 б.) 4; 2) (1 б.) 2; 3) (1 б.) 1; 2; 4; 4) (1 б.) 5; 5) (2 б.) 1; 6) (2 б.) 4; 7) (2 б.) 2; 8) (2 б.): 22.
Викладання нового матеріалу.
. Ідеальний газ.
Найпростішою моделлю, даною молекулярно-кінетичною теорією, є модель ідеального газу. В кінетичній моделі ідеального газу молекули розглядаються як ідеально пружні кульки, що взаємодіють між собою і із стінками лише під час пружних зіткнень. Сумарний об'єм всіх молекул припускається малим в порівнянні з об'ємом посудини, в якій перебуває газ. Модель ідеального газу досить добре описує поведінку реальних газів в широкому діапазоні тиску і температур. Задача молекулярно-кінетичної теорії полягає в тому, щоб встановити зв'язок між мікроскопічними (маса, швидкість, кінетична енергія молекул) і макроскопічними параметрами (тиск, об'їм, температура).
Ідеальний газ – це газ, взаємодією між молекулами у якому можна знехтувати.
Газ можна вважати ідеальним, якщо:
а) відсутні сили міжмолекулярної взаємодії, тобто молекули не притягаються і не відштовхуються;
б) взаємодія між молекулами відбувається тільки під час їх ударів є пружною;
в) молекули газу не мають об’єму і вважаються матеріальними точками. . Температура й теплова рівновага.
Температура й теплова рівновага. Основна властивість температури полягає в такому: якщо привести до зіткнення два тіла – холодне й гаряче, то холодне тіло почне нагріватися, а гаряче – вистигати. Температура кожного з тіл буде змінюватися з часом доти, поки температури тіл не стануть однаковими. Ми говоримо, що тіла досягнуть стану теплової рівноваги. Отже,
температура характеризує стан теплової рівноваги: усі тіла, що перебувають у тепловій рівновазі, мають однакову температуру.
Поняття температури тісно пов'язано з поняттям теплової рівноваги. Тіла, що знаходяться в контакті один з одним, можуть обмінюватися енергією. Енергія, передана одним тілом іншому при тепловому контакті, називається кількістю теплоти.
Теплова рівновага – цей такий стан системи тіл, що знаходяться в тепловому контакті, при якому не походить теплопередачу від одного тіла до іншого, і всі макроскопічні параметри тіл залишаються незмінними. Температура – це фізичний параметр, однаковий для всіх тіл, що знаходяться в тепловій рівновазі. Можливість введення поняття температури виходить з досвіду і носить назву нульового закону термодинаміки.
Для вимірювання температури використовуються фізичні прилади – термометри, в яких про величину температури судять по зміні якого-небудь фізичного параметра. Для створення термометра необхідно вибрати термометричну речовину (наприклад, ртуть, спирт) і термометричну величину, що характеризує властивість речовини (наприклад, довжина ртутного або спиртного стовпчика). В різних конструкціях термометрів використовуються різноманітні фізичні властивості речовини (наприклад, зміна лінійних розмірів твердих тіл або зміна електричного опору провідників при нагріванні). Термометри повинні бути відкалібрований. Для цього їх приводять в тепловий контакт з тілами, температури яких вважаються заданими. Частіше всього використовують прості природні системи, в яких температура залишається незмінною, не дивлячись на теплообмін з навколишнім середовищем – це суміш льоду і води і суміш води і пари при кипінні при нормальному атмосферному тиску. По температурній шкалі Цельсія точці плавлення льоду приписується температура 0°С, а точці кипіння води – 100°С. Зміна довжини стовпа рідини в капілярах термометра на одну соту довжини між відмітками 0°С і 100°С приймається рівним 1°С. У ряді країн (США) широко використовується шкала Фаренгейта (TF), в якій температура замерзаючої води приймається рівній 32°F, а температура кипіння води рівної 212°F. Отже
![]()
Особливе місце у фізиці займають газові термометри (рис. 12), в яких термометричною речовиною є розріджений газ (гелій, повітря) в судині незмінного об'єму (V=const), а термометричною величиною – тиск газу p. Досвід показує, що тиск газу (при V=const) росте із зростанням температури, виміряної за шкалою Цельсія.
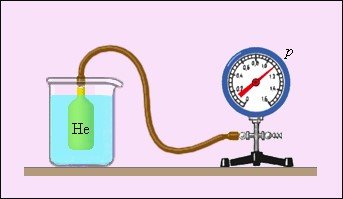
Рис. 12. Газовий термометр з постійним об'ємом
Щоб проградуювати газовий термометр постійного об'єму, можна зміряти тиск при двох значеннях температури (наприклад, 0°С і 100°С), нанести точки p0 і p100 на графік, а потім провести між ними пряму лінію (рис. 13). Використовуючи отриманий таким чином калібрувальний графік, можна визначати температури, відповідні іншим значенням тиску. Екстраполюючи графік в область низького тиску, можна визначити деяку «гіпотетичну температуру», при якій тиск газу став би рівним нулю. Досвід показує, що ця температура рівна –273,15°С і не залежить від властивостей газу. На досвіді отримати шляхом охолоджування газ в змозі з нульовим тиском неможливо, оскільки при дуже низьких температурах всі гази переходять в рідкий або твердий стан.
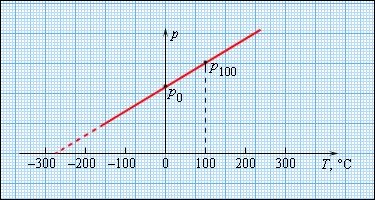
Рис. 13. Залежність тиску газу від температури при V=const . Абсолютна температура.
Англійський фізик У. Кельвін (Томсон) в 1848 р. запропонував використовувати точку нульового тиску газу для побудови нової температурної шкали (шкала Кельвіна). В цій шкалі одиниця вимірювання температури така ж, як і в шкалі Цельсія, але нульова крапка зсунута:
TК = TС + 273,15.
В системі СІ прийнято одиницю вимірювання температури по шкалі Кельвіна називати кельвіном і позначати літерою К. Наприклад, кімнатна температура TС=20°С по шкалі Кельвіна рівна TК =293,15К.
Температурна шкала Кельвіна називається абсолютною шкалою температур. Вона виявляється найзручнішою при побудові фізичних теорій.
Немає необхідності прив'язувати шкалу Кельвіна до двох фіксованих крапок – точці плавлення льоду і точці кипіння води при нормальному атмосферному тиску, як це прийнято в шкалі Цельсія.
Окрім точки нульового тиску газу, яка називається абсолютним нулем температури, достатньо прийняти ще одну фіксовану опорну точку. В шкалі Кельвіна в якості такої точки використовується температура потрійної точки води (0,01°С), в якій в тепловій рівновазі знаходяться всі три фази – лід, вода і пара. По шкалі Кельвіна температура потрійної точки приймається рівній 273,16К.
. Температура – міра середньої кінетичної енергії молекул. Стала Больцмана. Залежність тиску газу від концентрації його молекул і температури.
Газові термометри громіздкі і незручні для практичного застосування: вони використовуються як прецизійний стандарт для калібрування інших термометрів. Таким чином, тиск розрідженого газу в посудині сталого об'єму V змінюється прямо пропорційно абсолютній температурі: p ~ T. З другого боку, дослід показує, що при незмінних об'ємі V і температурі T тиск газу змінюється прямо пропорційно відношенню кількості речовини н в даній посудині до об'єму V посудини
![]() N n
N n
p ~~ n,
V N AV N A
де N – число молекул в судині, NА – постійна Авогадро, n = N / V – концентрація молекул (тобто число молекул в одиниці об'єму посудини). Об'єднуючи ці співвідношення, можна записати:
p = nkT
де k – деяка універсальна для всіх газів постійна величина. Її називають постійною Больцмана, на честь австрійського фізика, одного з творців молекулярно-кінетичної теорії. Постійна Больцмана – одна з фундаментальних фізичних констант. Її чисельне значення в СІ дорівнює:
k =1,38∙10–23 Дж/К.
Порівнюючи співвідношення p=nkT з основним рівнянням молекулярно-кінетичної теорії газів, можна отримати:
![]() kT
kT
Середня кінетична енергія хаотичного руху молекул газу прямо пропорційна абсолютній температурі.
Таким чином, температура є мірою середньої кінетичної енергії поступального руху молекул.
Слід звернути увагу на те, що середня кінетична енергія поступального руху молекули не залежить від її маси. Броунівська частинка, зважена в рідині або газі, володіє такою ж середньою кінетичною енергією, як і окрема молекула, маса якої на багато порядків менше маси броунівської частинки. Цей висновок розповсюджується і на випадок, коли в судині знаходиться суміш хімічно не взаємодіючих газів, молекули яких мають різні маси. Рівноваги молекули різних газів в змозі матимуть однакові середні кінетичні енергії теплового руху, визначувані тільки температурою суміші. Тиск суміші газів на стінки судини складатиметься з парціальних тиску кожного газу:
p = p1+p2+p3+...=(n1+n2+n3+...)kT.
В цьому співвідношенні n1, n2, n3,.. – концентрації молекул різних газів в суміші. Це співвідношення виражає на мові молекулярно-кінетичної теорії експериментально встановлений на початку XIX сторіччя закон Дальтона: тиск в суміші хімічно не взаємодіючих газів дорівнює сумі їх парціальних тиску.
Запитання до учнів у ході викладання нового матеріалу.
1.Що розуміють під тепловою рівновагою тіл?
2.Ртутний термометр показує температуру 27ºС. Якій абсолютній температурі це відповідає?
3.Чому дорівнює абсолютний нуль температури за шкалою Цельсія?
4.Які переваги має абсолютна шкала температур у порівнянні зі шкалою Цельсія?
5.Чому концентрація молекул усіх газів одна й та сама за однакових тисків і температур?
За н.у. число молекул будь-якого газу в 1м3 дорівнює:
![]()
![]() VN A 25
VN A 25 ![]() – число
n0 0 0 0м
– число
n0 0 0 0м
MV M
Лошмідта (NL)
Задачі, розв'язувані на уроці.
1.Одна з двох однакових посудин заповнена сухим повітрям, а інша – вологим, яке містить водяну пару. Температури й тиски в обох посудинах однакові. Яка з посудин легше?
- Легша посудина з вологим повітрям. У рівних об'ємах газів за однакових температур і тисків міститься однакове число молекул. Виходить, у вологому повітрі більш легкі молекули води просто заміняють таку ж кількість молекул азоту й кисню.
2.У закритій посудині відбувається повне згоряння шматочка вугілля з утворенням вуглекислого газу. Після цього посудину прохолоджують до початкової температури. Порівняйте кінцевий тиск у посудині з початковим. Об'єм вугілля малий у порівнянні з об'ємом посудини.
- Кінцевий тиск дорівнює початковому, тому що концентрація молекул газу в посудині не змінилася.
До конспекту учня. ОК-3
|
Температура характеризує стан теплової рівноваги системи тіл: усі тіла системи, що перебувають одне з одним у тепловій рівновазі, мають одну й ту саму температуру. Співвідношення між абсолютною температурою Т і температурою t за шкалою Цельсія: Т=t+273 Абсолютний нуль температур, це температура, при якій припинився б тепловий рух частинок, із яких складається тіло. Абсолютна
температура є мірою середньої кінетичної енергії поступального руху молекул
ідеального газу: Тиск ідеального газу залежить від числа молекул в одиниці об'єму й від абсолютної температури: р=nkT. |
Домашнє завдання: конспект, [1]§44.
Домашнє експериментальне завдання.
Дослід 1. Спостереження молекулярної взаємодії тіл.
Прилади і матеріали (рис. 14,а): 1) пластинки скляні розміром 75х25х1мм – 2 шт., 2) склянка низька з водою, 3) аркуш паперу.
Хід роботи.
1. Протріть скляні пластинки аркушем паперу; переконайтесь, що вони сухі і чисті.
2. Покладіть одну пластинку на іншу (пластинки беріть за краї і не торкайтеся пальцями до їх поверхонь). Притисніть пластинки пальцем (рис. 14,б).
|
Рис. 14,а. Дослід 1, Рис. 14,б. Дослід 1, підготовчий етап перша частина 4. Дайте відповіді на запитання: |
Рис. 14,в. Дослід 1, друга частина |
3. 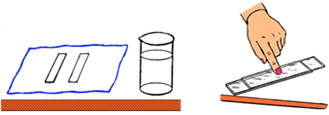
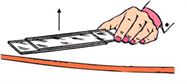 Підведіть
верхню пластинку за виступаючий край, переконайтесь, що пластинки «прилипнули»
одна до одної (рис. 14,в). Дослід повторіть кілька разів, змінюючи силу
стискування пластинок
Підведіть
верхню пластинку за виступаючий край, переконайтесь, що пластинки «прилипнули»
одна до одної (рис. 14,в). Дослід повторіть кілька разів, змінюючи силу
стискування пластинок
– Чому відбувається зчеплення скляних пластинок?
– Навіщо пластинки заздалегідь потрібно було стискувати?
5. Опустіть одну з пластинок в склянку з водою, а потім вийміть з води і оглянете її.
Переконайтесь, що до пластинки «прилипнули» крапельки води.
6. Покладіть змочену пластинку на суху і знову спробуйте їх роз'єднати.
7. Дайте відповіді на запитання:
– Між якими речовинами виявляються сили молекулярної взаємодії в останньому досліді?
– Яка сила молекулярної взаємодії більша: між молекулами води або між молекулами води і скла?
– Який висновок можна зробити з виконаних дослідів? [1, с. 8]
Список використаних джерел
1. Буров В. А. Фронтальные экспериментальные задания по физике: 9 кл. Дидакт. Материал. Пособие для учителя / В. А. Буров, А. И. Иванов, В. И. Свиридов; под ред. В. А. Бурова. – М.: Просвещение, 1986. – 48 с.
2. Коршак Є. В. Фізика : 10 кл. : [підруч. для загальноосвіт. навч. закл. : рівень стандарту] / Є. В. Коршак, О. І. Ляшенко, В. Ф. Савченко. – К. : «Генеза», 2010. – 192 с. 3. Туманцова О. О. Фізика. 10 клас. Рівень стандарту: Розробки уроків /
О. О. Туманцова. – Х.: «Ранок», 2010. – 320 с.
4. Уроки фізики у 10 класі. Молекулярна фізика і термодинаміка / Руденко А. В., упорядник. – Х.: Вид. група «Основа», 2010. –139 с. – (Б-ка журн. «Фізика в школах України». Вип. 11 (83)).
5. Щербина Т. Чому? Цікаві питання з фізики.10 клас / Т. Щербина. – К. : Ред.
загальнопед. газ., 2003. – 128 с. – (Бібліотека «Шкільного світу»).


про публікацію авторської розробки
Додати розробку
