Урок 47. Сучасна модель атома. Протонно - нейтронноа модель ядра атома. Ядерні сили.Ізотопи
Тема уроку. Сучасна модель атома. Протонно- нейтронна модель ядра атома. Ядерні сили.Ізотопи.
Мета уроку:
Освітня:дати учням уявлення про будову атома; познайомити їх із планетарною моделлю атома Резерфорда; розглянути сучасні теорії будови атомного ядра.
Розвиваюча: розвивати уяву, творче мислення.
Виховна:виховувати працелюбність та наполегливість.
Обладнання: , підручник, презентація (слайди) , періодична таблиця Д. І. Мендєлєєва.
Тип уроку: засвоєння нових знань.
Епіграф уроку: У математиці правильність інтуїтивної здогадки перевіряється логічно; у фізиці ж, що вивчає світ речей, верховний суддя – експеримент. Необов’язково щоразу звертатися до нього для перевірки
теорії, найчастіше теорія спростовується або підтверджується при ретельному аналізі виконаних раніше експериментів або співвідношень,що випливають із них.
А.Мігдал
Хід уроку
І. Організаційний момент.
ІІ. Актуалізація опорних знань та умінь.
Вправа «Мозковий штурм»
Учні називають поняття. Які асоціюються з категорією «Атомна енергетика»
ІІІ. Мотивація навчальної діяльності
У попередній вправі ви назвали свої асоціації. Які виникли від словосполучення «ядерна енергетика». Для того, щоб познайомитися з ядерною енергетикою, треба розпочати з найелементарнішого з’ясувати будову атома. З попередньо вивченого матеріалу ви знаєте, з чого складається атом, а сьогодні ми з вами поглибимо свої знання з цього питання.
Фронтальне опитування:
- Що ви знаєте про будову речовини?
- Хто ввів назву «атом» і що вона означає?
- Що називають атомами?
- Який заряд має ядро?
- До складу ядра які входять частинки?
- Що називають молекулами ?
ІV. Сприйняття та засвоєння нового матеріалу.
Механічні моделі будови атома
Я́дерна фі́зика — розділ фізики, який вивчає структуру і властивості атомних ядер, та механізми ядерних реакцій (в тому числі радіоактивний розпад).
1.Модель Томсона
Перша спроба створення моделі атома на основі накопичених експериментальних даних належить Дж. Томсону (1903).
Англійський фізик Джозеф Джон Томсон запропонував модель атома у вигляді позитивно зарядженої по всьому об'єму сфери діаметром 10~10 м, усередину якої, ніби родзинки в пудинг, вкраплені електрони. Позитивний заряд сфери компенсується сумарним негативним зарядом електронів.
Таким чином, атом подібний до пудингу, роль родзинок при цьому відіграють електрони.
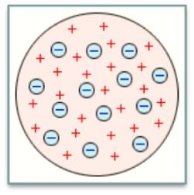
Рис.1.
Однак модель атома Томсона виявилась повністю відмінною від моделі, яку запропонував Резерфорд у результаті своїх досліджень. Резерфорд 1906 року запропонував модель, згідно з якою будова атома дуже схожа на будову сонячної системи. Щоб перевірити правильність своєї теорії, він провів низку дослідів, які називають дослідами Резерфорда .
2.Досліди Резерфорда
Перші безпосередні експерименти з дослідження внутрішньої структури атомів були виконані Е. Резерфордом і його співробітниками Е. Марсденом і Г.Гейгером у 1909 – 1911 рр. Резерфорд запропонував застосувати зондування атома за допомогою α-частинок, які виникають при радіоактивному розпаді радію і деяких інших елементів. Маса α-частинок приблизно в 7300 разів більша, ніж маса електрона, а позитивний заряд дорівнює подвоєному елементарному заряду. У своїх дослідах Резерфорд використовував речовину, із якої вилітали α-частинки з дуже великою швидкістю – приблизно 107 м/с. Але все – таки значно меншою, ніж швидкість світла. α-частинки – це позитивно заряджені частинки, вони були відкриті Резерфордом в 1899 р. при вивченні явища радіоактивності. Помістивши цю речовину в свинцевий контейнер із невеликим отвором, дослідники отримали вузький пучок α-частинок. Цими частинками Резерфорд бомбардував тонку фольгу з досліджуваного матеріалу (золото, срібло). Після розсіювання α-частинки потрапляли на напівпрозорий екран, вкритий сульфідом цинку. Зіткнення кожної частинки з екраном супроводилося спалахом, який можна було спостерігати в мікроскоп. Увесь прилад містився в посудні , з якої було викачано повітря.
У результаті дослідів було з’ясовано, що переважна більшість α-частинок проходить крізь фольгу, причому деякі з них відхиляються від початкової траєкторії. І цілком несподівано виявилося, що невелика кількість α-частинок ( приблизно одна з двох тисяч) відхилялись на кути, більші 900.
Узагальнивши результати дослідів, Резерфорд зробив висновки:
-
в цілому атом порожній. Майже вся його маса сконцентрована в ядрі діаметром d ~ 10
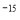 м. Ядро становить 99.95% від маси атома.
м. Ядро становить 99.95% від маси атома.
- ядро несе в собі заряд q+, величина якого за модулем дорівнює заряду електрона, помноженому на порядковий номер цього елемента в таблиці Менделєєва.
Оскільки атом електрично нейтральний, то позитивний заряд ядра компенсує заряд електронів, які мають рухатись навколо ядра, подібно до планет навколо Сонця. Кількість електронів дорівнює порядковому номеру елемента в таблиці Менделєєва. Таку модель атома Резерфорд назвав планетарною моделлю атома.
3. Планетарна модель атома
Модель атома за Е. Резерфордом: атом містить позитивно заряджене важке ядро, що займає невеликий об’єм усередині атома, і негативно заряджені електрони. При цьому електронна хмара займає майже весь об’єм атома, але її маса є незначною порівняно з масо атома.
Сумарну кількість протонів і нейтронів в атомі називають нуклонним числом та позначають символом А. Кількість протонів у ядрі називають протонним числом та позначають символом Z (Рис. 2).
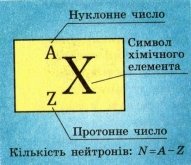
Рис.2.
Його легко визначити скориставшись періодичною системою хімічних елементів Д. І. Мендєлєєва. Порядковий номер елемента у періодичній таблиці відповідає кількості протонів у ядрі. Знаючи протонне і нуклонне числа ядра хімічного елемента, можна визначити кількість нейтронів (N) у ядрі цього елемента:
![]()
Наприклад: розглянемо Торій-234 (![]() ). А (нуклонне число) – 234, Z (протонне число) – 90, кількість нейтронів 234 – 90 = 144.
). А (нуклонне число) – 234, Z (протонне число) – 90, кількість нейтронів 234 – 90 = 144.
Дізнаємося про сильну взаємодію
Вам уже відомо. що електрони, маючи негативний заряд, утримуються навколо позитивного ядра завдяки електрохімічній взаємодії. Але яким чином у складі одного ядра і на дуже близькій відстані один від одного утримуються протони, адже однойменно заряджені частинки відштовхуються?
Фізики з’ясували, що всі частинки всередині ядра притягуються одна до одної, причому байдуже які: протон до протона, протон до нейтрона, нейтрон до нейтрона. І це відбувається завдяки виду, яка набагато сильніша, ніж електромагнітне виштовхування протонів. Саме тому взаємодію нуклонів називають сильною взаємодією.
4.Ізотопи
Ізотопи — нукліди одного і того самого хімічного елементу, які мають різну атомну масу.
Ізотопи позначають тими самими символами, що і хімічний елемент, додаючи зверху з лівого боку символу число, що показує масу даного ізотопу, виражену у вуглецевих одиницях, наприклад, ізотопи хлору позначають: ![]() Cl і
Cl і ![]() Cl, чи масове число слідує за назвою чи символом елементу, наприклад: уран-233 чи Pu-239.
Cl, чи масове число слідує за назвою чи символом елементу, наприклад: уран-233 чи Pu-239.
Ізотопи даного хімічного елементу мають однаковий заряд атомного ядра, тобто один порядковий номер, і займають те ж саме місце в періодичній системі, мають однакову кількість протонів в ядрі атома, але відрізняються один від одного кількістю нейтронів.
V. Закріплення нового матеріалу.
1.Фізичний диктант.
- Хто запропонував першу модель атома? (Дж. Томсон)
- Що являє собою перша модель атома? (Позитивно заряджена куля, у якій розташовані електрони)
- Хто досліджував структуру атома? (Резерфорд)
- Якими частинками бомбардувалася золота фольга в досліді Резерфорда? (α-частинками)
- Як відхилялася більшість частинок, коли проходили крізь фольгу? (Більшість частинок не відхилялася)
- Чи відхилялися які-небудь частинки на кут більше 90º, пройшовши крізь шар речовини? (Відхилялися, але їх було дуже мало)
- Якою частинкою може бути відкинута назад α-частинка? (Позитивно зарядженою частинкою великої маси)
- Який заряд має α-частинка? (Позитивний)
- Чому приблизно дорівнює маса α-частинки? (8000 мас електрона)
- Із чого складаються молекули? (З атомів)
- Який знак має заряд ядра? (Позитивний)
- Які частинки рухаються навколо ядра? (Електрони)
2.Розв’язування задач
Задача №1.Використовуючи періодичну систему хімічних елементів Менделєєва.
І варіант. Опишіть будову атомів Алюмінію,Ванадію.
ІІ варіант. Опишіть будову атомів Хлору,Радону.
Задача № 2.У ядрі деякого атома міститься 55 протонів. Який це елемент?
3. Робота з підручником. Контрольні запитання.
VІ. Підведення підсумків уроку. Виставлення оцінок
Вправа «Мікрофон»
Закінчити речення:
Сьогодні на уроці мені сподобалося….
Я зрозумів…..
VІІ. Домашнє завдання.
1.Опрацювати § 33,34.
2.Підготувати повідомлення на тему «Життєвий шлях Е.Резерфорда»
1


про публікацію авторської розробки
Додати розробку
