Урок 8 клас. Хімічні властивості кислот
1
Методична розробка уроку
Урок № Клас 8 Дата___
Тема: Хімічні властивості кислот: дія на індикатори, взаємодія з металами. Ряд активності металів. Реакції заміщення. Заходи безпеки під час роботи з кислотами
Навчальна мета: з’ясувати хімічні властивості кислот, поняття «реакції заміщення», пояснити використання індикаторів для визначення кислотного середовища;
продовжити знайомство з електрохімічним рядом напруг металів;
з’ясувати суть реакції заміщення на прикладі взаємодії кислот з металами;
продовжити роботу над закріпленням правил техніки безпеки під час роботи з кислотами;
Розвивальна мета: розвивати хімічну мову.
Виховна мета: виховувати інтерес до вивчення хімії.
Базові поняття і терміни: кислоти, ряд активності металів, реакції заміщення.
Тип уроку: комбінований.
Девіз уроку: Просто знати – ще не все, знання потрібно використовувати. (І. Гете)
Методи форми та прийоми роботи: словесні (фронтальна бесіда), індивідуальні, практичні (виконання вправ), інтерактивні, методи контролю.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, ряд активності металів.
Структура уроку:
Організаційний етап
Актуалізація опорних знань, перевірка домашнього завдання (10 хв)
Мотивація навчальної діяльності (2хв)
Вивчення нового матеріалу (19 хв)
Закріплення нового матеріалу (9 хв)
Підбиття підсумків уроку (3 хв)
Домашнє завдання (диференційоване) (1 хв)
Хід уроку
Організаційний етап
Привітання, перевірка присутніх.
Шановні учні, сьогодні на уроці ми працюватимемо разом, я розраховую на вашу підтримку та допомогу. Кожному з вас я хочу побажати УСПІХУ! І не тільки на уроках хімії. Усе людське життя - постійне бажання досягти успіху у вирішенні нових питань та проблем. І хочу щоб ви завжди вміли:
Не просто слухати, а чути
Не просто дивитися, а бачити
Не просто відповідати, а міркувати
Дружно і плідно працювати
Актуалізація опорних знань, перевірка домашнього завдання
. Скажіть будь ласка яку загальну тему зараз вивчаємо? ( неорганічні сполуки)
2. На які класи розділяють неорганічні сполуки?( оксиди, кислоти, основи, солі.)
2. Як класифікують основні класи?
( солетворні оксиди, несолетворні оксиди, основи, кислоти, солі,…)
4. Про які класи неорганічних речовин ми говорили детальніше. (оксиди, кислоти)
Вправа “Доповни схему” сл. 2-3
Гра « Вірю не вірю»
|
Вода – найпоширенішій на землі оксид. |
|
|
Оксиди – це складні речовини до складу яких входить гідроген. |
|
|
Валентність кислотного залишку визначається за кількістю атомів гідрогену. |
|
|
Оксиди поділяють на основні і кислотні. |
|
|
Кислоти –це тверді речовини. |
|
|
Кислоти –це складні речовини, які містять атоми оксисену і кислотного залишку. |
|
|
Оксигеновмісні кислоти не містять в своєму складі оксигену. |
|
|
Основність кислот визначається за кількістю атомів гідрогену. |
|
|
Безоксигеновмісні кислоти не містять в своєму складі оксигену. |
|
Робота в програмі wordwall https://wordwall.net/uk/resource/54078252
Встановіть відповідність
Оксид
CO2
P2O5
SO2
SiO2
SO3
Кислота
H2SO4
H2SiO3
H3PO4
H2CO3
H2SO3
Мотивація навчальної діяльності сл. 5
Казка "Хлоридна кислота у країні Металів"
Одного разу потрапила хлоридна кислота у країну Металів. Метали жили окремими вулицями і не спішили зустрічатися з кислотою. Навпаки, більшість із них, почувши про появу кислоти, позакривались у своїх будинках, щоб кислота не змогла з ними зустрітися. Тільки метали однієї вулиці сміливо пішли на зустріч гості. Це були представники вулиці "Неактивних металів". Самою гостинною була Мідь. Вона зовсім не боялася кислоти. Але кислоті стало сумно в такій компанії, і вона вирушила далі…
Пройшовши вулицею, вона потрапила у гості до Цинку. Але враз відчула якесь шипіння і зрозуміла, що перетворюється на іншу речовину. Не сподобалось їй і тут гостити і вона пішла далі.
І тут вона побачила будиночок: такий сріблястий, охайний. Там проживав Магній. І їх вмить захотілося побачити - а що там у середині. Як тільки вона переступила поріг, як відчула страшенне шипіння, в неї миттєво піднялася температура, ще секунда і все… Тут кислота миттєво зачинила двері і побігла звідти скільки було сили. Довго вона бігла не озираючись. І зупинилася лише біля знаку "Обережно, лужні метали". Це вже повинно було насторожити кислоту. Але вона була норовиста, самовпевнена і не звернула уваги на попередження. Тільки наблизилась до будиночка Натрію, як вмить і загинула наша необережна кислота.
Отже, і ми повинні пам’ятати, як кислоти відносяться до металів і як потрібно з ними поводитися, щоб не сталося лиха.
Проблемне запитання
- Про що свідчить зміна забарвлення чаю після додавання соку лимона ?
Отже, ви вже зрозуміли, що тема сьогоднішнього уроку : “Кислоти. Хімічні властивості кислот.”
Запишемо в зошити сьогоднішню дату та тему уроку.
Хімічні властивості кислот: дія на індикатори, взаємодія з металами. Ряд активності металів. Реакції заміщення.
Мета:
з’ясувати хімічні властивості кислот, поняття «реакції заміщення», пояснити використання індикаторів для визначення кислотного середовища;
продовжити знайомство з електрохімічним рядом напруг металів;
з’ясувати суть реакції заміщення на прикладі взаємодії кислот з металами;
продовжити роботу над закріпленням правил техніки безпеки під час роботи з кислотами;
Вивчення нового матеріалу
Фізичні й хімічні властивості кислот
Всі кислоти розчиняються у воді (крім кислоти H2SiO3), у багатьох випадках – необмежено, тобто змішуються з водою в будь-яких співвідношеннях з утворенням розчинів. Під час розчинення деяких кислот виділяється значна кількість теплоти.
Вам відомо, що безоксигенові кислоти є водними розчинами газів – сполук неметалічних елементів VI і VII груп із Гідрогеном (наприклад, H2S, HCl). Ці гази виділяються зі своїх розчинів навіть за звичайних умов.
Леткою, тобто такою, що переходить у газуватий стан за помірного нагрівання, є нітратна кислота HNO3. Леткі кислоти мають запах.
Ортофосфатна кислота Н3РО4, ортоборатна (борна) Н3ВО3, металисікатна H2SiO3 – тверді речовини. Вони, а також сульфатна кислота H2SO4 є нелеткими).
Карбонатна і сульфідна кислоти існують лише у водному розчині. Відповідні оксиди взаємодіють із водою неповною мірою, а кислоти, що утворюються, частково розкладаються на оксиди і воду:
![]()
![]()
Більшість кислот – токсичні речовини. Вони спричиняють серйозні отруєння, опіки шкіри. Тому працювати з кислотами, як і з лугами, потрібно обережно, дотримуючись правил безпеки. При потраплянні розчину кислоти на руку слід змити його водою, обробити шкіру розбавленим розчином харчової соди (для знешкодження залишків кислоти) і знову промити водою.
Здатність кислот реагувати з іншими речовинами значною мірою залежить від їх активності, стійкості, леткості, розчинності у воді. На це звертатимемо увагу, розглядаючи хімічні властивості кислот.
Кислоти виявляють різну хімічну активність. Дуже активні кислоти називають сильними, а малоактивні – слабкими. Є ще й кілька кислот середньої сили.
![]()
![]()
![]() HCl HNO3 H2SO4 HF H2SO3 H3PO4 H2S H2CO3 H2SiO3
HCl HNO3 H2SO4 HF H2SO3 H3PO4 H2S H2CO3 H2SiO3
сильні кислоти кислоти середньої сили слабкі кислоти
З курсу хімії 7 класу ви вже знаєте що індикатори мають здатність змінювати своє забарвлення в залежності від середовища в яке вони потрапляють
Кислоти у водних розчинах змінюють забарвлення індикаторів.
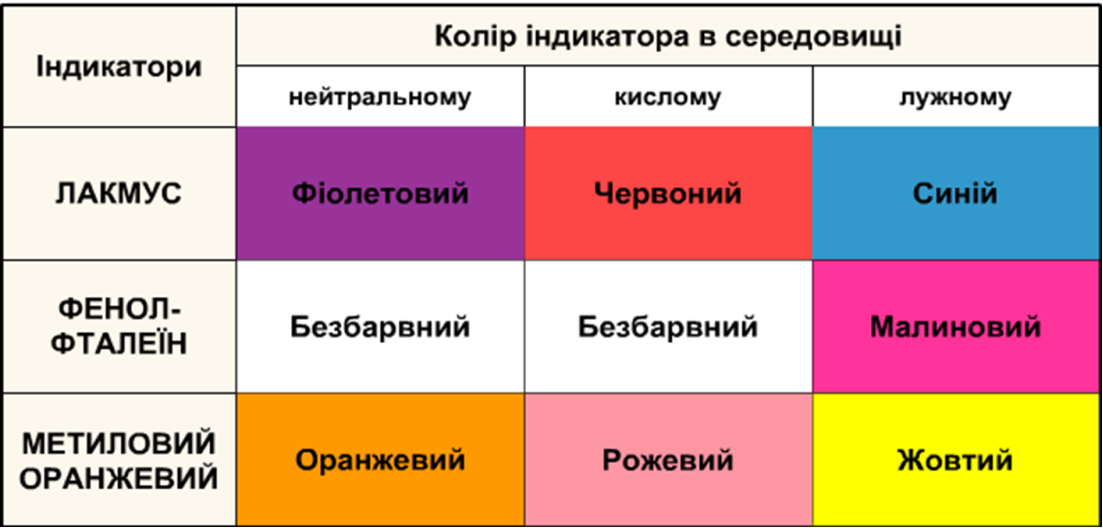
22 сл Лабораторний дослід.1 Дія кислот на індикатори
В три пробірки акуратно наливаємо по 1 мл розчину хлоридної кислоти. У одній з пробірок змочуємо скляну паличку розчином кислоти й торкаємося нею до універсального індикаторного папірця. Як змінюється колір індикатора?
В одну пробірку з розчином кислоти додаємо 1-2 краплі розчину метилового оранжевого, у другу – стільки ж розчину лакмусу, а в третю – фенолфталеїну.
На підставі спостережень заповнюємо таблицю.
|
|
Універсальний індикаторний папір |
Метиловий оранжевий |
Лакмус |
Фенолфталеїн |
|
Нейтральний |
|
Оранжевий |
Фіолетовий |
Безбарвний |
|
HCl |
|
|
|
|
|
|
|
|
|
|
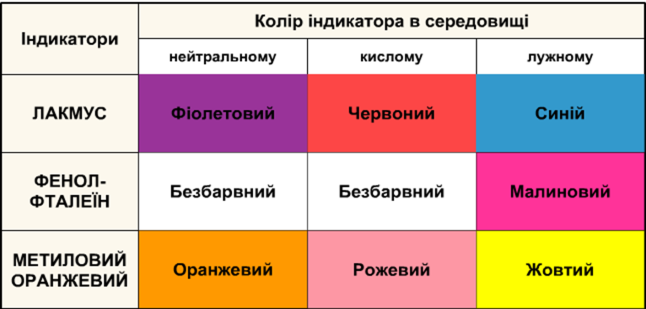
Висновок. У розчинах кислот універсальний індикаторний парір та метиловий оранжевий набуває червоного забарвлення, лакмус – рожевого. Отже, розчини кислот можна визначити з допомогою універсального індикатора, метилоранжу або лакмусу.

![]()
Лакмус враз тут засмутився,
Червоніє, весь змінився,
Ось таке видовище,
Яке це середовище? (Кислотне)
Майже всі метали окиснюються кислотами . характер взаємодії з кислотою залежить від активності металу від його властивостей а також концентрації кислоти
Усі безоксигенові кислоти, сульфатна кислота (у розбавленому розчині) та деякі інші реагують із металами з виділенням водню й утворенням солей:
![]()
2 Al + 6 HCl → 2 AlCl3 + 3 H2 ↑;
![]()
Zn + H2SO4 (розб.) → ZnSO4 + H2 ↑
Під час деяких реакцій атоми металічного ел емента, які містяться в простій речовині, заміщують атоми Гідрогену у складній речовині.
емента, які містяться в простій речовині, заміщують атоми Гідрогену у складній речовині.
Реакцію між простою і складною речовинами, у результаті якої утворюються нові проста і складна речовини, називають реакцією заміщення.
Лабораторний дослід.2 Взаємодія хлоридної кислоти з металами
Розглянемо, як взаємодіють кислоти з металами.
Для експерименту в три пробірки наливаємо хлоридну кислоту; у першу додаємо шматочки мідного дроту, у другу – гранули цинку, у третю – магнієву стружку.
Чому метали неоднаково реагують із кислотою?

Це пов’язано з властивостями металів. Микола Миколайович Бекетов – український вчений хімік розташував метали відповідно до їх активності в ряд від найсильніших до найслабших, на підставі вивчення реакцій металів із кислотами і солями. Цей ряд так і називається – ряд активності металів. (Розглядаємо таблицю, знаходимо рядактивності металів у підручнику.) Водень серед металів перебуває не випадково. Він розділяє метали на активні, які витісняють водень із розчинів кислот,і ті, що не взаємодіють із розчинами кислот і водень не витісняють.
активні метали метали середньої сили малоактивні метали
![]()
![]()
![]()

Запишемо рівняння реакцій:
Cu +HCl ≠
Zn + 2 HCl → ZnCl2 + H2
Mg + 2 HCl → MgCl2 + H2
Укажіть тип реакції. (Реакція заміщення)
Увага! Нітратна кислота по-особливому реагує з металами. Водень не витісняється жодним із металів, наприклад:
Zn + 4HNO3→Zn(NO3)2+ 2H2O + 2NO2
Усі метали реагують з кислотами з виділенням водню Н2, окрім металів, які знаходяться в ряду активності металів після Н, окрім кислот-окисників: H2SO4 (конц.), HNO3 (розб.), HNO3 (конц.), H2SiO3.
Закріплення вивченого матеріалу
Дописати рівняння реакцій:
Mg + H3PO4 →
Na + HCl →
Fe + H2SO4 →
Zn + H2SO4 →
Ag + H2SO4 →
Hg + HCl →
Al + H3PO4 →
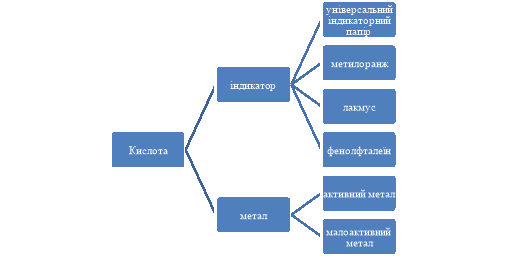
Для закріплення отриманих на уроці знань, створюємо разом з учнями ментальну карту.
Підбиття підсумків уроку
Для підбиття підсумків уроку можна використати інтерактивну технологію колективного групового навчання «Незакінчене речення». Пропонуємо учням продовжити речення: «Найважливішим відкриттям на цьому уроці для мене було…». Дати відповідь на питання, які завдання виявилися складними для розв’язання, які складними.
Домашнє завдання
Підручник П. П. Попель, Л.С. Крикля Хімія 8 клас
Опрацювати § 30, с.159 – 164, виконати завдання №235, 238, *241, с.167.
*Виконати домашній експеримент «Дія на сік буряка лимонного соку, розчину харчової соди, мильного розчину»
- «Тест-тренажер»
1. Вибрати формулу оксиду:
1. NaCl; 2. СО2;
3. Са(ОН)2; 4. НNO3
2. Вибрати ряд, в якому знаходяться тільки формули кислотних оксидів:
1. Na2O; SO2, CuO, Al2O3;
2. BaO, SО3, SО2, N2O5;
3. CO2, P2O5, SO3, SiO2,
4. FeO, ZnO, P2O5, CO.
3 Серед наведених оксидів основним є:
1. CO2;
2. FeO;
3. SiО2;
4. P2O5.
4. «Знайди помилку». Яка формула написана невірно:
1. SO3;
2. P2O5;
3. NaO2;
4. СO2.
5. Який оксид утворює сульфатну кислоту H2SO4:
1.S2O
2.SO2
3.SO3
4.S2O3
6. Серед наведених кислот виберіть двохосновну:
1.HCl;
2. H2SO4;
3. HNO3;
4.H3PO4.
7. Серед наведених кислот виберіть безоксигенову:
1. H2SO4;
2. HBr;
3. HNO3;
4.H2CO3.
8. Валентність кислотного залишку сульфатної кислоти:
1. I 2. III
3 IV 4 II
Гра « Вірю не вірю»
|
Вода – найпоширенішій на землі оксид. |
|
|
Оксиди – це складні речовини до складу яких входить гідроген. |
|
|
Валентність кислотного залишку визначається за кількістю атомів гідрогену. |
|
|
Оксиди поділяють на основні і кислотні. |
|
|
Кислоти –це тверді речовини. |
|
|
Кислоти –це складні речовини, які містять атоми оксисену і кислотного залишку. |
|
|
Оксигеновмісні кислоти не містять в своєму складі оксигену. |
|
|
Основність кислот визначається за кількістю атомів гідрогену. |
|
|
Безоксигеновмісні кислоти не містять в своєму складі оксигену. |
|
Дописати рівняння реакцій:
Mg + H3PO4 →
Na + HCl →
Fe + H2SO4 →
Zn + H2SO4 →
Ag + H2SO4 →
Hg + HCl →
Al + H3PO4 →









про публікацію авторської розробки
Додати розробку
