Урок "Алюміній: фізичні та хімічні властивості". 11 клас (стандарт).
Тема: Алюміній: фізичні та хімічні властивості.
11 клас (стандарт).
Мета: повторити особливість будови атома Алюмінію; ознайомити з поширенням Алюмінію у природі; розглянути фізичні та хімічні властивості алюмінію, його оксиду і гідроксиду; довести амфотерність гідроксиду алюмінію.
Тип уроку: комбінований.
Міжпредметні зв’язки: історія, географія, література.
Обладнання:
технічні засоби: інтерактивна дошка, комп’ютер;
для демонстрацій: алюмінієва ваза, алюмінієвий дріт, виделка, ложка, каструля, бляшанка з-під оливок, тубус з зубною пастою, шоколад, фольга для запікання;
для лабораторних дослідів: штативи з пробірками, реактиви (1група- розчини алюміній хлориду, калій гідроксиду, сульфатної кислоти та натрій гідроксиду; 2 група- розчини алюміній нітрату, калій гідроксиду, хлоридної кислоти та натрій гідроксиду; 3 група- розчини алюміній сульфату, натрій гідроксиду, нітратної кислоти та калій гідроксиду) , колекції природних сполук алюмінію;
на партах учнів: інструкції з техніки безпеки, картки з фрагментами літературних творів (спогади професора В.Полосіна, казка про двоєдушний Алюміній) і науковим текстом (фрагмент підручника М.Фримантла Хімія в дії ).
Х І Д У Р О К У .
І. Організаційний момент
ІІ. Введення в нову тему
- Відгадайте загадку (слайд 1 презентації):
Це - найпоширеніший метал в земній корі, але в чистому вигляді його отримали лише 150 років тому, і протягом наступних 60 років він був великою рідкістю і цінувався дорожче за золото. В 1854р. ціна 1 кг цього металу складала 1200 рублів (в 270 разів дорожче за срібло), а в 1899р. – 1 рубль. Також відомо, що син російського царя мав виготовлене з цього металу брязкальце, а Наполеон ІІІ користувався посудом з того самого металу, коли влаштовував прийоми для найдорожчих гостей, навіть в 1889 році, коли Д.І.Менделєєв знаходився у Лондоні, йому, в знак визнання видатних досягнень в розвитку хімії, було подаровано ваги зроблені з золота та цього металу.
- Що це за метал?
- Що спільного між предметами на столі? (Вони виготовлені з алюмінію). Герой нашого уроку звичайний алюміній.
ІІІ. Вивчення нового матеріалу
- Поширеність Алюмінію у природі
- Розгляньте схему1 ,,Поширеність хімічних елементів у земній корі ”.
(слайд 2 презентації.)
Схема 1
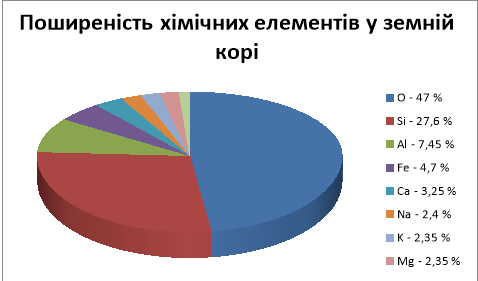
- Яке місце займає алюміній? (Трете взагалі і перше серед металів.) За
рядом напруг металів з’ясуйте, чи зустрічається алюміній у природі у вигляді самородків? (Тільки у вигляді мінералів, хоча є відомості о незначних кількостях знайденого чистого алюмінію в деяких породах та в місячному ґрунті )
- Характеристика алюмінію за положенням у ПСХЕ. Будова атома.
Охарактеризуйте його за положенням в ПСХЕ Д.І.Менделєєва . (Опитування за слайдом 3 презентації)
- Порядковий номер алюмінію ______
- Алюміній – елемент _____ групи, _______ підгрупи
- Заряд ядра атома алюмінію дорівнює _____
- Ядро атома алюмінію містить ______ протонів
- Ядро атома алюмінію містить ______ нейтронів
- В атомі алюмінію ______ електронів
- Атом алюмінію має _____ енергетичних рівня
- Електронна оболонка атома алюмінію має будову _______
- На зовнішньому рівні міститься _____ електрона
- Електронна будова йону алюмінію ________
- Валентність алюмінію в сполуках дорівнює _________
- Ступінь окиснення атома алюмінію в сполуках дорівнює ________
- Фізичні властивості алюмінію
- Прочитайте фрагмент з роману М.Г.Чернишевського ,,Що робити?’’,
( 1863 р.), де описано сон головної героїні (слайд 4 презентації):
,, ... Але які це підлоги і стелі? З чого ці двері і рами вікон? Що це таке? срібло? платина? Та й меблі майже вся така ж, - меблі з дерева тут лише каприз, вона тільки для різноманітності, але з чого ж вся решта меблів, стелі й підлоги? ,, Спробуй посунути це крісло "? - каже старша цариця. Ці металеві меблі легше наших горіхових. Але що ж це за метал? Ах, знаю тепер, Саша показував мені таку дощечку, вона була легка, як скло, і тепер уже є такі сережки, брошки, так, Саша говорив, що рано чи пізно алюміній замінить собою дерево, може бути і камінь. Але як же все це багато! Скрізь алюміній і алюміній ... Ось в цьому залі половина підлоги відкрита, тут і видно, що він з алюмінію. ''
- Опишіть за текстом фізичні властивості алюмінію. (Сріблясто-білий,
легкий, пластичний, з алюмінію можливо витягнути дріт). Де це застосовується? ( Літакобудування, машинобудування, виробництво упаковки, електротехніка).
- Які властивості ще не назвали? (Висока електро- і теплопровідність).
Високу теплопровідність можна довести зануривши звичайну ложку з алюмінію у гарячу воду. Ще одна властивість, де алюмінію нема рівних, - відбивання світла, де це застосовується? (виробництво жалюзей).
- Що з цього сну збулось, а що ні?
- Добування алюмінію
- Існує легенда (слайд 5): ,, Два тисячоліття тому римському імператору
Тіберію невідомий подарував дуже легку вазу, виготовлену з металу, схожого на срібло. Майстер розповів, що цей метал він добув з глинистої землі. Тіберій злякався, що новий метал знецінить золото та срібло, і наказав відрубати майстрові голову, а його лабораторію знищити, щоб ніхто не дізнався про спосіб добування нового металу.
- Алюміній до XX ст. був дуже дорогим металом, а нині в кожному домі є алюмінієві речи, які коштують зовсім небагато. Чому так сталося?(Економічний промисловий спосіб добування винайшов молодий американській дослідник Чарльз Мартін Хол лише 23 лютого 1886 року. А через два місяці 23 квітня француз Поль Еру отримав патент на аналогічне відкриття , яке він зробив незалежно і практично одночасно. Вражаюче і інше : вчені народились в 1863 і померли в 1914 роках. Перші кульки алюмінію і досі зберігаються в музеї Американської алюмінієвої компанії, а Холу встановлено пам’ятник, повністю виготовлений з алюмінію.
(Цікавинка - У Китаї є гробниця відомого полководця Чжоу Чжу, померлого на початку III століття. Порівняно недавно деякі елементи орнаменту гробниці були піддані спектральному аналізу. Результат виявився настільки несподіваним, що аналіз довелося кілька разів повторити. І кожен раз неупереджений спектр незаперечно свідчив про те, що сплав, з якого древні майстри виконали орнамент, містить 85% алюмінію. Яким чином вдалося отримати в III столітті цей метал висловили припущення німецьки хіміки на прикінці 1970 років.Вони нагріли суміш глини з вугільним порошком і сіллю.Сіль була отримана з морської води. Через деякий час на поверхні тигля з’явився шлак з кульками алюмінію)
- Розгляньте колекції природних сполук алюмінію. На жаль, в Україні
родовища бокситів невеликі.
- Де в Україні виробляють алюміній? (слайд 6) ( ВАТ Запорізький
виробничий алюмінієвий комбінат, ООО Миколаївський глиноземний комбінат, СП «Інтерсплав»).
- Хімічні властивості алюмінію
- Чи можна на ваш погляд віднести алюміній до активних металів.( Різні
відповіді - алюмінієвий посуд і дроти не реагують з водою, а за положенням в ряду напруг металів він повинен виявляти високу хімічну активність). Пояснення – швидко вкривається оксидною плівкою.
- Виходячи з положення в ПСХЕ порівняйте активність алюмінію і
магнію, якій ми вивчали раніше. Чи співпадає ваш висновок з розташуванням елементів у ряді напруг металів?
- А тепер хімічний тренінг, тренуємо хімічну пам'ять – пригадайте, що
означає поняття « амфотерна сполука». З якими амфотерними сполуками ви
ознайомились у 8 класі?
- Щоб підтвердити амфотерність алюмінію і з’ясувати його хімічні
властивості заповнимо схему 2 (слайд 7 презентації).
Схема 2
![]() Неметали →
Неметали →
Оксиди
![]() металів →
металів →
![]() Кислоти →
Кислоти →
![]()
![]()
![]()
![]() Алюміній + Луги →
Алюміній + Луги →
Солі →
Вода →
- Працюємо по групах: 1 група (сильні учні) – самостійно, 2 і 3 групи за
підручником ( М.Савчин Хімія 11 клас) (Завдання на слайді 7):
1 група опрацьовує питання: ,,Взаємодія алюмінію з неметалами і оксидами металів”;
2 група - ,, Взаємодія алюмінію з кислотами і лугами ”;
3 група - ,, Взаємодія алюмінію з солями і водою ”.
(Представники груп заповнюють рівняннями реакцій схему на дошці. А інші учні роблять загальний висновок про хімічні властивості алюмінію – активний метал, захищений від окиснення оксидною плівкою, виявляє амфотерні властивості. Перевірка рівнянь реакції за слайдом 7 презентації. )
- Властивості алюміній оксиду
- Переходимо до сполук Алюмінію. Якій оксид він утворює?
- Для того щоб розглянути фізичні властивості алюміній оксиду пропо-
ную вам прочитати науковий текст (доданок 1) і заповнити за текстом схему 3 ( слайд 8 презентації):
Схема 3
Al2O3
Фізичні
![]() властивості:
властивості:
Корунд
Колір:

 .
.
Рубін Сапфір
Колір: Колір:
Домішки: Домішки:
(Далі завдання І варіанту – написати рівняння взаємодії алюміній оксиду з соляною кислотою, ІІ варіант пише рівняння взаємодії алюміній оксиду з натрій гідроксидом. Взаємоперевірка за слайдом 9 презентації, після чого учні роблять висновок про амфотерність алюміній оксиду.)
- Властивості алюміній гідроксиду
- А тепер, під час експериментальної частини розглянемо фізичні власти-
вості алюміній гідроксиду та доведемо його амфотерність. Працюємо по групах за інструктивними картками (слайд 10 презентації). ( Необхідно нагадати учням про техніку безпеки.)
Інструктивна картка
Завдання 1. Виконайте досліди:
1група. Отримайте алюміній гідроксид із розчинів алюміній хлориду і калій гідроксиду, опишіть фізичні властивості алюміній гідроксиду. Дослідіть, в якому з двох випадків: при доливанні розчину лугу в розчин солі чи навпаки - розчину солі у розчин лугу – з’являється осад, що не зникає вмить. Проведіть реакції, що підтверджують амфотерність алюміній гідроксиду, використовуючи розчини сульфатної кислоти та натрій гідроксиду.
2 група. Отримайте алюміній гідроксид із розчинів алюміній нітрату і калій гідроксиду, опишіть фізичні властивості алюміній гідроксиду. Проведіть реакції, що підтверджують амфотерність алюміній гідроксиду, використовуючи розчини хлоридної кислоти та натрій гідроксиду.
3 група. Отримайте алюміній гідроксид із розчинів алюміній сульфату і натрій гідроксиду, опишіть фізичні властивості алюміній гідроксиду. Проведіть реакції, що підтверджують амфотерність алюміній гідроксиду, використовуючи розчини нітратної кислоти та калій гідроксиду.
Завдання 2. Проаналізуйте результати дослідів у групі, зробіть загальний висновок. Напишіть рівняння здійснених реакцій у молекулярній та йонній формі.
( Представники груп пишуть рівняння на дошці і потім учні перевіря-
ють записи за слайдом 11 презентації.)
І\/. Закріплення матеріалу
- Чи збагатилися ваші знання про алюміній та його сполуки? Давайте
для закріплення напишемо диктант (слайд 12 презентації):
Фразеологічний диктант
- Алюміній знаходиться в періодичній системі в … групі … підгрупі.
- Алюміній у природі зустрічається в вигляді … .
3. Алюміній згоряє з утворенням … і розчиняється в … кислоті з утворенням… .
4. З ... алюміній буде реагувати лише після видалення … плівки.
5. Алюміній може витискувати залізо та мідь з розчинів їх … , тому що він … метал.
6. Його … і … мають … властивості, тому що реагують з … і … .”( Далі іде взаємоперевірка за слайдом презентації. )
- І нарешті маленька вікторина, щодо застосування алюмінію в побуті (слайд 13).
- Які страви можна готувати в алюмінієвому посуді, а які – ні?
- Чи можна використовувати алюмінієву каструлю для скисання молока?
- В якому чайнику вода закипить швидше – в емальованому чи в алюмінієвому - і чому?
- Якою стороною треба використовувати алюмінієву фольгу, щоб вона зберігала продукти охолодженими, а якою - щоб сприяла скорішому їх приготуванню в духовці?
.
\/. Домашнє завдання (слайд14):
- вивчити §26 підручника (автор М.Савчин);
- прочитати спогади професора В.Полосіна (доданок 1), відповісти
на питання, написати відповідне рівняння реакції;
- ( додатково для сильних і за бажанням для інших учнів) прочитати
казку (доданок 2), проілюструвати її відповідними рівняннями реакцій.
- Щоб осмислити все побачене, почуте і виконане на нашому уроці, я
пропоную вам рефлексивний тест, спрямований на оцінювання ваших особистих дій
Рефлексивний тест
- Я пізнав (ла) багато нового.
- Мені це знадобиться у житті.
- На уроці було над чим поміркувати.
- На всі виникненні на уроці питання я отримав (ла) відповіді.
На уроці я працював (ла) сумлінно і мети уроку досягла
Доданок 1
,,…Оксид алюмінію (глинозем) … уявляє собою білу тверду сполуку, яка має температуру плавлення 2045оС … .
Безводні форми оксиду алюмінію утворюють в природних умовах мінерали групи корундів. Корунд – дуже тверда кристалічна форма оксида алюмінію. Його використовують в якості абразивного матеріалу, який за твердістю поступається лише алмазу. Великі та прозорі, нерідко кольорові, кристали корундів цінуються як дорогоцінне каміння. Чистий корунд не має кольору, але присутність в ньому невеликої кількості оксидів d-металів надає дорогоцінним корундам характерне забарвлення. Наприклад, червоний колір рубіну пояснюється присутністю в корунді йонів Cr3+, а синій колір сапфіру – присутністю йонів Co2+, Fe2+ i Ti4+. Внаслідок сплавлення глинозему з оксидами d-металів можна отримувати штучне дорогоцінне каміння, наприклад, штучний олександрит – сплав корунду зі сполуками ванадію і хрому ”.
Доданок 2
Спогади професора В.Полосіна
,,У післявоєнний час важко було дістати мило, і деяки люди почали варити його вдома.
Пам’ятаю, якось біля станції Раменське у вагонах було чути вигуки, відчувалося якесь напруження. Я побачив, що на підлозі тече якась рідина. Люди ходили по ній у валянках. Через деякий час в одного чоловіка розвалилися валянки, в іншого – бавовняна шинель.
Я відразу здогадався у чому справа, коли звернув увагу, як рідина руйнує бавовну.
Поруч зі мною сиділа літня жінка і дуже нервувала: з її алюмінієвого бідона витікала рідина. Я запитав, що вона везе. Вона відповіла…” ( Яку рідину везла літня жінка для приготування мила в домашніх умовах ? Як її треба було перевозити ?.)
Доданок 3
Казка про двоєдушний Алюміній.
Жив на світі хитрець-наглець на ім’я Алюміній. Його володіння знаходились між двома могутніми королівствами. В одному королівстві правив молодий життєрадісний король Натрій.
Усе в його королівстві було блакитним: чисте блакитне небо, глибокі прозорі озера і ріки, блакитні квіти на блакитних полях. І жили в королівстві веселі й добрі люди з блакитними очима. Працювати й жити в королівстві було легко, вільно і радісно. А це викликало сильну заздрість у керівництва іншого королівства - Сірки. Вона вся пожовтіла від заздрощів та злоби, інколи навіть починала плавитись від внутрішнього жару чи горіти ліловим полум’ям. Після веселого святкування дня народження сина Натрія її терпець урвавсь, і Сірка оголосила війну Натрію.
Натрій , який ніколи і нікому не бажав зла, за характером м’якій, як віск, хоч ножем ріж, не був готовий до війни. Він звернувся до Алюмінію: ,,Допоможи мені, ми ж родичі, метали.’’ Алюміній погодився, але вирішив зробити так, щоб обидва війська загинули, і він оволодів би обома королівствами.
І бій почався. Війська Натрія і Сірки билися, не жалкуючи сил, виділяючи велику кількість тепла. А Алюміній зі своїм військом все вигадував зручну позицію: якщо перемагало військо Натрія, він поспішав до нього, якщо військо Сірки, він переходив на його бік. Нарешті і Натрій і Сірка зрозуміли хитрощі Алюмінію. Обидва надіслали найсильніших вояків, яким наказали знищити негідника і зрадника.
Алюміній побачив, що з обох боків до нього наближаються два вершника, але нічого не зміг зробити. Незабаром два списа з силою встромилися в його безвільне тіло.
Література.
- Підласій І.П. Як підготувати ефективний урок. – К.: Рад. Шк.., 1989
- Ярошенко О.Г. Групова навчальна діяльність школярів: теорія і методика. – К.: Партнер, 1997.
- Руснак Т. Технології навчання біології //Біологія. Шкільний світ. – 2006. - №15
- Попіль П.П., Крикля Л.С. Хімія. 10 клас. – К., 2010
- Чернышевский Н.Г. Что делать? - Л.: Каменяр, 1989
- Габриелян О.С. Химия. 9 клас – М.: Дрофа, 2005
- Фримантл М. Химия в действии В 2-х ч. Ч. 2.: Пер. с англ..-М.:Мир,1991.
- Венецкий С.И. Рассказы о металлах. – М.: Металургия, 1985.

про публікацію авторської розробки
Додати розробку
