Урок "Біосинтез білка"
Тема уроку: Біосинтез білка
Навчальний предмет: біологія
Клас: 9-10
Мета уроку:
Сформувати предметні компетентності, розвивати ключеві компетентності; зрозуміти та вивчити поняття синтез білка, розглянути етапи синтезу білка, сформувати поняття транскрипція, трансляція, процесинг, сплайсинг, активація амінокислот, пострансляційна модифікація, поглибити знання учнів про генетичний код, матричний синтез, метаболізм клітини; розвивати логічне мислення, пізнавальний інтерес, уміння користуватися сучасними інформаційними технологіями, формувати навчально-пізнавальні компетенції, уміння порівнювати, аналізувати; виховувати ціннісне ставлення до свого здоров’я (порушення генетичної інформації).
Технічне обладнання та програмне забезпечення:
Комп’ютер під’єднаний до мережі Інтернет, смартфони та планшети з встановленим додатком «Сканер QR-кодов», віртуальний плакат до уроку (Thinglink), презентація до уроку (Prezi, Google), інтерактивні вправи (LearningApps), відео (YouTube).
Основні поняття й терміни: генетичний код, кодон, антикодон, триплет, транскрипція, трансляція, процесинг, сплайсинг, біосинтез.
Тип уроку: комбінований.
ХІД УРОКУ.
І.Організаційний момент (1 хв)
ІІ. Актуалізація опорних знань (10 хв)
- Фронтальна бесіда-опитування з класом.
- Що таке метаболізм?
- Які бувають види метаболізму?
- Назвіть приклади катаболізму?
- Назвіть приклади анаболізму?
-
 *Інтерактивна вправа 1 «Метаболізм» із застосуванням смартфонів та планшетів (вхід через QR-код ) http://LearningApps.org/watch?v=pbnh31p1a16
*Інтерактивна вправа 1 «Метаболізм» із застосуванням смартфонів та планшетів (вхід через QR-код ) http://LearningApps.org/watch?v=pbnh31p1a16
Постановка проблеми та оголошення теми уроку.
А чи належить синтез білка до процесів пластичного обміну?
Завдання уроку:
- з’ясувати, які основні етапи біосинтезу білка;
- з’ясувати, яка роль нуклеїнових кислот у цьому процесі;
- пригадати, що таке генетичний код, його властивості;
- з’ясувати, які органоїди і речовини клітини беруть участь у синтезі білка;
- *Вправа 2 «Що зображено на малюнку?»
- Нуклеїнові кислоти;
- Нуклеотиди ДНК;
- Нуклеотиди РНК;
- Реплікація;
- Амінокислота;
- Таблиця генетичного кода
III. Мотивація навчальної діяльності (3 хв)
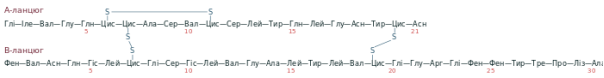
Інсулін — це невеликий білок, він складається із двох поліпептидних ланцюгів: А (21 амінокислота) та B (30 амінокислот). Молекула інсуліну містить три дисульфідні зв'язки: два із них сполучають між собою A та B-ланцюги, а третій розташований всередині A-ланцюга. Бичачий інсулін має таку первинну структуру:
Структура інсуліну майже не змінилась в еволюції вищих хребетних. Людський інсулін відрізняється від бичачого двома амінокислотними замінами в A-ланцюгу: у 8-му положенні треонін замість аланіну, а у 10-му ізолейцин замість валіну. Свинячий гормон ще ближчий до людського, він відрізняється всього однією амінокислотою: аланіном у 30-му положенні B-ланцюга замість треоніну.
IV. Вивчення нового матеріалу (20 хв)
http://prezi.com/czd_bv4qohal/?utm_campaign=share&utm_medium=copy&rc=ex0share
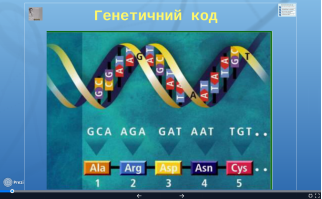
- Генетичний код.
Інформація про структуру кожного білка знаходиться у ядрі клітини у вигляді ДНК. Інформацію про первинну структуру білка містить ген - ділянка ДНК.
Генетичний код - це єдина для всіх живих організмів система збереження спадкової інформації в молекулах нуклеїнових кислот у вигляді послідовності нуклеотидів. Саме він визначає порядок розташування амінокислотних залишків у поліпептидному ланцюзі під час його синтезу.
У 1968р. М.В. Ніренберг, американський біохімік удостоєний Нобелівської премії за розшифрування генетичного колу.
Властивості генетичного коду
- Код однозначний. Кожна амінокислота кодується послідовністю з трьох нуклеотидів молекули ДНК, яка називається триплетом.
- Код універсальний. У всіх організмах одні й ті самі амінокислоти кодуються одними й тими ж кодонами (триплетами).
- Код є вироджений. Одна амінокислота може кодуватись більше, ніж одним триплетом.
Є 43 = 64 триплети, 20 амінокислот, 18 амінокислот кодуються від 2 до 6 триплетами, і лише 2 з них – одним триплетом. Надійність генетичного коду.
- Безперервність. Генетичний код не перекривається. Кодони (триплети) зчитуються один за одним.
У генетичному коді триплет АУГ- сигналізує про початок синтезу білка, а три триплети: УАА, УАГ, УГА - про припинення цього процесу,.
- Етапи біосинтезу білка
І етап – транскрипція.
Передача інформації про структуру білка з молекули ДНК на мРНК. Відбувається цей процес в ядрі.
Фермент РНК – полімераза роз'єднує подвійну спіраль ДНК. Потім на одному з її ланцюгів (матричному) за принципом комплементарності синтезується молекула мРНК, яка є точною копією цієї ділянки ДНК (одного гена). Копіюється тільки та частина ДНК, яка містить інформацію про потрібний білок. Отже ДНК є матрицею для мРНК.
ІІ етап – процесинг та сплайсинг.
Процес, що забезпечує дозрівання про-мРНК після транскрипції, при якому «вирізаються» інтрони і «зшиваються» екзони. Ці процеси з мРНК відбуваються відразу після зчитування інформації з ДНК, не відділяючись від неї.
Синтезована зріла мРНК відокремлюється від ДНК і крізь пори виходить з ядра в цитоплазму, а молекула ДНК відновлює свою структуру. Розміри мРНК залежать від обсягу інформації про розміри молекули білка, закодованої в ній.
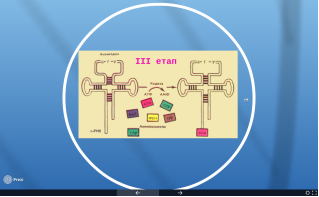
ІІІ етап – активація амінокислот.
Відбувається цей процес у цитоплазмі шляхом приєднання амінокислот до вільних тРНК, антикодони яких комплементарні кодону мРНК. Кожній з 20 відомих амінокислот відповідає певна тРНК. Оскільки багато амінокислот кодуються декількома триплетами, кількість різновидів тРНК зі своїми антикодонами більша за 20 (їх відомо близько 60). Цей процес є енергозалежним, оскільки на приєднання однієї амінокислоти до тРНК витрачається одна молекула АТФ.
ІV етап – трансляція (процес безпосереднього синтезу поліпептидних ланцюгів)
Спочатку відбувається ініціалізація: мала субодиниця рибосоми сполучається з мРНК та її стартовим кодон (АУГ) взаємодіє з антикодоном тРНК (Мет*). Велика субодиниця рибосоми приєднується до малої субодиниці. Утворюється ініціативний комплекс.
Далі починається елонгація – сам процес синтезу. До функціонального центру рибосоми підходить друга молекула тРНК з амінокислотою. Її антикодон взаємодіє з кодоном мРНК. Перша молекула тРНК залишає функціональний центр. Залишки амінокислот за допомогою пептидного зв'язку сполучаються у дипептид. Рибосома робить крок, що дорівнює одному триплету. До ділянки функціонального центру рибосоми, яка звільнилася, надходить третя молекула тРНК. У цей час антикодон третьої тРНК взаємодіє з кодоном мРНК. Молекула білка, що синтезується, складається вже з трьох залишків амінокислот. Таким чином процес продовжується далі. Для приєднання однієї амінокислоти під час трансляції потрібно 0,2 с.На приєднання одного амінікослотного залишку до молекули білка витрачається енергія розщеплення однієї молекули АТФ.
Якщо рибосома досягає одного з триплетів стоп-кодонів (УАА, УАГ, УГА) синтез білка припиняється. Цей процес називається термінацією.
Велика і мала субодиниця роз’єднаються і залишають мРНК, звільняються й молекули тРНК та синтезована молекула білка.
Часто мРНК з’єднується не з однією, а з декількома рибосомами. Такий комплекс називається полірибосомою або полісомою, на якому одночасно може синтезуватись декілька молекул певного білка.
V етап - посттрансляційна модифікація.
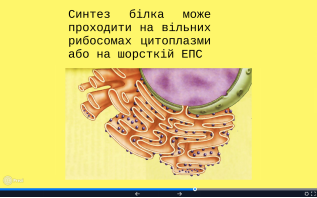
Білок набуває своєї природної конформації вторинної, третинної, четвертинної структур. У цей час до молекули можуть приєднуватися небілкові складові (ортофосфатні, карбоксильні групи, вуглеводи, ліпіди), лише після цього білок стає функціонально активним. Цей процес відбувається в цитоплазмі, гранулярній ЕПС, комплексі Гольджи. Середня тривалість існування синтезованої білкової молекули – близько двох діб.
Отже, синтез білка – це сукупність ферментативних реакцій із затратою енергії. Це реакції матричного синтезу, де одна молекула є основою для синтезу іншої: ДНК матриця- РНК матриця- білок
V. Узагальнення та систематизація знань (10 хв)
Розуміння механізму синтезу білка – це результат тривалої складної роботи вчених. Це блискуче досягнення є одним з основ біологічної науки.
- Перегляд та коментування відео «Нуклеїнові кислоти в синтезі білка»
https://www.youtube.com/watch?v=6QzTMHybE1k
-
Побудова асоціативного куща від слова ГЕН

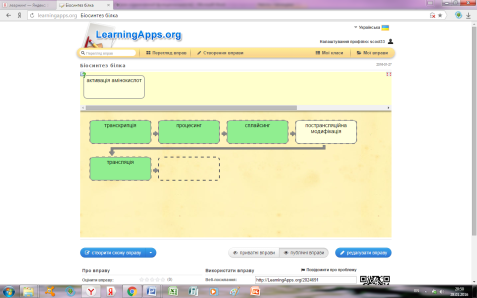
- Виконання вправи «Біосинтез білка» http://LearningApps.org/view2024691

VІ. Підсумки уроку(оцінки) та домашнє завдання (1 хв)
Вивчити відповідний § підручника.
Задача: Яка швидкість синтезу білка в організмів, якщо на утворення інсуліну з 51 амінокислоти необхідно 7,3 с.? (51:7,3 = 7 амінокислот/1 с)
Вправа «Синтез білка» http://LearningApps.org/view2024742 
Додаток 1
*Інтерактивна вправа 1 «Метаболізм»



Додаток 2
*Вправа 2 «Що зображено на малюнку?»






Додаток 3
*Навчальна презентація «Біосинтез білка»











Додаток 4
Відео «Нуклеїнові кислоти в синтезі білка»

Додаток 5
*Інтерактивна вправа 3 «Біосинтез білка»


Додаток 6
*Інтерактивна вправа 4 «Побудова асоціативного куща від слова ГЕН»

Додаток 7
*Інтерактивна вправа 5 «Синтез білка»


Додаток 8
*Віртуальний плакат «Біосинтез білка»
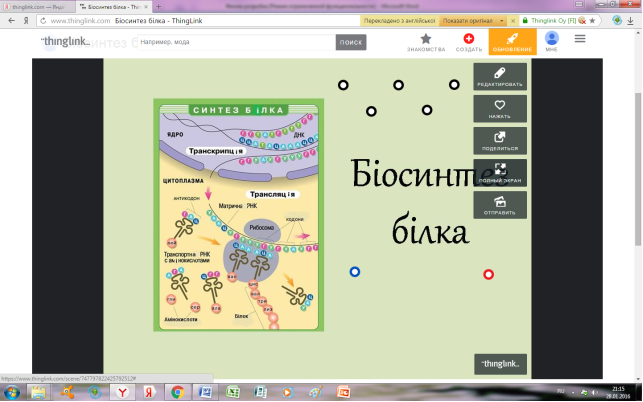
Додаток 9
Задача
Яка швидкість синтезу білка в організмів, якщо на утворення інсуліну з 51 амінокислоти необхідно 7,3 с.? (51:7,3 = 7 амінокислот/1 с)
Додаток 10
*Вправа 6
Інсулін — це невеликий білок, він складається із двох поліпептидних ланцюгів: А (21 амінокислота) та B (30 амінокислот). Молекула інсуліну містить три дисульфідні зв'язки: два із них сполучають між собою A та B-ланцюги, а третій розташований всередині A-ланцюга. Бичачий інсулін має таку первинну структуру:
Структура інсуліну майже не змінилась в еволюції вищих хребетних. Людський інсулін відрізняється від бичачого двома амінокислотними замінами в A-ланцюгу: у 8-му положенні треонін замість аланіну, а у 10-му ізолейцин замість валіну. Свинячий гормон ще ближчий до людського, він відрізняється всього однією амінокислотою: аланіном у 30-му положенні B-ланцюга замість треоніну.
- Запишіть амінокислотну послідовність людського та свинячого інсуліну.
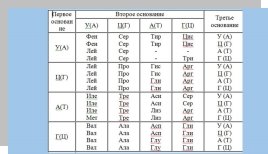
- Користуючись таблицею генетичного коду запишіть мРНК для А-Ланцюга.
- Користуючись правилом комплементарності запишіть послідовність нуклеотидів для ДНК.
1


про публікацію авторської розробки
Додати розробку