Урок "Добування і застосування вуглеводнів", 10 клас
Тема: Вуглеводні.
Тема уроку: Добування і застосування вуглеводнів.
Мета уроку:
навчальна: розширити знання учнів про властивості вуглеводнів, ознайомити з основними способами добування вуглеводнів; сформувати в учнів вміння складати рівняння реакцій; сприяти формуванню судження про роль теорії в системі наукових знань;
розвиваюча: усвідомлювати необхідність збереження довкілля під час одержання вуглеводнів; оцінювати екологічні наслідки порушення технологій добування вуглеводнів та їхніх похідних;
виховна: виховувати усвідомлене ставлення про вплив на здоров’я людей та довкілля та значущість правильного добування вуглеводнів;
корекційна: розвивати вміння робити логічні висновки; активізувати пізнавальну діяльність, розвивати інтерес до вивчення предмету, формувати уміння працювати самостійно; вести діалог.
Тип уроку: урок засвоєння нових знань.
Методи навчання: словесні (бесіда, пояснення, розмірковування), наочні (демонстрація), практичні (виконання вправ).
Ключові компетентності: спілкування державною мовою (популяризація хімічних знань); математична (використання логічного мислення, зокрема, для знаходження способів одержання вуглеводнів); уміння вчитися впродовж життя (осмислення результатів самостійного вивчення хімії).
Обладнання: зразки вуглеводнів, зразки продуктів, отриманих з них.
ХІД УРОКУ
Усне опитування:
- Порівняйте арени з алканами та алкенами, алкени з алкінами: що подібного і які відмінності?
- Охарактеризуйте просторову будову молекули бензену.
- Чому арени виділили в окремий клас вуглеводнів?
- Які основні відмінності у властивостях аренів та алкенів, аренів та алканів?
- Як відрізнити бензен від алканів? Бензен від алкенів?
Проблемне питання
Яким чином пов’язані між собою вивчені нами класи вуглеводнів? Чи можливо здійснювати перетворення речовини одного класу в інший? Як отримати вуглеводні? Чи потрібно це?

фото: СП ПГНК
Добування алканів
В основному алкани добувають з природної сировини: нафти, природного
газу, вугілля. Проте є і промислові та лабораторні методи.



Добування:
1. Метану :

А. Дія водню на вугілля (t = 5000 С, тиск, каталізатор – Nі, Fе): С + 2Н2 → СН4
Кам’яне вугілля гідрують в автоклавах при 300 атм. та наявності каталізаторів: сульфідів та оксидів Fe, Mo, Ni, W (Бергіус, 1913 р.) та отримують інші алкани:
![]()
Для України, яка має значні запаси бурого вугілля, цей метод є важливим та економічно привабливим.
Оксосинтез за методом Фішера-Тропша (1922 р.) проводять у дві стадії:
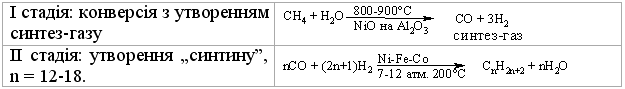
Б.Взаємодія алюміній карбіду з водою: Аl4С3 +12НОН → 3СН4 +4Аl(ОН)3
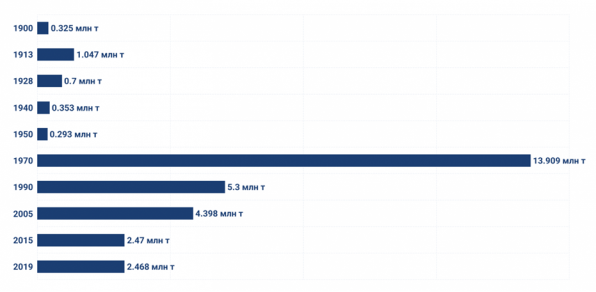
Статистика видобутку газу в Україні (включаючи газовий конденсат)
За період 2015–2019 рр. не враховані обсяги видобутку на тимчасово окупованих територіях.
Лабораторні методи
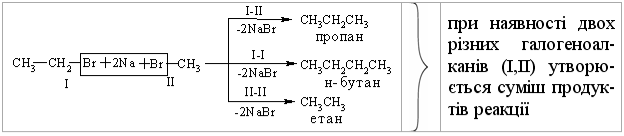
- Реа́кція Вю́рца, або си́нтез Вю́рца (Wurtz reaction) (1855 р.)— реакція, в ході якої дві молекули алкілгалогеніду реагують з лужними металами із утворенням нового алкану з довшим карбоновим ланцюгом:
2. Термічне декарбоксилювання солей карбонових кислот (реакція Дюма):
![]()
Реакція відбувається з відщепленням СО2, або карбонату лужного чи лужно-земельного металу та з утворенням алкану, який має на один атом Карбону менше, ніж у вихідній солі карбонової кислоти.
https://www.youtube.com/watch?v=E1rdbvA2XfU
2. Добування інших представників алканів:
1. гідрування ненасичених вуглеводнів в присутності каталізаторів платинової групи (Pt, Pd, Ni):
алкенів С4Н8 + Н2 → С4Н10
алкінів С4Н6 + 2Н2 → С4Н10
2. Суха перегонка. У відносно невеликих кількостях алкани одержують шляхом сухої перегонки (нагрівання без доступу повітря) вугілля, сланців, торфу.
 Добування алкенів
Добування алкенів
Алкени добувають кількома способами, причому з різних класів органічних
сполук: алканів, алкінів, спиртів. Значну частину алкенів отримують переробляючи нафтопродукти.
В природі алкени зустрічаються значно менше, ніж насичені вуглеводні, мабуть, внаслідок своєї високої реакційної здатності. Тому їх одержують з використанням різних реакцій.
I. Крекінг алканів при високих температурах (> 700 °C) без доступу кисню повітря:
![]()
Наприклад: ![]()
ІІ. Дегідрування алканів при 500С:
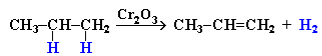
Лабораторні методи
А.Дегідрогалогенування галогеноалканів при дії спиртових розчинів лугів:
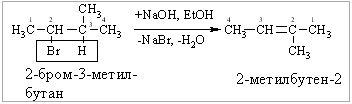
Відщеплення галогеноводню відбувається за правилом Зайцева (1875 р.): Гідроген відщеплюється від менш гідрогенізованого атома Карбону.
Б. Дегідратація (dehydration) насичених одноатомних спиртів у присутності дегідратуючих засобів.
а) в промисловості:
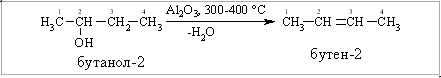
Дегідратація також відбувається за правилом Зайцева.
б) в лабораторних умовах:
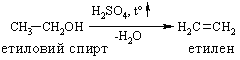
В. Дія активних металів (Zn0 або Mg0) на дигалогенопохідні вуглеводнів:
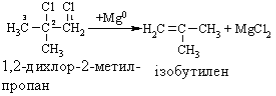
Добування алкінів
Ацетилен одержують в промисловості двома способами.
-
 Термічний крекінг метану (метод більш економічний, ніж карбідний). Ацетилен добувають піролізом метану при високій температурі в 1200- 1500°С з наступним швидким охолодженням продуктів реакції. Продукти, отримані в результаті реакції піролізу метану, швидко охолоджуються до температури 90-200°С. Робиться це для того, щоб зберегти ацетилен, оскільки при такій температурі реакція його розкладу припиняється:
Термічний крекінг метану (метод більш економічний, ніж карбідний). Ацетилен добувають піролізом метану при високій температурі в 1200- 1500°С з наступним швидким охолодженням продуктів реакції. Продукти, отримані в результаті реакції піролізу метану, швидко охолоджуються до температури 90-200°С. Робиться це для того, щоб зберегти ацетилен, оскільки при такій температурі реакція його розкладу припиняється:
![]()
- У промисловості також використовують термоокиснювальний піроліз метану. Цей процес полягає в неповному згорянні суміші метану з киснем при температурі 1450–1500°С і атмосферному тиску. Метан, який не прореагував при цій температурі, розкладається з утворенням ацетилену і ряду інших продуктів
6CH4 + 4O2 → HC≡CH + CO2 + 3CO + 8H2 + 3H2O
Також ацетилен добувають піролізом вуглеводневої сировини (бензину, гасу) при 1200–1500°С, який проходить легше ніж піроліз метану:
C6H14 → 3HC≡CH + 4H2
3.Гідроліз кальцій карбіду:
![]()
https://www.youtube.com/watch?v=HiM4bOFVrcM
Лабораторні методи
А. Дегідрогалогенування дигалогеналканів або галогеналкенів. Реакція дегідрогалогенування відбувається при підвищених температурах сильними основами (спиртовий розчин лугу, алкоголят, натрій амід тощо)
CH3-CH2–CHBr2 + 2KOH → CH3–C≡CH + 2KBr + 2H2O
CH2=CHBr +NaNH2 → HC≡CH + NaBr + NH3
Б. З ацетиленідів в два етапи:
1) утворення ацетиленідів
HC≡CH + NaNH2 → HC≡CNa + NH3
2) дія алкілгалогеніду на ацетиленід
HC≡CNa + Br–CH3 → HC≡C–CH3 + NaBr
Добування бензену
1.У промисловості – з нафти і кам’яновугільної смоли.
При сухій перегонці кам’яного вугілля (при 1273-1473 К) утворюється декілька продуктів: коксовий газ, кокс, аміачна вода і кам’яновугільна смола (дьоготь). Коксовий газ - суміш газоподібних продуктів, при пропусканні яких через систему поглиначів можна виділити смолу, амоніак і пари легкого масла. Це масло містить близько 60% бензену, толуен та інші вуглеводні.
2. Дегідрування н-гексану - каталізатор Pt, Pd
С6Н14 = С6Н6 + 4Н2
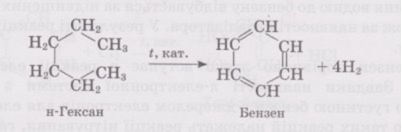
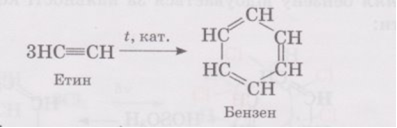
3.Тримеризація ацетилену (t=600º, нагріте вугілля)
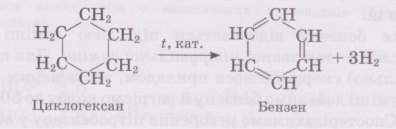
4. Дегідрування циклопарафінів
Застосування алканів
Насичені вуглеводні широко використовуються в найрізноманітніших сферах життя й діяльності людини.

 Газоподібні алкани (метан і пропан-бутанова суміш) використовуються як цінне паливо. Рідкі вуглеводні становлять значну частку в моторних і ракетних паливах і використовуються як розчинники. Вазелінова олія (суміш рідких вуглеводнів із числом атомів Карбону до 15) – прозора рідина без запаху й смаку, використовується в медицині, парфумерії та косметиці. Вазелін (суміш рідких і твердих насичених вуглеводнів із числом атомів Карбону до 25) використовується для виготовлення мазей, які застосовуються в медицині.
Газоподібні алкани (метан і пропан-бутанова суміш) використовуються як цінне паливо. Рідкі вуглеводні становлять значну частку в моторних і ракетних паливах і використовуються як розчинники. Вазелінова олія (суміш рідких вуглеводнів із числом атомів Карбону до 15) – прозора рідина без запаху й смаку, використовується в медицині, парфумерії та косметиці. Вазелін (суміш рідких і твердих насичених вуглеводнів із числом атомів Карбону до 25) використовується для виготовлення мазей, які застосовуються в медицині.
 Парафін (суміш твердих вуглеводнів C19 – C35) – біла тверда маса без запаху й смаку (tпл = 50-70°С) – застосовується для виготовлення свічок, голівок сірників і пакувального паперу, для теплових процедур у медицині та ін. У сучасній нафтохімічній промисловості насичені вуглеводні є базою для одержання різноманітних органічних сполук, важливою сировиною в процесах одержання напівфабрикатів для виробництва пластмас, каучуків, синтетичних волокон, мийних засобів і багатьох інших речовин. Нормальні насичені вуглеводні середньої молекулярної маси використовуються як поживний субстрат у мікробіологічному синтезі білка з нафти. Велике значення мають галогенопохідні алканів, що використовуються як розчинники, холодоагенти й сировина для подальших синтезів.
Парафін (суміш твердих вуглеводнів C19 – C35) – біла тверда маса без запаху й смаку (tпл = 50-70°С) – застосовується для виготовлення свічок, голівок сірників і пакувального паперу, для теплових процедур у медицині та ін. У сучасній нафтохімічній промисловості насичені вуглеводні є базою для одержання різноманітних органічних сполук, важливою сировиною в процесах одержання напівфабрикатів для виробництва пластмас, каучуків, синтетичних волокон, мийних засобів і багатьох інших речовин. Нормальні насичені вуглеводні середньої молекулярної маси використовуються як поживний субстрат у мікробіологічному синтезі білка з нафти. Велике значення мають галогенопохідні алканів, що використовуються як розчинники, холодоагенти й сировина для подальших синтезів.
Застосування алкенів
Алкени застосовуються як вихідні продукти у виробництві полімерних матеріалів (пластмас, каучуків, плівок) та інших органічних речовин.
Етилен (етен) Н2С = СН2 використовується для одержання поліетилену, політетрафлуоретилену (тефлону), етилового спирту, оцтового альдегіду, галогенопохідних і багатьох інших органічних сполук. Застосовується як засіб для прискореного дозрівання фруктів.
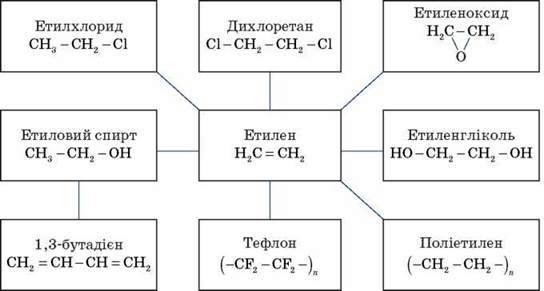
Пропілен (пропен) Н2С = СН2 – СН3 і бутилени (бут-1-ен і бут-2-ен) використовуються для одержання спиртів і полімерів.
Ізобутилен (2-метилпропен) Н2С = С(СН3)2 застосовується у виробництві синтетичного каучуку.
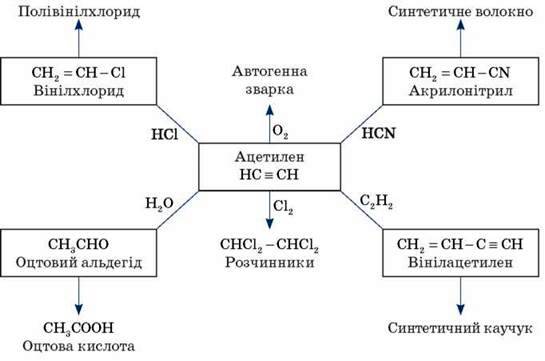
Найбільше практичне значення мають ацетилен Н – С ![]() С – Н і вінілацетилен СН2 = СН – С
С – Н і вінілацетилен СН2 = СН – С ![]() СН.
СН.
Ацетилен використовується для одержання найрізноманітніших речовин.
Застосування бензену та його гомологів
Бензен і його гомологи застосовуються як хімічна сировина для виробництва ліків, пластмас, барвників, отрутохімікатів та багатьох інших органічних речовин. Широко використовують їх як розчинники. Бензен як добавка поліпшує якості моторного палива.
Однією з важливих галузей застосування похідних бензену є сільське господарство. Тут використовуються речовини, що захищають рослини від комах-шкідників, паразитичних грибів, бур’янів. Такі речовини називають пестицидами.
До пестицидів належать гексахлорциклогексан (або промислова назва гексахлоран), гексахлорбензен тощо. Гексахлоран C6H6Cl6 дуже токсичний. Протягом тривалого часу його використовували проти бавовникового довгоносика.
Гексахлоробензол C6Cl6 використовується для протруювання (знезараження) насіння зернових культур перед висіванням у ґрунт.
До хімічних засобів захисту рослин ставлять жорсткі вимоги щодо їх безпечності для людини і тварин, загалом для довкілля. Ці сполуки повинні легко розкладатися на нешкідливі речовини, щоб після закінчення терміну їхньої дії вони не забруднювали ґрунт і водойми, не потрапляли в їжу.
-
Встановіть відповідність між речовиною та способом її добування:
1. бензен
2. етин
3. етанол
4. пропен
a) взаємодія кальцій карбіду з водою
b) тримеризація ацетилену (етину)
c) дегідрування пропану
d) гідратація етену - Дайте відповіді на питання:
- Який вуглеводень використовують для прискорення дозрівання плодів?
- Чому не можна заводити автомобіль у закритому гаражі?
- Який вуглеводень є незамінним помічником зварювальників?
- Яке автомобільне паливо не отруює повітря? Чому?
- Чи можна з пластикових пляшок можна отримати бензин?
3. Правда – неправда
1. Винайдено пляшки та інший посуд, який можна їсти разом із харчовими продуктами, які в них містяться.
2. З нафти і кухонної солі вчені навчилися виготовляти дощові плащі скатертини, різну тару.
Домашнє завдання:
- Здійснити перетворення:
![]()
- Запропонувати схеми синтезу алканів: а) 2-метилгексану; б) н-декану на основі відповідних галогенопохідних та металічного натрію.
- Працюємо з медійними джерелами
Виконайте навчальні проекти (кожна група свій), що стосуються застосування вуглеводнів різних класів. Підготуйте цікаві презентаційні матеріали, зробіть колекції, фотографії тощо.
Поцікавтеся професіями людей, які працюють на заводах з переробки вуглеводневої сировини та виробництва з неї інших речовин.
- Застосування вуглеводнів https://learningapps.org/3108429


про публікацію авторської розробки
Додати розробку
