Урок "Електроліти та неелектроліти"
Тема: Електроліти та неелектроліти.
Мета: розширити і поглибити знання учнів про розчини, будову речовини, види хімічних зв’язків, сформувати поняття «електроліт»,
«неелектроліт», розкрити залежність електропровідності розчинів від виду хімічного зв’язку, виховати в учнів самостійність у навчанні, працьовитість і сумлінність.
Тип уроку: урок вивчення нового матеріалу.
Основні терміни і поняття: розчини, розчинник, електроліти, неелектроліти, електропровідність, хімічний зв’язок, кристалічна решітка.
Методи, прийоми і форми роботи: бліц - опитування по ланцюжку, метод «незакінчене речення», діаграмма Вена, сладання опорних схем.
Обладнання: періодична система хімічних елементів Д.І. Менделєєва, таблиця розчинності солей, таблиці «Види хімічного зв’язку».
Очікувані результати навчальних досягнень
Учень
- Розпізнає, називає, дає визначення електроліти та неелектроліти
- Обґрунтовує суть електричної провідності в розчинах та розплавах електролітів.
- Наводить приклади і встановлює залежність між здатністю розчину речовини проводити електричний струм та типом хімічного зв’язку в цій речовині
Хід уроку
І. Організаційний момент(2 хв)
ІІ. Актуалізація опорних знань.
1. Бліц-опитування по ланцюжку. (5хв)
(повторення основних видів хімічного зв’язку, класів неорганічних сполук)
2. Метод «Незакінчене речення» (3хв)
Позитивно заряджені Йони це –
Негативно зарядженні Йони називають…
Напрямлений рух заряджених частинок називають …
Провідниками електричного струму є…
У сполуці натрій хлорид хімічний зв’язок …
У сульфатній кислоті тип зв’язку…
ІІІ. Мотивація навчальної діяльності (2хв)
В інструкціях до електричних приладів ми часто зустрічаємо в вимогах при експлуатації таку вимогу «Не торкатися приладу мокрими або вологими руками». Це пов’язано з небезпекою ураження електричним струмом. Але, якщо подивитись у підручник з хімії чи фізики, ми побачим що вода (чиста речовина) не проводить електричний струм. Тоді чим зумовлена така вимога?
Пояснити це ви зможете після вивчення даної теми.
ІV. Повідомлення теми та мети уроку (1хв)
V. Вивчення нового матеріалу.
Розповідь учителя. ( 5 хв)
Електроліти – це складні речовини, розчини або розплави яких мають електричну провідність, зумовлену спрямованим рухом заряджених частинок (іонів).
Неелектроліти – це сладні речовини, що не проводять електричний струм у розплавленому чи розчиненому вигляді.
Електроліти утворені йонним або ковалентним полярним зв’язком, неелектроліти – неполярним чи слабополярним ковалентним зв’язком.
Колективне обговорення (7 хв)
 За допомогою учнів, створюємо діаграму Вена, щоб розкрити залежність між електричною провідністю та типом зв’язку.
За допомогою учнів, створюємо діаграму Вена, щоб розкрити залежність між електричною провідністю та типом зв’язку.
Йонний зв’язок Ковалентний
Полярний зв’язок
Утворений атомами сполучаються Утворюється за
з великою електро- атоми з різною допомогою спільних
(більше 1,8) електронегатив –електронних пар
Виникає між атома- ністю, в резуль- Виникає між атома-
ми металів та не- таті чого виникає ми неметалів
металів полярність
(заряди)
Робота з підручником (5хв)
Заповнюється таблиця, в якій відтворюється характерні властивості електролітів та неелектролітів.
|
Критерії |
Електроліти |
Неелектроліти |
|
Визначення |
|
|
|
Вид хімічного зв’язку |
|
|
|
Приклади |
|
|
VІ. Узагальнення та систематизація знань.
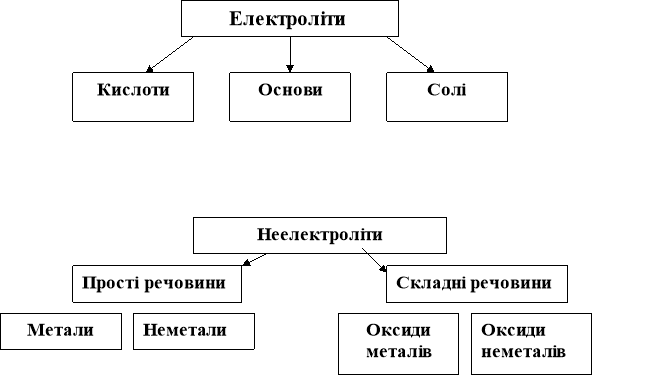
1.Складання опорних схем (8 хв)
(учні за допомогою вчителя)
2. Логічна вправа «Вибери зайвого» (3 хв)
а) NaCl, H2SO4, Ba(OH)2, C2H5OH;
2) ВаSO4, NaNO3, Fe(OH)3, AgCl
в) СH3OH, CH3COOH, CH3ONa.
VI. Домашнє завдання § 10, Впр. 1 – 5 (1хв)
Творче завдання.
Написати доповідь про використання електролітів у побуті.
Індивідуальне завдання
(кілька учнів за вибором вчителя + учні, які виявили бажання)
Вибрати цікаві факти з життя Сванте Арреніуса.
VII. Підбиття підсумків уроку.(4 хв)
Вправа «Вузлик на пам’ять»
Учні беруть в руки стрічку, зав’язують вузлик при цьому кажуть
Я запам’ятала, що електроліти це … і т.д.
1


про публікацію авторської розробки
Додати розробку
