Урок "Електролітична дисоціація"
Тема уроку: ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ. ЕЛЕКТРОЛІТИ Й НЕЕЛЕКТРОЛІТИ.
Навчально-освітня мета: розпочати формування предметної компетентності в темі «Електролітична дисоціація» (основною предметною компетенцією цього уроку є формування поняття електроліти неелектроліти, електролітична дисоціація), пояснити механізм дисоціації, роль води для цього процесу, продемонструвати прилад на випробування розчинів на електропровідність, учити спостерігати за експериментом, порівнювати, робити логічні висновки, формувати здоров’язберігаючу компетентність під час висвітлення питання обережного поводження з електроприладами.
Тип уроку: набуття нових знань.
Форми роботи: розповідь учителя, демонстраційний експеримент.
Навчальне обладнання: таблиця розчинності кислот, основ, солей, дистильована вода, розчин кухонної солі, цукор, розчин цукру, кристалічна кухонна сіль, харчова сода, прилад на випробування речовин на електропровідність.
Предметна компетентність: розпочати формування предметної компетентності в темі «Електролітична дисоціація» (основною предметною компетенцією цього уроку є формування поняття електроліти неелектроліти, електролітична дисоціація), пояснити механізм дисоціації, роль води для цього процесу, продемонструвати прилад на випробування розчинів на електропровідність, учити спостерігати за експериментом, порівнювати, робити логічні висновки, формувати здоров’язберігаючу компетентність під час висвітлення питання обережного поводження з електроприладами.
Ключові компетентності: Спілкування державною мовою, компетентність, основні компетентності у природничих науках і технологіях, інформаційно-цифрову компетентність, уміння вчитися впродовж життя.
ХІД УРОКУ
І. Організаційний етап
Аналіз перевірочної роботи, допущених помилок, способи подолання труднощів у майбутньому.
ІІ. Актуалізація опорних знань
- Чи всі речовини здатні проводити струм?
- Чому метали здатні проводити струм, за рахунок чого він відбувається?
- Який метал має найвищу електропровідність?
- Чи проводить електричний струм вода?
ІІІ. Мотивація навчальної діяльності
Проведемо демонстраційний експеримент: занурюємо електроди в дистильовану воду й подаємо струм у систему. Лампочка не горить. Висновок — ланцюг розімкнений, дистильована вода не проводить електричний струм.
Формування здоров’язберігаючої компетентності
Нагадуємо, що електричні прилади не можна гасити водою, не можна торкатися електричних дротів, електричних приладів мокрими руками. Чому? (Тому що водопровідна вода проводить електричний струм)
Перевіряємо водопровідну воду приладом — лампа горить. Проблемне питання: Чому? Чим відрізняються дистильована й водопровідна вода? (Наявністю розчинених у них солей)
Проведемо експеримент.
Сухі електроди зануримо в сухий натрій хлорид — лампочка не горить. Тепер приєднаємо до приладу склянку з дистильованою водою й акуратно шпателем додаємо кілька кристалів натрій хлориду. Спостерігаємо за лампою, що поступово розгоряється.
Висновок: розчинені у воді кристали зробили розчин електропровідним.
— Чи всі речовини здатні так змінювати воду?
Проведемо аналогічне дослідження із содою, цукром, лимонною кислотою. Робимо висновок:
• розчин цукру не проводить електричний струм;
• розчин соди проводить електричний струм.
Розглянемо електропровідність інших розчинів (NaОH, Na2SО4).
Речовини, розчини й розплави яких проводять електричний струм, називаються електролітами. (До них належать усі солі, кислоти, основи, більшість основних оксидів, тобто речовини з іонним і ковалентним полярним типами зв’язку.)
Речовини, розчини й розплави яких не проводять електричний струм, називаються неелектролітами. (Це прості речовини — неметали, речовини немолекулярної будови, більшість органічних речовин.)
ІV. Вивчення нового матеріалу
Чому розчини й розплави кислот, основ і солей проводять електричний струм?
Необхідно згадати особливості будови молекули H2О (диполь, з ковалентним полярним зв’язком).
Під час розчинення диполі води орієнтуються таким чином, що позитивні полюси диполя підходять до негативного іона, а негативний полюс-до позитивного. Внаслідок електростатичної взаємодії протилежних зарядів диполі води виривають іони з іонної кристалічної ґратки, утворюються гідратовані іони. Під час створення у системі електричного поля іони починають узгоджено рухатися, в системі виникає електричний струм.
NaCl ![]() Na+ + Cl-
Na+ + Cl-
HCl ![]() H+ + Cl-
H+ + Cl-
Такі уявлення про дисоціацію у водних розчинах сполук сформувалися не відразу. Сванте Арреніус та інші прихильники фізичної теорії назвали цей процес електролітичною дисоціацією.
Електролітична дисоціація — це розпад електролітів на іони в розчині або розплаві.
Основні положення теорії електролітичної дисоціації (ТЕД) сформулював шведський учений Сванте Арреніус у 1887 р., за що в 1901 р. отримав Нобелівську премію з хімії.
Основні положення ТЕД
• Дисоціація електролітів відбувається під дією полярних молекул розчинника.
• Дисоціація — оборотний процес. Зворотний процес називається асоціацією.
• Молекули, що дисоціюють, розпадаються на катіони й аніони, причому заряд усіх катіонів дорівнює сумарному заряду всіх аніонів.
Під дією електричного струму в розчині виникає спрямований рух йонів: катіонів — до катода, аніонів — до анода.
Уперше припущення, що в розчині відбувається сполучення речовини й розчинника, було висловлено Д. І. Менделєєвим.
Згодом І. О. Каблуков і В. О. Кистяковський об’єднали обидві теорії й показали, що розчинення — складний фізико-хімічний процес.
Розглянемо на прикладах:
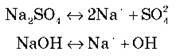
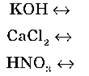
Самостійно запишіть рівняння дисоціації речовин:
V. Підбиття підсумків уроку, висновки
Доповни речення.
Процес розпаду електроліту на іони називається___________. Речовини, що ____________називаються неелектроліти, а я _____________ електроліти. Асоціація – це ___________ процес дисоціації. _______ рухаються до катода, а ________ до анода.
VI. Домашнє завдання
Опрацювати § , відповісти на запитання до нього.
Написати рівняння дисоціації в розчинах таких речовин: K2SO4, H2SO4, RbOH, BaCl2, HBr, AlCl3.


про публікацію авторської розробки
Додати розробку
