Урок "Фізичні та хімічні властивості кислот"
Тема. Фізичні та хімічні властивості кислот
Цілі. Освітня: ознайомити учнів з фізичними та хімічними властивостями кислот; розширити знання учнів про реакції заміщення та обміну; формувати вміння користуватися рядом активності металів для визначення тих металів, що можуть заміщувати Гідроген у кислотах, уміння класифікувати та пояснювати хімічні явища;
розвивальна: розвивати навички складання рівнянь хімічних реакцій, повторити та закріпити основні вміння та навички виконання хімічного експерименту; розвивати спостережливість та вміння аналізувати, аргументувати свою думку та презентувати її, робити висновки; закріпити знання з техніки безпеки;
виховна: виховувати акуратність, організованість під час роботи з хімічними речовинами та лабораторним посудом; формувати комунікативні навички роботи у групах та парах.
Тип уроку. Урок вивчення нового матеріалу.
Обладнання та реактиви. Ноутбук, мультимедійний проектор, екран, ряд активності металів, таблиця розчинності, штативи з пробірками, розчини соляної, сірчаної кислот, натрій гідроксиду, купрум (ІІ) сульфату, фенолфталеїну, метилоранжу; універсальний індикатор, купрум (ІІ) оксид, кальцій оксид, цинк (гранули), мідь (дротинки).
Основні поняття і терміни. Кислота, індикатор, фенолфталеїн, метилоранж, універсальний індикатор, лакмус, ряд активності металів, реакції заміщення та обміну.
Девіз уроку. “ Єдиний шлях, що
веде до знання, - це діяльність ”
Б. ШОУ
Хід заняття
І. Організаційний момент.
Привітання, відмічання відсутніх, перевірка готовності учнів до роботи, відповіді на запитання по домашньому завданню.
ІІ. Встановлення психолого-педагогічного контакту
з учнями.
У ч и т е л ь. Сьогодні ми проведемо нестандартне заняття, яке вимагає підготовки, напруженої роботи і я хочу перевірити вашу готовність до співробітництва, ваш настрій.
( Слайд №1) Пропоную тест «Личка».

 Якщо все одно
Якщо все одно
 Якщо бажання не має
Якщо бажання не має
Сподіваюся з вашим настроєм і знаннями заняття буде вдалим!
ІІІ. Актуалізація опорних знань. Мотивація навчальної
діяльності.
( Слайд №2)
У ч и т е л ь. Я б хотіла, щоб девізом нашого уроку стали слова відомого ірландського драматурга, філософа та прозаїка Б. Шоу.

Асоціативний кущ.
У ч и т е л ь. Слово кислота не нове для вас, ви вже багато знаєте про кислоти. Давайте з`ясуємо, з якими поняттями асоціюється у вас це слово.
Оцет Лимон Кислий смак

![]()


![]()
![]()
![]()
Їдка речовина Гідроген Опік
У ч и т е л ь. Молодці! Для того щоб краще зрозуміти, що таке кислоти, яке місце вони посідають серед інших речовин, який взаємозв`язок існує між різними речовинами в природі, як можна використовувати їх в нашому житті, необхідно знати, які фізичні та хімічні властивості характерні для цих речовин.
Отож, наша сьогоднішня тема так і звучить
”Фізичні та хімічні властивості кислот” (запис до зошита)
( Слайд №3)

( Слайд №4)

Виконуючи досліди ви покажете ваше володіння технікою експерименту, знання правил ТБ, уміння діяти в нестандартних ситуаціях, аргументувати власну точку зору, презентувати її.
IV. Пояснення нового матеріалу.
( Слайд №5) У ч и т е л ь.

1. Фізичні властивості кислот.
Я приготувала вам схеми, де до формул кислот підібрала прикметники та дієслова. Ваше завдання розібратися чому саме ці прикметники.
Вам готові в цьому допомогти ваші однокласники. Слухайте їх уважно і зробіть відповідні записи у зошитах.
( виступи учнів див. у додатку 1)
( Слайд №6)
( Слайд №7)

( Слайд №8)
( Слайд №9)
2. Хімічні властивості кислот.
Перед тим як ми почнемо розгляд даного питання дайте відповідь на питання:
( Слайд №10)

Так як кислоти небезпечні речовини , необхідно знати правила ТБ при роботі з ними.
( Слайд №11)
( Слайд №12)

Вам необхідно вивчити назви індикаторів та запам`ятати як само змінюється їх колір в розчинах кислот (кислому середовищі).
Проведемо лабораторний дослід №1
( Слайд №13)



Чимало кислот є в нашій їжі, фруктах, овочах, солодких напоях, виділеннях тварин. Це органічні кислоти. Ви будете їх вивчати трохи пізніше. Але знання, які ви здобуваєте зараз стосуються і їх.
Давайте спробуємо довести, що в яблуці, лимоні та солодких напоях є кислоти.
Як ми можемо це зробити?
(Використати індикатор)
Тому їх і називають речовини-визначники.
Експеримент : лимон + лакмус
яблуко + лакмус
фанта + лакмус
( Слайд №14)

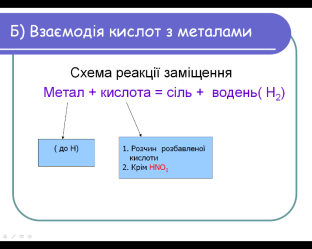
У три пробірки наливаємо розбавленої хлоридної кислоти. У першу опускаємо залізну пластинку, у другу – гранули цинку, у третю – мідні дротинки.
Чи відбуваються хімічні реакції?
(Так, у першій та другій пробірках, бо виділяється газ.)
Який газ виділяється?
Щоб це з`ясувати напишемо рівняння цих реакцій.
( Слайд №15)

Цинк – проста речовина, а кислота? (складна)
Реакція між простою і складною речовинами називається реакцією заміщення.
Що потрібно аби скласти формулу речовини? (валентність)
Яка у цинку? Яка у кислотного залишку? ( ІІ і І )
Складаємо формулу. Гідроген утворює двохатомну просту речовину – водень.
Це вже готове рівняння? (ні, схема)
Що потрібно зробити? ( урівняти, розставити коефіцієнти)
Урівнюємо.
![]() Fe + H2SO4 FeSO4 + H2
Fe + H2SO4 FeSO4 + H2
![]()
![]() Zn + 2HCl ZnCl2 + H2
Zn + 2HCl ZnCl2 + H2
![]() Cu + HCl
Cu + HCl
Висновок:
- Не всі метали реагують з кислотами.
- Метали мають різну активність по відношенню до кислот
( Слайд №16)

Результати наших дослідів відповідають закономірності встановленій М.М. Бекетовим. Метали, що стоять до Гідрогену, взаємодіють з кислотами, а ті що після нього ні. Їх всього п`ять: мідь, ртуть, срібло, платина, золото.
Слід також знати, що метали від літію до натрію – активні і вони будуть реагувати не лише з кислотою, а й з водою, в якій кислота розчинена. Тому запис лише одного рівняння не зовсім відповідає дійсності.
( Слайд №17)
( Слайд №18)

Реакція відбулася?
( так, зміна кольору)
Це реакція заміщення?
(ні, бо реагують дві складні речовини)
Реакція між двома складними речовинами, в процесі якої вони обмінюються своїми складовими частинами називаються реакціями обміну.
( Слайд №19)

( Слайд №20)


( Слайд №21)

- Закріплення знань
Щоб перевірити чи запам`ятався вам матеріал уроку, проведемо графічний диктант.
( Слайд №22)


( Слайд №23)

VІ. Домашнє завдання
( Слайд №24)

VІІ. Рефлексія.
( Слайд №25)
 Якщо ви байдуже просиділи на занятті
Якщо ви байдуже просиділи на занятті
 Якщо заняття не сподобалося.
Якщо заняття не сподобалося.
VІІІ. Підбиття підсумків уроку.
( Слайд №26)

( Слайд №27)

Додаток 1
Виступи учнів
Фізичні властивості сульфатної кислоти.
Алхімікам вдалося одержати її ще в X столітті, прожарюючи галуни або купороси. Звідси й походить назва «купоросна олія». Чиста сульфатна кислота – безбарвна масляниста рідина, що змішується з водою у всіх співвідношеннях. Розчинення кислоти супроводжується значним виділенням тепла. Тому слід приливати кислоту до води невеликими порціями під час перемішування. Пропускаючи через концентровану сульфатну кислоту потік вологого повітря або газ, який не взаємодіє з нею, можна практично повністю звільнити газ від водяної пари. Цукор, целюлоза, крохмаль під час контакту з нею обвуглюються.
Фізичні властивості хлоридної кислоти.
За часів середньовіччя її називали «соляним спиртом». НСІ – сильна кислота, що являє собою розчин гідроген хлориду (хлороводню) у воді. Хлоридна кислота – безбарвна рідина з різким характерним запахом гідроген хлориду. Максимальна концентрація близько 36%. Технічна хлоридна кислота має жовтувате забарвлення, що обумовлене домішками хлору та солей Феруму. Кислота «димить» у вологому повітрі, тому що гідроген хлорид викликає конденсацію парів води та утворення краплинок хлоридної кислоти, які ми бачимо як слабкий «дим», точніше цей дим слід називати туманом. Ця кислота входить до складу шлункового соку( 0,3%) і сприяє перетравленню їжі, а також убиває різні хвороботворні бактерії. У разі зниженої кислотності шлункового соку лікарі рекомендують приймати хворим дуже розведену хлоридну кислоту.
Фізичні властивості ортофосфатної кислоти.
Ортофосфатна кислота – біла тверда речовина. Безводна ортофосфатна кислота являє собою безбарвні кристали, які плавляться за температури
42,3 °С. З водою кислота змішується у будь-якому співвідношенні. Речовина не отруйна. Ортофосфатна кислота входить до складу речовин нашого організму, що відповідають за збереження спадкової інформації. Щоденно сечею з організму дорослої людини виводиться 4 г кислоти.
Фізичні властивості силікатної кислоти.
Силікатна кислота являє собою білий студенистий осад (гель), що не розчиняється у воді. Силікатна кислота належить до числа дуже слабких
( слабша за карбонатну) та нестійких кислот. Під час нагрівання кислота втрачає воду, перетворюючись на силіцій оксид. Частково дегідратована силікатна кислота (силікагель) використовується для поглинання вологи та інших речовин, а її солі використовуються у силікатній промисловості ( виробництво скла, керамічних виробів, цегли, цементу та покрівельних матеріалів.


про публікацію авторської розробки
Додати розробку
