Урок хімії в 11 класі(профіль)."Карбонатна кислота.Гідроген-карбонати. Колообіг карбону в природі
Плетена Тетяна Володимирівна вчитель біології,
вчитель вищої категорії,
старший вчитель НВК №240 «Соціум»,м.Київ
Урок хімії в 11 класі(профіль)
Тема уроку.
Карбонатна кислота. Гідроген каробанати. Колообіг Карбону в природі.
Цілі:
дидактична: формувати в учнів уявлення про карбонатну кислоту й гідроген карбонати; особливості будови , фізичні, хімічні властивості, якісною реакцією на карбонат-іони, з’ясувати умови взаємного перетворення карбонів, ознайомити учнів з коло обігом Карбону в природі; навчити висловлювати судження що до значення карбону в природі та житті людини;
розвивальна: продовжувати розвивати вміння і навички скаладати окисно-відновні реакції, йонні рівняння під час запису хімічних реакцій, які підтверджують хімічні властивості карбонатної ( вугільної ) кислоти, розвивати вміння експериментально визначати карбонат-іони; розвивати вміння робити висновки стосовно використання людиною карбонатів; розвивати навички поводження з хімічним обладнанням та хімічними реактивами ( правила роботи з кислотами ) формувати вміння співпрацювати в групі під час виконання дослідів;
виховна: зміцнювати екологічне виховання; збуджувати інтерес до вивчення хімії ( проведення демонстрацій, лабораторних дослідів); виховувати охайність під час оформлення роботи в зошиті; вміння слухати вчителя ,поважати інших учнів.
Обладнання: переодична система хімічних елементів, таблиця розчинності кислот, основ, солей у воді; проекти « Будова карбонатної кислоти. Фізичні властивості» , «Хімічні властивості карбонатної кислоти. Карбонати. Гідрокарбонати» , «Твердість води та шляхи її усунення», «Значення карбонатної кислоти в природі та житті людини» , штатив з пробірками, карбонат магнію(MgCO3), карбонат натрію(NA2CO3), хлоридна кислота (HCL)
, вапняна вода( Ca(OH)2) .
Тип уроку:комбінований.
План уроку:
- Організаційний етап ( 1 хв).
- Перевірка домашнього завдання ( 5хв).
- Мотивація навчальної діяльності (2хв).
- Повідомлення теми, мети, завдань уроку (1хв).
- Засвоєння нових знань, умінь (20хв).
- Закріплення отриманих знань, умінь, навичок (5хв).
- Підбиття підсумків. Рефлексія (4хв).
- Домашнє завдання (2хв).
|
Етапи уроку |
Діяльність учителя
|
,Діяльність учнів |
|
1.Організаційний етап |
Привітання учнів. Організація робочого місця. Вступне слово вчителя. Сьогодні ми продовжуємо вивчати сполуки неметалічних елементів і з’ясуємо на скільки добре ви засвоїли попередню тему. |
Привітання вчителя. Організація робочих місць. Учні слухають вчителя. |
|
2.Перевірка домашнього завдання. |
Три учні працюють біля дошки, учні класу пишуть самостійну роботу. Учитель контролює процес виконання самостійної роботи. |
Учні біля дошки працюють за картками ( 5 хв) (додаток 1). Весь клас пише самостійну роботу ( додаток 2). Перевірка роботи учнів біля дошки. |
|
3.Мотивація навчальної діяльності. |
« Один раз під час бенкету Клеопатра заявила, що вип’є десять мільйонів сестерцій. Вона вийняла з вуха сергу з перлиною рівної якої тне було в усьому світі, і кинула її в чашу, де та вмить розчинилася. На очах здивованої публіки красуня залпом випила це питво». Невдовзі після цього Клеопатру знайшли мертвою в її оселі. Що ж стало причиною смерті великої богині Єгипту? Який напій випила Клеопатра? Що сталося з перлиною? (проблемне питання) |
Слухають учителя, висловлюють свої думки. (Розвиток продуктивної творчості.) |
|
4. Засвоєння нових знань,умінь, навичок. |
Пропонує учням за допомогою підготовлених проектів з’ясувати основні поняття теми. Проводять демонстрацію 9 « Добування вуглекислого газу та його перетворення на кальцій карбонат і кальцій гідрокарбонат». |
Доповідачі кожної групи повідомляють класу матеріали за основними поняттями використовуючи підготовлені проекти( Додатки 3,4,5,6).(Розвиток інформаційної компетентності). |
|
5. Закріплення отриманих знань, умінь, навичок. |
Організація роботи в групах. (4,5 учнів ). Інструктаж з техніки безпеки ( Розвиток комунікативної та соціальної компетентності).Спостереження за роботою учнів. |
Виконання лабораторного досліду 8, практичної роботи 1. «Добування вуглекислого газу та його перетворення на кальцій карбонат і кальцій гідрокарбонат». (Додаток 8 ) Обговорення спостережень, відповіді на питання, оформлення роботи в зошиті. |
|
6. Контроль та корегування отриманих знань. |
Пропонує учням тестові завдання( Додаток 7) (Саморозвиток і самоосвіта учнів) |
Обирають правильні відповіді. Записують в зошит. Самоперевірка. |
|
7. Підбиття підсумків уроку. Рефлексія. |
Учитель проводить підсумок уроку, оцінює роботу груп та окремих учнів. Рефлексія.
|
Слухають учителя. Беруть участь в обговоренні підсумків уроку. Відповідають на питання вчителя. |
|
8. Домашнє завдання. |
Вивчити відповідний параграф підручника,дати відповіді на запитання в кінці параграфа |
Записують домашнє завдання. |
Додаток1
Робота учнів з індивідуальними картками.
І варіант.1) У 1921 році вмісті Опал (Німеччина) на заводі, який випускав добрива (суміш амонію сульфату та амонію-нітрату(NH4)2SO4 і NH4NO3) стався вибух. Ці солі довго зберегалися на складі і залежались. Їх вирішили подрібнити слабкими вибухами. Це спричинило детонацію в усій масі речовини. Потужній вибух забрав життя 560осіб.
З’ясувалося, що амоній-нітрат вибухо небезпечний. При нагріванні до 260ºC він розкладає ця на нітроген ( І ) оксид и воду. Запиши рівняння реакції.
(NH4NO3=N2O↑+H20).
2) З подальшим підвищенням температури реакція ускладнюється, амонію-нітрат розкладається на нітроген ( І ) оксид, нітроген ( ІІ ) оксид, нітроген та воду. Запиши рівняння реакції.
(8NH4NO3=2NO2↑+4N0↑+5N2+16H20↑).
ІІ варіант. Напишіть рівняння реакції згідно з схемами.
P→P2O5→H3PO4→Na3PO4
↓
Ca3(PO4)2
ІІІ варіант. Запиши рівняння реакції.
P→P2O5→ Ca3(PO4)2
↓
H3PO4→ Na3PO4
Додаток 2.
Самостійна робота класу
І варіант
1)Знайдіть відповідність
- Фосфатне борошно А. Ca(H2PO4)2
- Амофоз Б. СaHPO4*2H2O
- Подвійний суперфосфат В. (NH4)2SO4
- Солі амонію Д. Ca3(PO4)2
- Простий суперфосфат
2)Що таке амофоска?
ІІ варіант
1)Запишіть хімічні формули аміачної води, рідкого аміака, аміачної селітри.
2)На які групи поділяють ортофосфати, їх особливості? Наведіть приклади.
Додаток 3.
Карбонатна кислота. H2CO3.
Будова молекули
У вільному стані не існує, нестійка сполука. Існує лише у водному розчині.
Фізичні властивості. Дуже нестійка кислота, на повітрі легко розкладається на карбон діоксид (CO2) і воду( H2O), що є оборотною реакцією.
Хімічні властивості.
Карбонатна кислота – слабка, дисоціює на іони незначною мірою.
CO2+H2O↔H2CO3↔H+HCO3↔2H+CO3
Солі карбонатної кислоти:
-середні (карбонати) -кислі (гідрокарбонати)
1)Нерозчинні за винятком карбонатів 1)Легкорозчинні за вийнятком
лужних металів та алюмінію. NaHCO3.
2)Всі кристалічні речовини 2)Легко розкладається при
3)Розкладаються за високих температур. Нагріванні.
CaCO3=CaO+CO2 Сa(HCO3)2=CaCO3+H2O+CO2
4)Внаслідок дії кислот на карбонати NaHCO3 – питна сода
виділяється оксид карбону (ІV)
MgCO3+2HCl=MgCl2+CO2↑+H2O
MgCO3+3H=Mg+CO2+H2O
5)Можуть перетворюватись на кислі солі
CaCO3+CO2+H2O=Ca(HCO3)2
Ca(HCO3)2=CaСO3↓+CO2↑+H2O
Додаток 4.
Твердість води
Твердість води, зумовлена наявністю іонів кальцію Са2+ та іонів магнію Mg2+ , називається загальною твердістю води.
Чим вищий вміст у воді цих іонів, тим більша твердість води. Загальна твердість води складається з карбонатної (тимчасової) і не карбонатної (сталої).
CO2+H2O=H2CO3 CaCO3+H2O+CO2=Ca (HCO3)2
MgCO3+H2O+CO2=Mg (HCO3)2.
Карбонатна твердість води
Спричиняється наявністю у воді кальцій і магній гідроген карбонатів.
Пом`якшення води (усунення карбонатної твердості, тобто видалення з неї кальцій і магній гідроген карбонатів).
А) Кип`ятіння води:
Ca (HCO3)2=Ca CO3+CO2+H2O
Mg (HCO3)2=MgCO3+CO2+H2O
Mg (HCO3)2=Mg (OH) 2+2CO2
Б) Додавання соди:
Ca (HCO3)2+Na2CO3=CaCO3+2NaHCO3
Mg (HCO3)2+Na2Co3=MgCO3+2NaHCO3
В) Додавання гашеного вапна (у промислових умовах):
Ca (HCO3)2+Ca (OH) 2=2CaCO3+2H2O
Mg (HCO3)2+Ca (OH) 2=CaCO3+MgCO3+2H2O
Не карбонатна твердість води
Обумовлюється наявністю у воді сульфатів, хлоридів, нітратів кальцію і магнію.
Усунення не карбонатної твердості води:
А) Содовий метод:
CaSO4+NaCO3=CaCO3+Na2SO4
MgSO4+Na2CO3=MgCO3+Na2SO4
CaCl2+Na2CO3=CaCo3+2NaCl.
Б) Фосфатний метод:
3CaSO4+2Na3PO4=Ca3 (PO4)2+3Na2SO4
3MgSO4+2Na3PO4=Mg3 (PO4)2+Na2SO4
Додаток 5.
Колообіг Карбону у природі
Важлива роль у колообігу Карбону належить оксиду карбону(IV), що входить до складу атмосфери Землі.
З повітря CO2 поглинається рослинами та планктоном Світового океану.
Із рослин, що служать кормом для тварин, Карбон переходить у тваринні організми. Тварини виділяють Карбон у вигляді вуглекислого газу під час дихання. При відмиранні тварини і рослини гниють, перетворюються на CO2 . Частково перетворюються на горючі копалини- кам`яне вугілля, нафту, природний газ. Використовуються як паливо. Утворюються вапняки, доломіти, карбонати.
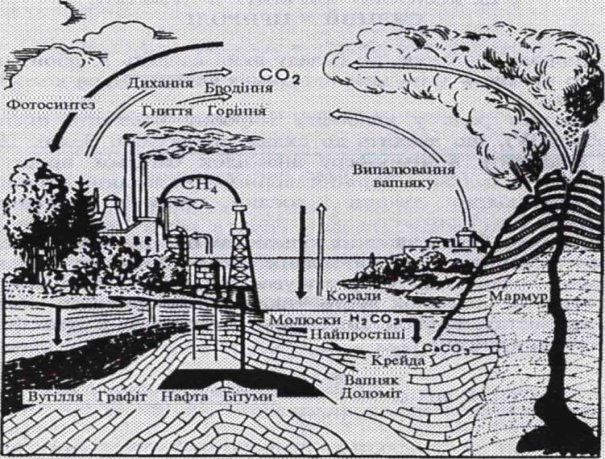
Додаток 6.
Значення H2CO3 та карбонатів
Для людини
а) будівництво (мрамор, вапняк, крейда)
б) сільське господарство (у грунт для зниження кислотності та поліпшення його структури; боротьба з бур’яном)
в) у виробництві скла, мила, мийних засобів, барвників
г) целюлозно-паперова, текстильна, нафтова промисловість
д) харчова промисловість (NaHCO3), входить до складу вогнегасників.
є) фармацевтична промисловість
В природі
а) утворення осадових порід
б) «будиночки» для морських та прісноводних тварин
в) сприяють утворенню печер ( в наслідок вимивання карбонатів земної кори)
Добування вуглекислого газу. Взаємоперетворення карбонатів і гідрогенкарбонатів
Додаток 7.Тести
- Гідрокарбонати
а) розчинні у воді
б)не розчинні у воді
в)розчинні у кислотах
г) розчинні в органічних розчинниках
- Карбонати мало активних металів
а) розкладаються при кипятінні
б) не розкладаються при кипятінні
в) розкладаються при нагріванні
г) не розкладаються при нагріванні
- Гідрокарбонати можуть перетворюватись на карбонати
а) при взаємодії з кислотами
б) при взаємодії з основами
в) при нагріванні
г) при охолоджені
- Карбонати при взаємодії з кислотами утворюють
а) вуглекислий газ і воду
б) вуглекислий газ і кисень
в) вуглекислий газ і карбон
г) солі і вуглекислий газ
- Карбонати і воді не розчиняються за винятком
а) лужних металів і магнію
б) лужних металів та амонію
в) лужних металів та алюмінію
г) фосфатів та калію
- Якісною реакцією на карбонат – іони є
а) взаємодія з основами
б) взаємодія з кислотами
в) взаємодія з солями
г) взаємодія з лугами
- Вкажіть послідовність коло обігу карбону в природі
а) атмосфера → тварини, рослини → атмосфера
б) фотосинтез → дихання → мінерали
в) атмосфера → фотосинтез → дихання → тварини, рослини → атмосфера, мінерали
г) атмосфера → мінерали → тварини, рослини
- Встановіть відповідність
А) К2СО3 1)питна сода,
Б) Na HCO3 2) крейда, вапняк
B) Na2CO3 3) кальцинована сода
Г)CaCO3 4) поташ
Додаток 8.
Практична робота 1.
«Добування оксидукарбону(IV), взаємоперетворення карбонатів і гідрокарбонатів»
Коротка інструкція:
1. У пробірку покладіть кілька шматочків крейди або мармуру і долийте трохи розбавленої хлоридної кислоти.
2. Пробірку швидко закрийте корком з відвідною трубкою, кінець якої занурте у пробірку з вапняною водою (1 — 2 мл). Що спостерігається?
3. Продовжуйте пропускати газ у цю саму пробірку доти, доки не зникне каламуть і утвориться прозорий розчин.
Запитання і завдання
1. Що відбувається при дії хлоридної кислоти на карбонати?
2. Як двома способами довести, що з пробірки виділяється саме оксид карбону(IV)?
3. Як пояснити появу каламуті в пробірці з вапняною водою, крізь яку пропускали оксид карбону(IV), і розчинення каламуті?
4. Напишіть рівняння реакцій у молекулярній, повній і скороченій йонних формах.
Література
1 Буринська Н.М. , Величко Л.П. Хімія-10.-К.: Ірпінь:ВТФ «Перун» , 2005.
-129 с.
2.Глінка М.Л. Загальна хімія . – К.:Вища школа , 1982 .- 367 с.
3. Гриньова М.В., Шиян Н.І. та ін.. Хімія. Довідник для абітурієнтів та школярів.- К.: Літера ЛТД , 2012 .- 464 с.
4. Рудика В.В. Сульфатна кислота й сульфати . Якісна реакція на сульфат –іон.10 клас. Профільний рівень // Хімія , «Основа» .- 2012.-№13-14( 265-266 )
Інтернет джерела
Херсонська область
Великолепетиське ПТУ – 22
Тема уроку.
Карбонатна кислота. Гідроген каробаната. Колообіг Карбону в природі.
10 клас. Рівень стандарту.
Підготувала викладач хімії ,
вчитель вищої категорії
Плетена Т.В.
( моб: 0950847199 )
2012 р.
Великолепетиське ПТУ – 22
Тема уроку.
Карбонатна кислота. Гідроген каробаната. Колообіг Карбону в природі.
Підготувала викладач хімії
Плетена Т.В.
2012 р.


про публікацію авторської розробки
Додати розробку
