Урок "Хімічні властивості кислот: дія на індикатори, взаємодія з металами. Ряд активності металів. Реакції заміщення. Заходи безпеки під час роботи з кислотами"
Розробка відкритого уроку для учнів 8 класу з використанням ментальних карт (створюєсо разом з учнями).
Урок спрямований на закріплення знань про класифікацію кислот, їхні фізичні та хімічні властивості;
Складаючи ментальну карту закріплюються вміння складати рівняння хімічних реакцій, що характеризують хімічні властивості кислот та способи їх одержання.
1
Конспект уроку
Урок № 45/11 Клас 8 Дата____Вчитель Алхімова О. О.
Тема: Хімічні властивості кислот: дія на індикатори, взаємодія з металами. Ряд активності металів. Реакції заміщення. Заходи безпеки під час роботи з кислотами
Навчальна мета: закріпити знання про класифікацію кислот, їхні фізичні та хімічні властивості; закріпити вміння складати рівняння хімічних реакцій, що характеризують хімічні властивості кислот та способи їх одержання.
Розвивальна мета: розвивати хімічну мову.
Виховна мета: виховувати інтерес до вивчення хімії.
Базові поняття і терміни: кислоти, ряд активності металів, реакції заміщення.
Тип уроку: комбінований.
Методи форми та прийоми роботи: словесні (фронтальна бесіда), індивідуальні, практичні (виконання вправ), інтерактивні, методи контролю.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, ряд активності металів.
Структура уроку з хронометражем:
- Організаційний етап (1 хв)
- Актуалізація опорних знань, перевірка домашнього завдання (10 хв)
- Мотивація навчальної діяльності (2хв)
- Вивчення нового матеріалу (19 хв)
- Закріплення нового матеріалу (9 хв)
- Підбиття підсумків уроку (3 хв)
- Домашнє завдання (диференційоване) (1 хв)
Хід уроку
- Організаційний етап
Привітання, перевірка присутніх.
-
Актуалізація опорних знань, перевірка домашнього завдання
- Прийом «Вилучи зайве»
- Ca, MgO, NaCl, H2SO4;
- SO2, H2CO3, Na2O, CuO;
- K2O, Ag2O, CO2, FeO;
- SiO2, MnO, P2O5, N2O5;
-
HCl, H2CO3, K2SO4, H3PO4.
- Встановіть відповідність
Оксид
- CO2
- P2O5
- SO2
- SiO2
- SO3
Кислота
- H2SO4
- H2SiO3
- H3PO4
- H2CO3
- H2SO3
- Мотивація навчальної діяльності
Ми вже знаємо класифікацію кислот, а які ж їхні хімічні властивості? Сьогодні ми з вами розглянемо дію кислот на індикатори, та їх взаємодію з металами.
- Вивчення нового матеріалу
Фізичні й хімічні властивості кислот
Всі кислоти розчиняються у воді (крім кислоти H2SiO3), у багатьох випадках – необмежено, тобто змішуються з водою в будь-яких співвідношеннях з утворенням розчинів. Під час розчинення деяких кислот виділяється значна кількість теплоти.
Вам відомо, що безоксигенові кислоти є водними розчинами газів – сполук неметалічних елементів VI і VII груп із Гідрогеном (наприклад, H2S, HCl). Ці гази виділяються зі своїх розчинів навіть за звичайних умов.
Леткою, тобто такою, що переходить у газуватий стан за помірного нагрівання, є нітратна кислота HNO3. Леткі кислоти мають запах.
Ортофосфатна кислота Н3РО4, ортоборатна (борна) Н3ВО3, металисікатна H2SiO3 – тверді речовини. Вони, а також сульфатна кислота H2SO4 є нелеткими).
Карбонатна і сульфідна кислоти існують лише у водному розчині. Відповідні оксиди взаємодіють із водою неповною мірою, а кислоти, що утворюються, частково розкладаються на оксиди і воду:
![]()
![]()
Більшість кислот – токсичні речовини. Вони спричиняють серйозні отруєння, опіки шкіри. Тому працювати з кислотами, як і з лугами, потрібно обережно, дотримуючись правил безпеки. При потраплянні розчину кислоти на руку слід змити його водою, обробити шкіру розбавленим розчином харчової соди (для знешкодження залишків кислоти) і знову промити водою.
Здатність кислот реагувати з іншими речовинами значною мірою залежить від їх активності, стійкості, леткості, розчинності у воді. На це звертатимемо увагу, розглядаючи хімічні властивості кислот.
Кислоти виявляють різну хімічну активність. Дуже активні кислоти називають сильними, а малоактивні – слабкими. Є ще й кілька кислот середньої сили.
![]()
![]()
![]() HCl HNO3 H2SO4 HF H2SO3 H3PO4 H2S H2CO3 H2SiO3
HCl HNO3 H2SO4 HF H2SO3 H3PO4 H2S H2CO3 H2SiO3
сильні кислоти кислоти середньої сили слабкі кислоти
Кислоти у водних розчинах змінюють забарвлення індикаторів, але не всіх і не так, як луги.
Лабораторний дослід. Дія кислот на індикатори
В три пробірки акуратно наливаємо по 1 мл розчину хлоридної кислоти. У одній з пробірок змочуємо скляну паличку розчином кислоти й торкаємося нею до універсального індикаторного папірця. Як змінюється колір індикатора?
В одну пробірку з розчином кислоти додаємо 1-2 краплі розчину метилового оранжевого, у другу – стільки ж розчину лакмусу, а в третю – фенолфталеїну.
На підставі спостережень заповнюємо таблицю.
|
|
Універсальний індикаторний папір |
Метиловий оранжевий |
Лакмус |
Фенолфталеїн |
|
Нейтральний |
|
Оранжевий |
Фіолетовий |
Безбарвний |
|
HCl |
Червоний |
Червоний |
Рожевий |
Безбарвний |
Висновок. У розчинах кислот універсальний індикаторний парір та метиловий оранжевий набуває червоного забарвлення, лакмус – рожевого. Отже, розчини кислот можна визначити з допомогою універсального індикатора, метилоранжу або лакмусу.

![]()
![]() Усі безоксигенові кислоти, сульфатна кислота (у розбавленому розчині) та деякі інші реагують із металами з виділенням водню й утворенням солей:
Усі безоксигенові кислоти, сульфатна кислота (у розбавленому розчині) та деякі інші реагують із металами з виділенням водню й утворенням солей:
![]() 2 Al + 6 HCl → 2 AlCl3 + 3 H2 ↑;
2 Al + 6 HCl → 2 AlCl3 + 3 H2 ↑;
Zn + H2SO4 (розб.) → ZnSO4 + H2 ↑
Під час деяких реакцій атоми металічного елемента, які містяться в простій речовині, заміщують атоми Гідрогену у складній речовині.
Реакцію між простою і складною речовинами, у результаті якої утворюються нові проста і складна речовини, називають реакцією заміщення.
Лабораторний дослід. Взаємодія хлоридної кислоти з металами
Розглянемо, як взаємодіють кислоти з металами.
Для експерименту в три пробірки наливаємо хлоридну кислоту; у першу додаємо шматочки мідного дроту, у другу – гранули цинку, у третю – магнієву стружку.
- Чому метали неоднаково реагують із кислотою?

Це пов’язано з властивостями металів. Микола Миколайович Бекетов – український вчений хімік розташував метали відповідно до їх активності в ряд від найсильніших до найслабших, на підставі вивчення реакцій металів із кислотами і солями. Цей ряд так і називається – ряд активності металів. (Розглядаємо таблицю, знаходимо рядактивності металів у підручнику.) Водень серед металів перебуває не випадково. Він розділяє метали на активні, які витісняють водень із розчинів кислот,і ті, що не взаємодіють із розчинами кислот і водень не витісняють.
активні метали метали середньої сили малоактивні метали
![]()
![]()
![]()

Запишемо рівняння реакцій:
Cu +HCl ≠
Zn + 2 HCl → ZnCl2 + H2
Mg + 2 HCl → MgCl2 + H2
Укажіть тип реакції. (Реакція заміщення)
Увага! Нітратна кислота по-особливому реагує з металами. Водень не витісняється жодним із металів, наприклад:
Zn + 4HNO3→Zn(NO3)2+ 2H2O + 2NO2
Усі метали реагують з кислотами з виділенням водню Н2, окрім металів, які знаходяться в ряду активності металів після Н, окрім кислот-окисників: H2SO4 (конц.), HNO3 (розб.), HNO3 (конц.), H2SiO3.
- Закріплення вивченого матеріалу
Дописати рівняння реакцій:
- Mg + H3PO4 →
- Na + HCl →
- Fe + H2SO4 →
- Zn + H2SO4 →
- Ag + H2SO4 →
- Hg + HCl →
- Al + H3PO4 →
Для закріплення отриманих на уроці знань, створюємо разом з учнями ментальну карту.
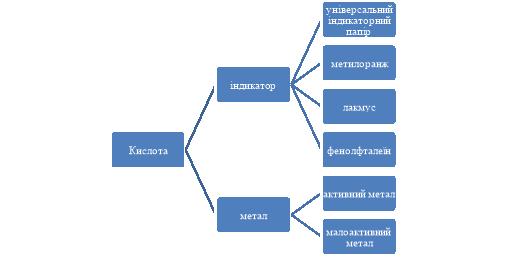
- Підбиття підсумків уроку
Для підбиття підсумків уроку можна використати інтерактивну технологію колективного групового навчання «Незакінчене речення». Пропонуємо учням продовжити речення: «Найважливішим відкриттям на цьому уроці для мене було…». Дати відповідь на питання, які завдання виявилися складними для розв’язання, які складними.
- Домашнє завдання
Підручник П. П. Попель, Л.С. Крикля Хімія 8 клас
Опрацювати § 30, с.159 – 164, виконати завдання №235, 238, *241, с.167.
*Виконати домашній експеримент «Дія на сік буряка лимонного соку, розчину харчової соди, мильного розчину»


про публікацію авторської розробки
Додати розробку
