Урок "Хімічні властивості солей"

Тема уроку: «Хімічні властивості солей»
Михайлюк Галина Анатоліївна учитель біології, хімії,
спеціаліст вищої категорії,
вчитель – методист
опорного закладу освіти
“Раухівський заклад загальної середньої освіти І-ІІІ ступенів
Березівської районної ради
Одеської області”
Тема. Хімічні властивості солей
Цілі уроку: систематизувати знання учнів про хімічні властивості класів неорганічних сполук на прикладі хімічних властивостей солей; показати поширення солей у природі, їх практичне значення.
Тип уроку: поглиблення й систематизація знань.
Форми роботи: лабораторна робота, навчальний міні-семінар, робота з опорною схемою.
Обладнання: Періодична система хімічних елементів
Д. І. Менделєєва, таблиця розчинності, ряд
активності металів, розчини реактивів.
ХІД УРОКУ
І. Організація класу
ІІ. Актуалізація опорних знань учнів
Гра «Мікрофон» Дайте визначення класу Оксиди,класу Кислоти, класу Основи і класу Солі.
1. Який склад солей ?
Напишіть загальну формулу.
МехRy , де Ме – метал, R – кислотний залишок.
Солі – це сполуки, до складу яких входять метали й кислотні залишки.
- Які існують правила назви солей: назва металу + (валентність Ме, якщо вона є змінною) + назва кислотного залишку.
Приклади: Cu3(PO4)2 – купрум (ІІ) фосфат,
Na2SiO3 – натрій силікат,
NH4NO3 – амоній нітрат.
3. Дайте назви речовинам та розподіліть по классам
(самостійна робота)
1)барій ортофосфат, 2)йод, в)хлоридна кислота, 3)калій карбонат,
4)ферум (ІІІ) сульфід, 5)водень, 6)алюміній бромід,
7) плюмбум (ІІ) силікат, 8)натрій сульфіт, 9)хлор,
10)нітратна кислота, 11)хром (ІІІ) йодид, 12)меркурій (ІІ) сульфат,
13)манган (ІІ) нітрат, 14)станум (ІV) гідроксид, 15)сульфітна кислота,
ІІІ. Вивчення нового матеріалу. Оголошення теми уроку.
Де ви зустрічаєтесь із солями?
1.К Л А С И Ф І К А Ц І Я С О Л Е Й
Середні |
Кислі |
Основні |
Подвійні |
Мішані |
Комплексні |
MexRy |
Mex(HR)y |
[Me(OH)x]zRy |
MeIMeIIR |
MeRIRII |
Mex[комплекс]y |
Al2(SO4)3 |
Al(HSO4)3 |
[Al(OH)2]2CO3 |
KAl(SO4)2 |
Ca(OCl)Cl |
Na3[Al(OH)6] |
2. Х І М І Ч Н І В Л А С Т И В О С Т І С О Л Е Й
Складання опорної схеми
В Л А С Т И В І С Т Ь |
П Р И К Л А Д |
Метал-1 + Сіль-1 Метал-2 + Сіль-2,абоМеІ + МеІІR МеІІ + МеІRУвага! У ряді напруг МеІ має бути ЛІВІШЕ від МеІІ !!! |
Fe + CuCl2 Cu + FeCl2CuCl2 + Fe не йдеВитяг з ряду напруг: Мg Al Mn Zn Cr Fe Ni Sn Pb Cu Hg |
Сіль-1 + Кислота-1 Сіль-2 + Кислота-2, абоМеRI + HRII MeRII + HRIУвага! У ряді леткості кислот HRII має бути ЛІВІШЕ від HRI |
Na3PO4 + H2SO4 Na2SO4 + H3PO4Na2SO4 + H3PO4 не йдеВитяг з ряду кислот: H2SO4 HCl=HNO3=H3PO4 H2SO3 H2S H2CO3 H2SiO3 |
Cіль-1 + Луг-1 Сіль-2 + Луг-2 абоСіль-1 + Луг-1 Сіль-2 + Основа Увага! Сіль-1 має бути РОЗЧИННОЮ у воді. |
Li2SO4 + Ba(OH)2 BaSO4 + LiOHCuCl2 + KOH KCl + Cu(OH)2 |
Сіль-1 + Сіль-2 Сіль-3 + Сіль-4 Увага! Обидві солі-реагенти мають бути розчинними у воді. Хоча б ожна з солей-продуктів має бути у воді нерозчинною. |
AgNO3 + Na3PO4 NaNO3 + Ag3PO4 ZnF2 + BaS ZnS + BaF2 |
Розклад під час нагрівання різні продукти |
CaCO3 CaO + CO2KNO3 KNO2 + O2AgNO3 Ag + NO2 + O2(NH4)2CO3 NH3 + CO2 + H2O тощо |
- Лабораторна робота № 7. Взаємодія солей з металами
У три пробірки наливаємо по 1 мл розчину купрум (ІІ) сульфату й занурюємо по одній гранулі заліза, алюмінію, цинку.
У наступні три пробірки наливаємо по 1 мл розчину цинк сульфату й занурюємо по одній гранулі міді, заліза, алюмінію.
- Що спостерігаєте? Заповніть протокол.
Протокол лабораторної роботи № 7
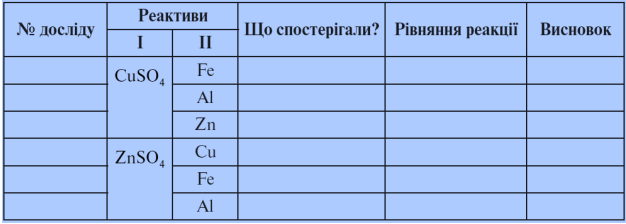
Чому в графі «Рівняння реакції» у деяких випадках немає запису? (Ряд активності)
- . Лабораторна робота № 8. Взаємодія солей з лугами в розчині
У дві пробірки наливаємо розчини CuSO4 й ZnSO4, потім в обидві пробірки по краплях додаємо натрій гідроксид до появи осаду.
Чому до розчину ZnSO4 натрій гідроксид необхідно додавати акуратно, по краплях?
А якщо, навпаки, додавати розчин ZnSO4 до розчину натрій гідроксиду?
Заповніть протокол лабораторної роботи № 8.
Протокол лабораторної роботи № 8

5. Лабораторна робота № 9. Реакція обміну між солями в розчині
Протокол лабораторної роботи № 9
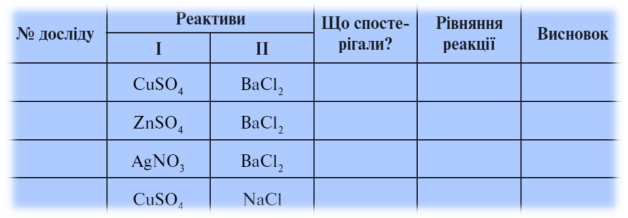
В якому випадку ми можемо стверджувати, що реакція не відбувається? Чому?
VI. Міні-семінар
Учні розповідають про практичне застосування солей, їх поширення в природі.
ІІІ. Повторення і закріплення знань
1. Напишіть по 5 формул солей, з якими реагуватиме:
а) Mg, б) Al, в) Mn, г) Zn, д) Cr, е) Fe,
є) нікель, ж) станум, з) свинець, и) мідь, і) ртуть.
2. Напишіть по три формули солей, які реагуватимуть з такими кислотами:
а) сульфатною, б) ортофосфатною, в) нітратною, г) хлоридною, д) сульфітною, е) сульфідною, є) карбонатною.
Складіть відповідні хімічні рівняння.
5. Складіть хімічні рівняння за даними схемами:
а) калій гідроксид + ферум (ІІІ) сульфат → |
і) FeCl2 +Zn |
б) барій гідроксид + натрій карбонат → |
ї) H3PO4 + Na2SiO3 |
в) меркурій (ІІ) хлорид + калій фосфат → |
й) Al2O3 + HBr |
г) манган + ферум (ІІ) сульфат → |
к) Ca(OH)2 + K2SO3 |
д) магній + сульфідна кислота → |
л) H2O + Na |
е) барій нітрат + сульфатна кислота → |
м) Fe(NO3)3 + Ba(OH)2 |
є) сульфітна кислота + калій силікат → |
н) ZnBr2 + Na2SO3 |
ж) барій карбонат + нітратна кислота → |
о) AgNO3 + HI |
з) натрій гідроксид + ферум (ІІ) йодид → |
п) Mg + H2SO4 |
и) аргентум нітрат + хром (ІІІ) бромід → |
Р) AlBr3 + K3PO4 |
VII. Домашнє завдання
Здійснити перетворення.
а) Na NaOH Na2CO3 NaCl NaNO3
б) S SO2 H2SO3 K2SO3 ZnSO3
в) Ca CaO Ca(OH)2 Ca3(PO4)2 H3PO4
г) Zn ZnCl2 Zn(OH)2 ZnO Zn(NO3)2
д) P P2O5 H3PO4 Na3PO4 NaBr
е) CaCl2 CaCO3 CO2 K2CO3 BaCO3
є) H2SO4 H2 H2O KOH Cu(OH)2
ж) MgO Mg(NO3)2 Mg(OH)2 MgSO4 MgCl2
з) SO3 Na2SO4 NaI Na2SO4 BaSO4
Опрацювати відповідний параграф підручника, підготуватися до практичної роботи № 1 «Дослідження властивостей основних класів неорганічних сполук».


про публікацію авторської розробки
Додати розробку
