Конспект уроку з хімії для 8 класу: "Фізичні й хімічні властивості кислот"
Тема: Основні класи неорганічних сполук
Тема. Фізичні й хімічні властивості кислот
Мета уроку:
Навчальна: ознайомити учнів з фізичними й хімічними властивостями кислот; розширити знання учнів про реакції заміщення й обміну на прикладі хімічних властивостей кислот, їх взаємодії з металами, основними оксидами, основами й солями; розвивати навички складання рівнянь хімічних реакцій на прикладі хімічних властивостей кислот.
Корекційна: розвивати вміння спостерігати, аналізувати результати дослідів, робити логічні висновки; активізувати пізнавальну діяльність учнів, розвивати інтерес до вивчення предмету, формувати уміння працювати самостійно; вести діалог.
Виховна: виховувати бережливе ставлення до навколишнього середовища.
Тип уроку: вивчення нового матеріалу.
Форми роботи: розповідь учителя, демонстраційний відеоексперимент, робота з опорною схемою.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, комп’ютер, мультимедійний проектор.
ХІД УРОКУ
І. Організаційний момент
Люблю я свій розум,
Увагу та пам'ять.
Працює мій мозок.
І вчусь я старанно.
Сприймаю все нове
І мислю логічно.
Учителя слово
Здійсню практично..
ІІ. Перевірка домашнього завдання, актуалізація опорних знань
На попередніх уроках ми познайомилися з фізичними й хімічними властивостями оксидів.
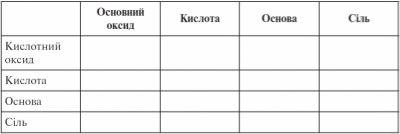
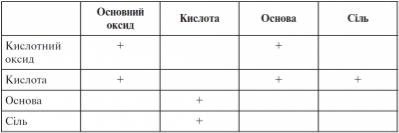
- З якими класами неорганічних речовин взаємодіють оксиди?
(З водою, з лугами — кислотні оксиди, з кислотами — основні оксиди, з іншими оксидами)
Розстав знак «плюс» там, де реакція можлива, виходячи з властивостей оксидів.
- А як же інші клітинки? Щоб заповнити їх, ми повинні вивчити хімічні властивості інших класів неорганічних сполук.
ІІІ. Вивчення нового матеріалу
Фізичні й хімічні властивості кислот
Коли ми вивчали класифікацію кислот, звернули увагу, що більшість відомих кислот — це водні розчини. Без води їх властивості змінюються. Наприклад, безводна сульфатна кислота не взаємодіє із залізом, що дозволяє перевозити її в сталевих цистернах. А розчин цієї кислоти розчинить цистерну дорогою. Безводна хлоридна кислота — це газ гідроген хлорид (безбарвний задушливий газ із різким запахом). А в разі розчинення у воді — це хлоридна кислота, що входить до складу шлункового соку.
Вивчення хімічних властивостей кислот ми проведемо за планом:
- Дія кислот на індикатори
- Взаємодія кислот з металами
- Взаємодія кислот з оксидами
- Взаємодія кислот з основами
- Взаємодія кислот із солями
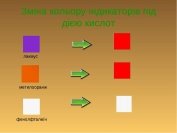
1) Відеодемонстрація досліду № 1. Дія кислот на індикатори (наприклад, https://www.youtube.com/watch?v=u1S5bc9ANt0).
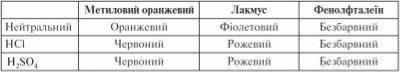
На підставі спостережень заповнюємо таблицю.
Висновок. У розчинах кислот метиловий оранжевий набуває червоного забарвлення, лакмус — рожевого, фенолфталеїн – не змінює забарвлення. Отже, розчини кислот можна визначити з допомогою індикатора метилоранжу або лакмусу.
2) Відеодемонстрація досліду № 2. Взаємодія кислот з металами (наприклад, https://www.youtube.com/watch?v=DZih_54Jthc) .
- Чому метали неоднаково реагують із кислотою?
 Це пов’язано з властивостями металів. М. М. Бекетов розташував метали відповідно до їх активності в ряд від найсильніших до найслабших.
Це пов’язано з властивостями металів. М. М. Бекетов розташував метали відповідно до їх активності в ряд від найсильніших до найслабших.
Цей ряд так і називається — ряд активності металів. (Розглядаємо таблицю, знаходимо ряд активності металів у підручнику.) Водень серед металів перебуває не випадково. Він розділяє метали на активні, які витісняють водень із розчинів кислот, і ті, що не взаємодіють із розчинами кислот і водень не витісняють.
Zn + 2HCl→ZnCl +2H2
Mg + 2HCl→MgCl +2H2
Укажіть тип реакції. (Реакція заміщення)
Увага! Нітратна кислота по-особливому реагує з металами. Водень не витісняється жодним із металів, наприклад:
Zn + 4HNO3→Zn(NO3)2+ 2H2O+ 2NO2
Висновок. Розчини кислот взаємодіють з активними металами з виділенням водню.
3) Із попередніх уроків ми знаємо, що кислоти можуть реагувати тільки з якими оксидами? (З основними)
Відеодемонстрація досліду № 3. Взаємодія купрум(ІІ) оксиду з хлоридною кислотою (наприклад, https://www.youtube.com/watch?v=kfieYauW1nM) .
Запишемо рівняння реакції:
CuO + 2HCl→CuCl2+H2O
Укажіть тип реакції.
Це реакція обміну — дві складні речовини обмінюються своїми складовими.
Висновок. Розчини кислот взаємодіють з основними оксидами.
 Комплекс вправ 4 (гімнастика для очей)
Комплекс вправ 4 (гімнастика для очей)
1. Швидко покліпати очима; заплющити очі та посидіти спокійно, повільно рахуючи до 5. Повторити 4 -5 разів.
2. Міцно замружити очі. Порахувати до 3, відкрити очі та подивитися вдалечінь. Порахувати до 5. Повторити 4 – 5 разів.
3. У середньому темпі проробити 3 – 4 кругових рухів очима в правий бік, стільки ж само – у лівий. Розслабивши очні м’язи, подивитися вдалечінь – на рахунок 1 – 6. Повторити 1 – 2 рази.
4) Відеодемонстрація досліду № 4. Реакція нейтралізації (наприклад, https://www.youtube.com/watch?v=kfrQ1p5ieCo).
Запишемо рівняння хімічної реакції:
NaOH+HCl = NaCl +H2O
- Чому знебарвлюється розчин? (Середовище стало нейтральним)
Укажіть тип реакції. (Реакція обміну)
Така реакція між розчинами кислот і основ називається реакцією нейтралізації. Поясніть, чому.
Висновок. Кислоти взаємодіють з основами.
5) Кислоти можуть витісняти більш слабкі кислоти з їхніх солей.
Відеодемонстрація досліду № 5. Взаємодія кальцій карбонату з розчином хлоридної кислоти (наприклад, https://www.youtube.com/watch?v=KetxMzY_P1I) .
СaCO3 + 2HCl→СаCl2 + H2CO3
H2CO3→H2O +CO2↑
Висновок. Кислоти взаємодіють із солями.
IV. Закріплення вивченого матеріалу
Підіб’ємо підсумки сьогоднішнього уроку.
Переглянь таблицю, яку ми почали заповнювати на початку уроку.
- В які ще клітинки ми можемо поставити знак «плюс»?
Рефлексія
1) Ми познайомилися на уроці з такими поняттями, як «індикатор», «реакція обміну»
2) Чи знаєте ви тепер, з якими простими й складними речовинами реагують кислоти?
3) Які труднощі виникли під час уроку?
Опрацювати відповідний параграф підручника, відповісти на запитання до нього, виконати вправи.
Творче завдання. Скласти правила роботи з кислотами.


про публікацію авторської розробки
Додати розробку