Урок химии в 9 классе по теме «Реакции обмена между растворами электролитов, условия их протекания»
Цель: определить условия протекания реакций ионного обмена до конца, сформировать умение составлять полные и сокращенные ионные уравнения, применять полученные знания на практике.
Урок по теме: «Реакции обмена между растворами электролитов, условия их протекания» (9 класс)
Цели:
Образовательная:
-сформировать представление о сущности реакций ионного обмена,
-определить условия протекания реакций ионного обмена до конца,
-сформировать умение составлять полные и сокращенные ионные уравнения,
- применять полученные знания на практике.
Развивающая:
-совершенствовать практические умения при выполнении лабораторных опытов,
-развивать умение выдвигать гипотезы, делать выводы.
Воспитательная:
воспитывать чувство ответственности, умение работать в парах.
Тип урока: урок-исследование
Методы обучения: объяснительно-иллюстративный, наглядный, частично-поисковый, практический
Оборудование: компьютер, презентация, алгоритмы, таблица растворимости
Электролитическая диссоциация
оказалась применимой и полезной
во всех областях современной науки
Сванте Аррениус
ХОД УРОКА
І. Организационный момент
Создание позитивного настроя. Прием «Связь поколений»
Известный психолог Дейл Карнеги сказал: «Она ничего не стоит, но много дает. Длится мгновение, а в памяти остается порой навсегда. Она создает счастье в доме, порождает атмосферу доброжелательности. Ее нельзя купить, нельзя выпросить, она сама по себе ни на что не годится, пока ее не отдали».
- Отдайте ее мне. Вы догадались, о чем речь?
- Да, это улыбка. Если вы хотите, чтобы жизнь вам улыбалась, подарите ей свое хорошее настроение.
ІІ. Актуализация опорных знаний
Давайте вспомним основные термины, изученные на прошлом уроке. Для этого разгадаем кроссворд.
Кроссворд
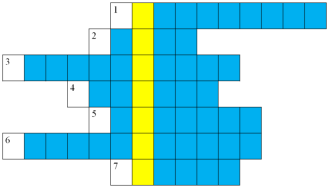
1. Назовите кислоту, которая распадается на ионы
H2S HCl H2SiO3 H2CO3 (хлоридная)
2. Вещество, при диссоциации которого образуются катионы металла (соль)
3. Вещество, раствор которого проводит электрический ток (электролит)
4. Положительно заряженный ион (катион)
5. Вещество, при диссоциации которого образуются анионы кислотного
остатка (кислота)
6. Процесс распада электролита на ионы (диссоциация)
7. Отрицательно заряженный ион (анион)
Получили ключевое слово ХОРТИЦА
Сообщение ученика «Остров Хортица»
Хортица - крупнейший остров на Днепре. Его длина - 12,5 км, ширина 2,5 км. Хортица — необычайно красивый, живописный остров. На нем обитает свыше 30 видов зверей, 120 видов птиц.
Хортица – легендарный остров, колыбель казачества. На острове расположена «Казацкая миска» - естественная выемка диаметром полтора метра. По легенде из нее запорожские казаки кормили друг друга галушками. Название Хортица произошло от имени Хорса - бога солнечного света. Солнечное настроение и имя бога отражено во многих словах: хороший, похорошеть, прихорашиваться.
Учитель. Желаю вам солнечного настроения!
ІІІ. Изучение нового материала
Реакции в растворах электролитов проходят между ионами. Электролит в растворе распадается на ионы.
- Как определить будет ли вещество распадаться на ионы? (По таблице растворимости)
Реакции ионного обмена – это реакции, протекающие между ионами в растворах электролитов
Выдвижение гипотезы
Реакции ионного обмена бывают обратимые и необратимые.
|
Необратимые (протекают до конца) |
Обратимые (не протекают до конца) |
|
1.Образуется осадок ↓ |
Продукты реакции хорошо растворимы в воде и не уходят из сферы реакции |
|
2.Выделяется газ ↑ |
|
|
3.Образуется малодиссоциирующее вещество вода (Н2О) |
|
Проверим гипотезу на практике
Демонстрация. Реакции обмена между растворами электролитов
Учитель проводит реакцию: к раствору NaOH приливаю раствор K2SO4. Изменений не происходит.
Составляем молекулярное уравнение
2 NaOH + K2SO4 = Na2SO4 + 2 KOH
Воспользуемся алгоритмом «Составление ионных уравнений» (Приложение 1)
Составляем полное ионное уравнение
2 Na+ + 2 OH- + 2 K+ + SO42- = 2 Na+ + SO42- + 2 K+ + 2 OH-
Сокращаем одинаковые ионы. Сокращенного ионного уравнения нет.
Вывод. Признаков реакции нет. Реакция обратима, т.к. нет ионов которые могут связаться между собой.
Обратимые реакции – реакции, идущие во взаимно противоположных направлениях
Для реакций ионного обмена составляют уравнения
- молекулярное
- полное ионное
- сокращенное ионное
Сокращенное ионное уравнение отражает сущность реакции ионного обмена. Сущность реакции сводится к взаимодействию ионов.
Вернемся к нашей гипотезе. Условия протекания реакций ионного обмена.
Но сначала вспомним правила безопасности при выполнении эксперимента.
Правила безопасности
1. Вещества нельзя брать руками и пробовать на вкус
2. При выполнении опыта пользуйтесь небольшими количествами веществ
3. Особую осторожность соблюдайте при работе с кислотами и щелочами
4. Если кислота или щелочь попала на руки или одежду, то немедленно смойте её большим количеством воды.
Проверим гипотезу на практике.
Вам надо выполнить один лабораторный опыт. Каждый из вас пройдет путь ученого экспериментатора.
Класс делится на три группы. Каждая группа получает инструкции. Отчет оформляют в виде таблицы
|
Исходные вещества |
Наблюдение |
Вывод |
Уравнения реакций |
|
Н2SO4 и BaCl2 |
|
|
|
|
Na2CO3 и HCl |
|
|
|
|
KOH и фенолфталеин + HNO3 |
|
|
|
Группа 1 Лабораторный опыт 2
Реакции обмена в растворах электролитов с выпадением осадка
К раствору Н2SO4 прилить несколько капель BaCl2. Что наблюдаете?
Запишите молекулярное, полное ионное и сокращенное ионное уравнение. Сделайте вывод.
Группа 2 Лабораторный опыт 3
Реакции обмена в растворах электролитов с выделением газа
К раствору Na2CO3 прилить несколько капель HCl. Что наблюдаете?
Запишите молекулярное, полное ионное и сокращенное ионное уравнение. Сделайте вывод.
Группа 3 Лабораторный опыт 4
Реакции обмена в растворах электролитов с образованием воды
К раствору KOH прилить 2 капли фенолфталеина. Что наблюдаете? Затем прилить несколько капель HNO3 до обесцвечивания раствора.
Запишите молекулярное, полное ионное и сокращенное ионное уравнение. Сделайте вывод.
Выражение решения
Один ученик от группы выходит к доске и записывает уравнения реакций ионного обмена.
1группа
BaCl2 + Н2SO4 = BaSO4 + 2 НCl Молекулярное уравнение Ba2+ +2Cl - + 2Н+ +SO4 2 - = BaSO4 ↓ + 2Н+ + 2Cl - Полное ионное уравнение Ba2+ + SO4 2 - = BaSO4 ↓ Сокращенное ионное уравнение
2 группа
Na2 CO3 + 2 HCl = 2 NaCl + H2CO3 Молекулярное уравнение 2Na+ +CO32 - +2H+ +2Cl- = 2Na+ + 2Cl- +H2O+ CO2 Полное ионное уравнение 2 H+ + CO3 2 - = H2O + CO2 Сокращенное ионное уравнение
3 группа
KOH + HNO3 = KNO3 + H2O Молекулярное уравнение K+ + OH - + H+ + NO3 - = K+ + NO3 - + H2O Полное ионное уравнение H+ + OH - = H2O Сокращенное ионное уравнение
Итак, подведем итог
Реакции ионного обмена идут до конца:
Если выделится газ - это раз.
И получится вода - это два.
А еще - нерастворимый осаждается продукт.
«Есть осадок», - говорим мы.
Это третий важный пункт.
Химик « правила обмена » не забудет никогда:
В результате - непременно будет газ или вода,
Выпадет осадок – вот тогда порядок!
ІV. Практическое применение знаний
Экологическая задача
В сточных водах реки Днепр обнаружены ионы тяжелых металлов, они губительно действуют на живые организмы. Существуют разные способы очистки воды. Один из них химический.
Предложите реактивы, с помощью которых можно очистить сточные воды от ионов а) Zn2+ б) Pb2+ в) Ва2+ г) Fe3+
Эксперимент «Предскажи реакцию»
В растворах содержатся ионы. Произойдет ли реакция ионного обмена? Почему?
Группа 1
Cu2+ Na+ SO42- OH- (Произойдет. Выпадает осадок)
Группа 2
Na+ H+ NO3- CI- (Не произойдет. Изменений нет)
Группа 3
Ag+ Na+ NO3- I- (Произойдет. Выпадает осадок)
На практике подтвердите свои гипотезы с помощью химического эксперимента.
Один ученик от группы выходит к доске и проделывает реакции. Записывает уравнения реакций.
Группа 1
CuSO4 + 2 NaОН = Na2SO4 + Cu(OH)2 синий осадок
Группа 2
NaCI + HNO3 = НCI + NaNO3 изменений нет
Группа 3
AgNO3 + NaI = NaNO3 + AgI желтый осадок
- Какой из символов Украины напоминают вам полученные цвета?
- Флаг Украины (23 августа ежегодно отмечается День Государственного флага Украины).
V. Закрепление знаний
Тестирование
1 вариант
1. Выберите электролиты а) ВaO б) H2SO4 в) HNO3 г) AgCl д) H3PO4 е) CuSO4
2. Вещество, при диссоциации которого образуются силикат-анионы а) K2SiO3 б) SiO2 в) H2SiO3 г) CaSiO3
3. При диссоциации Сa(NO3)2 общее число образующихся ионов равно а) 2 б) 3 в) 4 г) 5
4. CuCl2 может прореагировать с а) NaNO3 б) MgSO4 в) KOH г) HBr
5. К образованию осадка приведет нахождение в растворе ионов а) K+ и Cl- б) H+ и NO3- в) Аl3++ и OH- г) Ва2+ и ОН-
2 вариант
1. Выберите неэлектролиты а) BaCl2 б) Al(OH)3 в) PbSO4 г) CO2 д) ZnSO4 е) H2SiO3
2. Вещество, при диссоциации которого образуются катионы цинка а) ZnСO3 б) ZnO в) Zn(OH)2 г) Zn(NO3)2
3. При диссоциации Fe2(SO4)3 общее число образующихся ионов равно а) 2 б) 3 в) 4 г) 5
4. Zn(NO3)2 может прореагировать с а) HBr б) BaСI2 в) H2SO4 г) Na2S
5. К образованию осадка приведет нахождение в растворе ионов а) Ba2+ и Cl- б) Na+ и SO42- в) Аl3++ и Cl- г) Zn2+ и ОН-
VІ. Рефлексия
Прием «Незаконченное предложение».
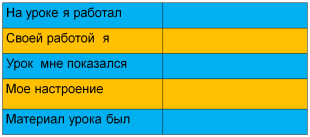
VІІ. Домашнее задание
Прочитать § 12 , выполнить упр. 1483 стр. 75
Творческое задание: предложите способ очистки сточных вод от ионов тяжелых металлов.
Приложение 1
Алгоритм «Составление ионных уравнений»
|
Пример
|
|
|
1. Записать молекулярное уравнение а) Определить растворимость каждого вещества |
Молекулярное уравнение 3 NaOH + FeCl3 = Fe(OH)3↓+ 3 NaCl P P H P |
|
2. Составить полное ионное уравнение
коэффициенты перед молекулами = коэффициентам перед ионами
а) Найти одинаковые ионы и сократить их в правой и левой части |
Полное ионное уравнение
3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3↓+ Na+ + 3Cl-
3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3↓+ 3Na+ + 3Cl- |
|
3. Составить сокращенное ионное уравнение а) Выписать формулы оставшихся ионов и веществ б) Сумма зарядов ионов в левой и правой части уравнения должна быть одинакова |
Сокращенное ионное уравнение
3OH- + Fe3+ = Fe(OH)3↓
|


про публікацію авторської розробки
Додати розробку
