Урок: "Кількість речовини. Моль – одиниця кількості речовини. Стала Авогадро."
|
Тема
|
Кількість речовини. Моль — одиниця вимірювання кількості речовини. Стала Авогадро.
|
|
Мета |
- Сформувати поняття про кількість речовини та одиницю вимірювання кількості речовини – моль; - з'ясувати значення сталої Авогадро; - розвивати вміння розраховувати число атомів і молекул за відомою кількістю речовини й кількість речовини — за відомим числом атомів чи молекул; - виховувати взаємоповагу, доброзичливість, працюючи в парах. |
|
Обладнання та матеріали |
Періодична система хімічних елементів Д. І. Менделєєва; картки з завданнями; комп‘ютер, програма «Віртуальна хімічна лабораторія» - демонстрація № 8.6. - зразки різних речовин кількістю речовини 1 моль. |
|
Базові поняття й терміни |
Атом, молекула, кількість речовини, моль, стала Авогадро. |
|
Тип уроку |
Урок засвоєння нових знань, навичок і вмінь з використанням комп’ютерної техніки. |
|
Форми й методи |
хімічний диктант, постановка проблемного питання, розповідь учителя з демонстрацією на комп’ютері, розв’язування задач, колективне складання таблиці, робота в парах |
Структура уроку
І. Організаційний етап
II. Актуалізація опорних знань
IIІ. Повідомлення теми, мети, завдань уроку та мотивація навчальної діяльності
IV. Вивчення нового матеріалу
1. Поняття про кількість речовини.
2. Моль — одиниця вимірювання кількості речовини.
3. Розрахунок кількості речовини за відомим числом атомів і молекул.
V. Узагальнення й систематизація знань
VI. Домашнє завдання
VII. Підбиття підсумків уроку
ХІД УРОКУ
I. ОРГАНІЗАЦІЙНИЙ ЕТАП
II. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Хімічний диктант.
Проводиться хімічний диктант на складання формул бінарних сполук. Вчитель диктує назву сполуки, учні записують формулу:
1 варіант. Складіть формули сполук:
1) калій сульфіду ;
2) ферум (ІІІ) хлориду;
3) манган (IV) оксиду;
4) барій флуориду;
5) кальцій сульфіду;
6) алюміній оксиду.
7) карбон (ІІ) оксиду;
8) сульфур (VI) оксиду;
9) літій сульфіду;
10) нітроген (IV) оксиду;
11) карбон (IV) оксиду;
2 варіант. Складіть формули сполук:
1) ферум (III) оксиду;
2) силіцій (IV) оксиду;
3) барій сульфіду;
4) алюміній (III) сульфіду;
5) сульфур (VI) хлориду;
6) манган (II) хлориду.
7) натрій сульфіду;
8) ферум (ІІ) сульфіду;
9) кальцій оксиду;
10) манган (VІІ) оксиду;
11) сульфур (IV) оксиду.
- ПОВІДОМЛЕННЯ ТЕМИ, МЕТИ, ЗАВДАНЬ УРОКУ ТА МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ
Постановка проблемного питання
Що демонструє запис такого рівняння реакції?
Запис в зошит
Fe + S → FeS
Чи можна взяти для реакції один атом заліза і один атом сірки? Чому?
(Учні висловлюють свої думки).
IV. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. ПОНЯТТЯ ПРО КІЛЬКІСТЬ РЕЧОВИНИ.
Розповідь учителя.
Будь-яка фізична величина — це певна характеристика об'єктів або явищ, яка може бути виміряна. Наприклад, властивості інертності тіла відповідає величина, яку називають масою, властивості просторової протяжності відповідає величина, яку називають довжиною.
У хімії, крім використання таких величин, як «маса» й «об'єм», застосовують величину «кількість речовини».
Запис в зошит
Кількість речовини — це фізична величина, обумовлена числом структурних елементів: атомів, молекул, йонів, електронів або груп атомів.
Кількість речовини позначається літерою n (або ν).
2. МОЛЬ - ОДИНИЦЯ ВИМІРЮВАННЯ КІЛЬКОСТІ РЕЧОВИНИ.
Розповідь учителя.
Будь-яка фізична величина має свою одиницю вимірювання: маса вимірюється в грамах, довжина — в метрах.
Запитання.
Як ви гадаєте, в чому можна вимірювати кількість речовини?
Розповідь учителя.
Кількість структурних елементів можна вимірювати в штуках. Тільки атоми чи молекули дуже незручно вимірювати в штуках, тому що побачити або вибрати одну молекулу надзвичайно важко. Навіть якщо використовувати кратні величини — кілоштуки (103) або гігаштуки (109), то й такі кількості дуже важко відміряти. Тому хіміки ввели дуже велику порцію для вимірювання кількості речовини — 6,02∙1023 штук. На честь відомого італійського вченого Амедео Авогадро ця величина називається «стала Авогадро» й позначається NА
NA =6,02∙1023 1/моль
Запис в зошит
Одиниця вимірювання кількості речовини — моль.
1 моль — це така кількість речовини, яка містить 6,02∙1023 ( ≈6∙1023) атомів або молекул.
Розповідь учителя.
Також використовуються кратні величини — кіломоль (кмоль, 103 моль), мілімоль (ммоль, 10-3 моль), мікромоль (мкмоль, 10-6 моль).
Число Авогадро — це дуже велике число. Наприклад, якби всю поверхню Землі (включаючи річки, озера, моря й океани) вистелити рівномірним шаром такої кількості однодоларових купюр, то утворився б шар висотою 2 метри. Проте молекули, які ми рахуємо за допомогою сталої Авогадро, є дуже маленькими часточками. Якщо ми візьмемо 6 • 1023 молекул води, то навіть не зможемо наповнити склянку.
Запитання.
Як ви гадаєте, якщо ми візьмемо один моль двох різних речовин, чи будуть це однакові кількості за зовнішнім виглядом?
(Ні. Об'єм (або маса), який буде займати 1 моль речовини, буде залежати від об’єму (або маси), який займає молекула цієї речовини. Оскільки в різних речовин різні молекули, то й об'єм, і маса 1 моль речовин будуть різні.)
Демонстрація № 8.6.
Вчитель демонструє на комп‘ютері різні речовини кількістю в 1 моль.
Увага звертається на те, що маса й об’єм 1 моль різних речовин відрізняються.



Запитання.
Який висновок про співвідношення розмірів і мас молекул (або атомів) води, заліза, кухонної солі, цукру, магнію … можна зробити?
З. РОЗРАХУНОК КІЛЬКОСТІ РЕЧОВИНИ
ЗА ВІДОМИМ ЧИСЛОМ АТОМІВ І МОЛЕКУЛ.
Розповідь учителя.
Для розрахунку кількості речовини використовується формула:
![]() , де N — кількість часточок (або атомів молекул).
, де N — кількість часточок (або атомів молекул).
Розв'язування задач.
Яка кількість речовини містить 10,5•1023 атомів заліза?
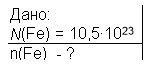
Розв'язання.
![]()
Відповідь: 1,75 моль заліза.
V. УЗАГАЛЬНЕННЯ Й СИСТЕМАТИЗАЦІЯ ЗНАНЬ, ЗАСТОСУВАННЯ ЇХ:
Колективне складання таблиці:
Розрахувати кількість речовини кожного з елементів, заповнивши таблицю.
|
Хімічна формула |
Кількість загальна |
Речовина Кількість Карбону |
Кількість Гідрогену |
|
СН4 |
2 |
|
|
|
С4Н10 |
4 |
|
|
|
С7Н16 |
6 |
|
|
Робота в парах за завданнями:
1. Скільки молекул міститься у воді кількістю речовини 15 моль?
Скільки молекул міститься в сульфатній кислоті кількістю речовини 12 моль?
2. Дано:
а) 1,3∙1023 атомов Сульфуру;
б) 1,2∙1023 атомов Сульфуру.
Обчисліть кількість речовини.
3. Скільки атомів міститься в міді кількістю речовини 1,5 моль, 2,5 моль?
Учні, які швидко справились з завданнями, опрацьовують додаткові завдання. (Додаток 2)
VI. ДОМАШНЄ ЗАВДАННЯ
Вивчити § 19 підручника .
Виконати завдання 130; 131*.
VlI. ПІДБИТТЯ ПІДСУМКІВ УРОКУ
- Що нового ви дізнались на уроці?
- Чи все було зрозуміле?
- Що викликало утруднення?
Додаток 1.
Картка №1.
1. Скільки молекул міститься у воді кількістю речовини 15 моль?
2. Дано:
1,3∙1023 атомов Сульфуру;
Обчисліть кількість речовини.
3. Скільки атомів міститься в міді кількістю речовини 1,5 моль?
Картка №2.
1. Скільки молекул міститься в сульфатній кислоті кількістю речовини 12 моль?
- Дано:
1,2∙1023 атомов Сульфуру.
Обчисліть кількість речовини.
- Скільки атомів міститься в міді кількістю речовини 2,5 моль?
Додаток 2.
Додаткові завдання
- Скільки атомів міститься в білому фосфорі, формула якого P4, кількістю речовини 3,5 моль, 0,025 моль?
- Скільки атомів і молекул міститься в кисні кількістю речовини 1,5 моль?
- Яка кількість речовини атомів Карбону й Гідрогену міститься в 1 моль речовин:
а) CH4; б) C2H6; в) C4H10; г) C6H6 ?
- Яка кількість речовини атомів Оксигену міститься в 1 моль речовин:
а) калій оксид; б) сульфур (IV) оксид; в) сульфур (VI) оксид;
г) манган (VII) оксид; д) бор (III) оксид; є) хлор (V) оксид.
- Яка кількість речовини атомів Гідрогену й Оксигену міститься у воді кількістю речовини:
а) 0,01 моль; б) 0,5 моль; в) 2 моль; г) 15 моль.


про публікацію авторської розробки
Додати розробку
