Конспект уроку з теми: "Молярна маса речовини"
|
Тема |
Молярна маса речовини |
|
Мета |
- Сформувати поняття молярної маси речовини; визначити зв‘язок між кількістю речовини і масою, порівняти поняття відносних атомної та молекулярної мас і молярної маси; сформувати навички розрахунку кількості речовини, виходячи з молярної маси речовин, і маси речовини, виходячи з молярної маси й кількості атомів чи молекул; - розвивати мислительні прийоми: аналіз, синтез, порівняння; сприяти розвитку розумової діяльності; - виховувати взаємоповагу, доброзичливість, працюючи в парах; на основі використання міжпредметних зв‘язків сприяти формуванню елементів наукового світогляду. |
|
Обладнання та матеріали |
Періодична система хімічних елементів Д. І. Менделєєва; картки з завданнями, комп’ютер. |
|
Базові поняття й терміни |
Атом, молекула, кількість речовини, моль, відносні атомна й молекулярна маси, молярна маса. |
|
Тип уроку |
Урок засвоєння нових знань, навичок і вмінь. |
|
Форми й методи |
самостійна робота, прийом «Самоперевірка», бесіда, розповідь учителя, розв’язування задач, робота в парах, обговорення результатів |
Структура уроку
- Організаційний етап
- Актуалізація опорних знань
- Повідомлення теми, мети, завдань уроку та мотивація навчальної діяльності
- Вивчення нового матеріалу
- Поняття молярної маси речовини.
- Розрахунок молярної маси речовини.
- Розрахунок кількості речовини, виходячи з молярної маси.
- Узагальнення й систематизація знань
- Домашнє завдання
- Підбиття підсумків уроку
ХІД УРОКУ
І. ОРГАНІЗАЦІЙНИЙ ЕТАП
ІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Самостійна робота за картками.
1 варіант 2 варіант
1. Скласти формулу, дати назву:
NaS Cr(III)Cl
P(III)O HS(II)
Fe(III)Cl AgS
C(IV)S LiO
2. Розрахувати відносну молекулярну масу:
KClO3 Fe2O3
P2O5 K2SO4
3. Визначити число молекул, якщо кількість речовини:
CaO = 6моль. MgO = 8моль.
Самоперевірка (виконані завдання проектуються на екран).
Учні виставляють собі бали та здають учителю.
Бесіда 1. Дайте визначення поняття «кількість речовини».
- У яких одиницях вимірюється кількість речовини?
IIІ. ПОВІДОМЛЕННЯ ТЕМИ, МЕТИ, ЗАВДАНЬ УРОКУ ТА МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ
Щоб хімію добряче знати,
Треба вміти рахувати.
Спочатку маси речовин,
Але це тільки на почин.
Проте почин – один з початків,
Формування вмінь й задатків.
Не навчишся, маси рахувати
Надалі важко буде хімію вивчати.
Так це чи ні, ми зможемо переконатися тільки через певний проміжок часу.
IV. ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. ПОНЯТТЯ МОЛЯРНОЇ МАСИ РЕЧОВИНИ.
Запитання.
Які різновиди маси вам уже знайомі? (Відносні атомна й молекулярна маси.)
Розповідь учителя.
Усі часточки мають певну масу. Якщо відома маса однієї молекули, то можна розрахувати масу двох, десяти, мільярда молекул і навіть одного моль молекул. Маса, яку має один моль атомів або молекул, є певною характеристикою речовини.
Запис в зошит
Маса одного моль речовини називається молярною масою речовини. Вона позначається буквою M і має одиницю вимірювання г/моль.
Розв'язування задач.
Розрахуємо масу 1 моль частинок різних речовин.
1) Маса однієї молекули водню дорівнює 3,35∙10-24 г. Яка маса 1 моль водню?
Розв'язання:
М = т∙NА = 3,35∙10-24г ∙ 6∙1023 1/моль ≈ 2 г/моль .
2) Маса однієї молекули кисню дорівнює 5,33∙1023 г. Яка маса 1 моль кисню?
Розв'язання:
М = т∙NА = 5,33∙10-23 г ∙ 6∙1023 1/моль ≈ 32 г/моль .
3) Маса одного атома Кальцію дорівнює 6,65∙1023 г. Яка маса 1 моль кальцію?
Розв'язання:
М = т∙NА = 6,65∙10-23 г ∙ 6∙1023 1/моль ≈ 40 г/моль.
Розповідь учителя.
Розраховані нами молярні маси водню, кисню й кальцію дорівнюють їхнім відносним молекулярним (для кальцію — атомній) масам. Якщо ми будемо розраховувати в такий же спосіб молярні маси інших речовин, то побачимо, що в усіх випадках вони будуть чисельно дорівнювати відносним молекулярним, атомним або формульним масам цих речовин. Повертаючись до теми попереднього уроку, вчитель повідомляє, що число Авогадро встановлене таким чином, щоб відносна молекулярна маса чисельно дорівнювала молярній масі речовини.
Незважаючи на те, що ці маси чисельно дорівнюють одна одній, вони мають різний зміст:
- відносна молекулярна (або атомна) маса показує, у скільки разів маса молекули (або атома) більша від 1/12 маси атома Карбону; є безрозмірною величиною;
- молярна маса показує, яку масу має 1 моль молекул (або атомів); вимірюється в грамах.
2. РОЗРАХУНОК МОЛЯРНОЇ МАСИ РЕЧОВИНИ.
Розповідь учителя.
Оскільки молярна маса речовини чисельно дорівнює відносній молекулярній або формульній масі, то розрахувати її можна аналогічно.
Запис в зошит
Таким чином, молярна маса речовини дорівнює сумі атомних мас усіх елементів, які входять до складу речовини з урахуванням їхніх індексів, і має розмірність г/моль.
3. РОЗРАХУНОК КІЛЬКОСТІ РЕЧОВИНИ ЗА МОЛЯРНОЮ МАСОЮ.
Розповідь учителя.
Оскільки молярна маса — це маса 1 моль речовини, то її можна використовувати для розрахунку кількості речовини:
![]()
За допомогою цієї формули можна розрахувати масу речовини, знаючи кількість речовини, й навпаки.
Колективне виведення формули: т = n ∙ М
Розв'язування задач.
1) Розрахувати масу 8 моль води.
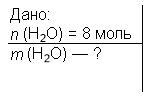
Розв'язання.
Розрахуємо молярну масу води:
М = 2∙Ar(Н) + Ar(O) = 2 ∙ 1 + 16 = 18 г/моль.
Формула розрахунку маси:
т = n ∙ М , т = 8 ∙ 18 г/моль = 144 г.
Відповідь: 144 г води.
 V. УЗАГАЛЬНЕННЯ Й СИСТЕМАТИЗАЦІЯ ЗНАНЬ
V. УЗАГАЛЬНЕННЯ Й СИСТЕМАТИЗАЦІЯ ЗНАНЬ
Завдання (робота в парах).
1) Обчисліть кількість речовини води масою:
а) 9 г; б) 36 г.
2) Яку масу має вуглекислий газ (карбон (IV) оксид) кількістю речовини:
а) 0,5 моль; б) 2 моль.
3) Обчисліть масу:
а) 3∙1023 атомів Сульфуру; б) 12∙1023 атомів Оксигену.
4) Яка маса атомів Сульфуру міститься в 15 г:
а) ферум (II) сульфіду; б) хром (III) сульфіду;
Після виконання завдань у парах результати обговорюються в класі.
VІ. ДОМАШНЄ ЗАВДАННЯ
Вивчити § 20 підручника. Виконати завдання 141. № 142*.
VlІ. ПІДБИТТЯ ПІДСУМКІВ УРОКУ
Прочитайте епіграф уроку.
Питання: Як він пов’язаний з вивченим матеріалом?
Додаток 1.
Картка № 1
1 варіант
1. Скласти формулу, дати назву:
NaS
P(III)O
Fe(III)Cl
C(IV)S
2. Розрахувати відносну молекулярну масу:
KClO3
P2O5
3. Визначити число молекул, якщо кількість речовини:
(CaO) = 6моль.
Картка № 2
2 варіант
1. Скласти формулу, дати назву:
Cr(III)Cl
HS(II)
AgS
LiO
2. Розрахувати відносну молекулярну масу:
Fe2O3
K2SO4
3. Визначити число молекул, якщо кількість речовини:
(MgO) = 8моль.
Додаток 2.
Картка № 1.
1) Обчисліть кількість речовини води масою: 9 г;
2) Яку масу має вуглекислий газ (карбон (IV) оксид) кількістю речовини: 0,5 моль;
З) Обчисліть масу:
3∙1023 атомів Сульфуру;
4) Яка маса атомів Сульфуру міститься в 15 г:
ферум (II) сульфіду;
Картка № 2.
1) Обчисліть кількість речовини води масою: 36 г.
2) Яку масу має вуглекислий газ (карбон (IV) оксид) кількістю речовини: 2 моль.
З) Обчисліть масу:
12∙1023 атомів Оксигену.
4) Яка маса атомів Сульфуру міститься в 15 г:
хром (III) сульфіду;


про публікацію авторської розробки
Додати розробку
