Урок: Кисень. Озон. Фізичні та хімічні властивості. Склад повітря.
Тема. Оксиген. Поширеність Оксигену в природі. Кисень, склад його молекули, поширеність у природі. Фізичні властивості кисню. ( 7 клас)
Мета :
Знаннєвий компонент
повторити класифікацію простих речовин, властивості металів і неметалів; склад молекули кисню, якісний та кількісний склад повітря; ознайомити учнів з історією відкриття кисню; познайомити із речовиною озоном, як алотропною видозміною Оксигену;
Діяльнісний компонент
розрізняти поняття про Оксиген як хімічний елемент і кисень як просту речовину
описувати поширеність Оксигену в природі; його фізичні властивості; характеризувати фізичні властивості повітря;
аналізувати склад повітря, його значення;
складати формули простих та складних речовин, що входять до складу повітря;
використовувати знання про Періодичну систему;
визначати місце Оксигену в Періодичній системі та будову його атома;
Громадянська відповідальність
розвивати творчі здібності учнів, уміння узагальнювати та робити висновки, логічно мислити: виділяти головне, аналізувати, порівнювати; сприяти розвитку в учнів екологічної культури;
Здоров’я і безпека
Ознайомити зі шляхами утворення озону в побуті, проблемою чистого повітря. ; пояснити згубну дію різних домішок на життедіяльність живих організмів; ознайомити учнів з негативними наслідками забруднень повітря;
Екологічна безпека і сталий розвиток
Розробити шляхи боротьби із забрудниками повітря. Розкрити біологічну роль кисню.
Підприємливість і фінансова грамотність
розкрити взаємозв'язок хімії, людини, природи, показати, що головною причиною забруднення природи є людина.
Тип уроку: поглиблення і засвоєння знань.
Форми роботи: вправа «мікрофон», розповідь учителя , бесіда, робота з підручником, складання опорних схем, самостійна робота, вправа «Закінчити речення». написання хімічного диктанту,
Міжпредметні зв’язки: природознавство, біологія, фізика, географія.
Наочність та обладнання: таблиця «Класифікація речовин», діаграма «Поширення елементів у природі», опорна схема «Кисень», діаграма «склад повітря».
Девіз уроку: «Кисень – проста речовина, навколо якої обертається земна хімія».
Я. Берцепіус
Хід уроку
І. Організація класу.
Оголошення теми і цілей уроку.
ІІ. Актуалізація опорних знань і мотивація навчальної діяльності.
1.Вправа «Мікрофон».
Учні по черзі відповідають на запитання, передаючи один одному мікрофон.
Запитання.
1. На які дві групи поділяються речовини за складом молекул?
2. Які речовини називають простими?
3. Які речовини називають складними?
4. Наведіть приклади простих і складних речовин.
5. У природі хімічні елементи зустрічаються у вигляді простих речовин чи складних?
6. Яких речовин більше в природі - простих чи складних?
7. На які групи поділяють прості речовини?
8. Яких елементів у природі більше – металічних чи неметалічних?
(Звертаємося до періодичної системи хімічних елементів і згадуємо розташування металічних і неметалічних елементів у таблиці).
9. Яких простих речовин у природі більше: металів чи неметалів?
10. Наведіть приклади простих речовин неметалів, що зустрічаються у природі.
11. Наведіть приклади простих речовин металів, що зустрічаються у природі.
12. Які неметалічні елементи є нейбільш поширеними у природі?
13. Які прості речовини неметали входять до складу повітря?
14.Що таке атмосфера і що входить до її складу.
15. Чи можна повітря записати формулою? Чому?
16.Які речовини входять до складу повітря?
17.Без якої складової повітря людина може прожити тільки кілька хвилин?
ІІІ. Вивчення нового матеріалу.
1.Склад повітря
Розповідь з елементами бесіди.
--Що ж таке повітря? Незважаючи на те, що людина живе на дні "повітряного океану", вона вивчила повітря значно пізніше, ніж інші речовини. Це пояснюється тим, що повітря невидиме, не має ні запаху, ні смаку. Лише наприкінці XVIII століття А.Лавуазьє визначив склад повітря. До його складу входять: азот - 78%, кисень - 21%, вуглекислий газ - 0,03%, аргон - 0,93%. Отже, повітря – складна суміш газів
Склад повітря:
|
Газ
|
Частка газу, % (округлене)
|
||
|
Назва
|
Формула
|
об'ємна
|
масова
|
|
Азот |
N2 |
78 |
75,5 |
|
Кисень |
02 |
21 |
23 |
|
Аргон |
Аг |
0,93 |
1,3 |
|
Карбон (IV) оксид |
С02 |
0,03 |
0,05 |
|
Інші |
|
0,04 |
0,15 |
У повітрі є ще пил, водяна пара і домішки різних газів: сульфуру (IV) оксиду SO2, метану СН4, амоніаку NНз, карбон (ІІ) оксиду СО тощо. Вони шкідливі для довкілля і здоров'я людини, забруднюють атмосферне повітря. Повітряний океан, що оточує нашу планету, утримується силами земного тяжіння. Якби Земля втратила свою повітряну оболонку – атмосферу, то перетворилася б на мляву, позбавлену рослинності, пустелю.
--Які властивості повітря?(Бесіда) ( Повітря невидиме і безбарвне. Чисте повітря запаху не має. Повітря не має смаку Повітря не має форми. Повітря пружне Повітря легше води, тобто менш щільне, ніж вода. Повітря – погано проводить тепло. При нагріванні повітря розширюється, а при охолодженні стискається.)
Поміркуйте
-А чому ж тоді небо блакитне? (Бо товстий шар повітря, який оточує нашупланету, освітлений Сонцем набуває блакитного забарвлення. Коли космонавтидивляться на Землю із космічного корабля, вони бачать, як наша планета переливається всіма відтінками блакитних кольорів)
— Поміркуйте! Чому космонавти, які виходять у відкритий космос, і водолази,які спускаються в морські глибини, вимушені вдягати спеціальні скафандри?
— Чому кулька, заповнена повітрям, не тонуть (Повітря легше за воду.)
— Чому м’яч після удару відскакує? (Повітря пружне, воно має здатністьстискатися. При ударі м’яча об підлогу або землю повітря, яке в ньомуміститься, миттєво стискається. Оскільки воно пружне, то відразу розширюється,внаслідок чого м’яч відскакує після удару.)
— Чому в теплій кімнаті кулька більша? А в холодній та сама кулька стає меншою? (Від нагрівання повітря розширюється, від охолодження — стискається.)
— Чому птахи настовбурчують пір’я під час морозів?
— Чому вікна в будинках мають подвійне, а іноді — потрійне скло?
— Коли краще зберігається тепло в кімнаті: якщо вікно засклене товстимсклом чи коли воно з подвійними рамами?
2. Повітря необхідне для всіх живих істот. Киснем дихають не тільки люди, тварини, але й рослини, мікроорганізми. Відомо, що людина може існувати без їжі 40 днів, без води – 5 днів,а без повітря не витримає й 5 хвилин. Повітря має значення для рослин, бо є не тільки середовищем життя, джерелом кисню для дихання, але й постачає рослинам вуглекислий газ. Без якого не може відбуватися фотосинтез. Зміна вмісту вуглекислого газу в повітрі впливає на фотосинтез. А значить, і на живлення зелених рослин. Про роль кисню в природі написані тисячі книг. Усі тварини дихають киснем і в безкисневій атмосфері просто не можуть існувати. Лише деякі мікроорганізми - анаеробні бактерії, живуть без кисню. Кисень під час дихання окиснює вуглеводи та інші речовини, і в цьому хімічному процесі виділяється та енергія, що витрачається на всі життєві процеси.
- Запитання. В результаті якого процесу утворюється кисень у природі?
Весь кисень виник і зберігається на планеті завдяки процесу фотосинтезу.
3 . Поширеність Оксиґену у природі.
Оксиген входить до складу таких біологічно важливих речовин, як вода, білки, жири, вуглеводи, нуклеїнові кислоти, до 50–85 % ваги живих і рослинних тканин. Атоми Оксиґену містяться у багатьох мінералах: піску, глині, вапняку, залізних та інших рудах, багатьох солях. Оксиґен утворює просту речовину кисень, що є компонентом повітря.
|
Відомості про... |
|
|
Оксиген |
Кисень |
|
Хімічний символ - О Аr (О) = 16 Валентність - ІІ Розташування в ПС: порядковий номер – 8, 2 2 період, VІ група Будова атома: Оксиген містить 8 протонів і 8 електронів |
Проста речовина, неметал Хімічна формула - О2 Мr (О2) = 32 Компонент повітря Невелика кількість кисню розчинена у природній воді |
Учні дану таблицю переносять в робочий зошит.
4. Коли кисень був відкритий вперше?
Перші відомості про кисень як складову частину повітря прийшли до нас з глибини VІІІ сторіччя. Китайський вчений Мао-Хоа встановив, що у повітрі є газ, який підтримує дихання і горіння.
Через 10 століть, незалежно один від одного, кисень відкрили К. Шеєле (шведський природодослідник) і Дж. Прістлі (англійський вчений). В історії хімії важливого значення набуло відкриття А. Лавуазьє. Вчений встановив, що кисень є складовою повітря, який підтримує горіння. На цій підставі він створив кисневу теорію горіння, яка до сьогодні залишається правильною та дає змогу пояснити багато хімічних процесів.
5. Фізичні властивості кисню. За звичайних умов кисень – безбарвний газ без смаку і запаху. Рідкий кисень - блакитна рідина, що притягується магнітом. Твердий кисень має високу густину, тому у рідкому тоне. Скраплений кисень зберігають у посудинах Дьюара. У домашніх умовах ми маємо ці посудини у складі термосів. Твердий кисень плавиться за температури – 2180 С. Рідкий кисень кипить при – 1830С. Кисень малорозчинний у воді: за н.у. (00С, 1 атм) у 100 л води розчиняється 5 л кисню, а при 200С розчинність зростає до 3,1 л. кисень важчий за повітря.
6. Оксиген утворює 2 алотропні форми – кисень О2 та озон О3.
Озон – хімічна речовина, яка складається з трьох атомів Оксигену. На відміну від кисню,озон має запах, є отруйним,його температури плавлення та кипіння вищі. Він виявляє більшу хімічну активність. У природі утворюється з кисню під час грозових розрядів та під впливом ультрафіолетового випромінювання Сонця, або під час окиснення смоли хвойних дерев.
Тому під час грози або перебування у хвойному лісі ми відчуваємо свіжий запах. Це і є озон.
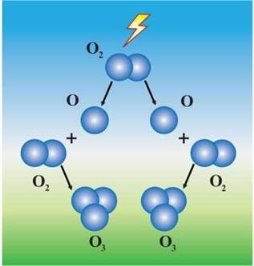
Якщо зобразити даний процес за допомогою хімічного рівняння, то воно матиме такий вигляд:
3О2 → 2О3
Тобто, з 3 молекул кисню утворюється 2 молекули озону.
А зараз я пропоную розглянути властивості озону у вигляді порівняльної таблиці
Робота з таблицею. Властивості кисню та озону. Порівняння учнями.
|
|
КИСЕНЬ |
ОЗОН |
|
1. Хімічна формула |
О2 |
О3 |
|
2. Відносна молекулярна маса |
32 |
48 |
|
3. Агрегатний стан |
Газ |
Газ |
|
4. Колір |
Безбарвний |
Синій |
|
5. Запах |
Без запаху |
Своєрідний, різкий |
|
6. Фізіологічна дія |
Не отруйний |
Отруйний |
|
7. Здатність вступати в реакції |
Висока |
Дуже висока |
Наша Земля оточена повітряною оболонкою, яку називають атмосферою (грец. атмос - «пара» і сфера — «куля». Вона захищає планету від перегрівання, надмірного охолодження, космічного випромінювання та метеоритів. Атмосфера складається з чотирьох шарів, кожний з яких має свою висоту, температуру та значення. Нижній шар атмосфери (висотою до 17 км) називається тропосферою. Над нею знаходиться наступний шар - стратосфера, її товщина майже ЗО км. Озоновий шар розташований на висоті 20 - 25 км і виконує захисну роль. Найвищий шар атмосфери називається іоносферою. Вона досягає висоти 100 км над Землею. Озон (О3) у перекладі означає «той, що пахне». У невеликих кількостях утворюється в повітрі з кисню під час сильних грозових дощів. За малих концентрацій (менше 0,03 г/мл) має приємний запах післягрозового повітря й діє стимулююче на організм, підвищує його стійкість проти холоду, гіпоксії, дії токсичних речовин, поліпшує роботу легень, нормалізує артеріальний тиск, підвищує рівень гемоглобіну у крові, імунобіологічну стійкість організму. Однак, якщо його концентрація у повітрі підвищується, приємний запах перетворюється на неприємний, що нагадує запах хлору, а ще за більших концентрацій – на солодкувато – нудний запах оксидів Нітрогену (це є свідченням того, що концентрація смертельна). Озон за високих концентрацій спричиняє спазм легень, подразнює верхні дихальні шляхи. Збільшується ймовірність утворення злоякісних пухлин легень. Для захисту органів дихання використовують протигази з натронним вапном або ізолюючий протигаз та захисний костюм. Тимчасово може допомогти ватно-марлева пов’язка, змочена розчином соди і калій йодиду. У разі отруєння допомагають інгаляції киснем, тепло, ін’єкції глюкози й кальцій хлориду, серцеві препарати. Озон використовують для дезінфекції води, вибілювання олій, борошна, паперу, тканин.
Проблема озону в атмосфері має два пов'язаних з людською діяльністю чинника :
- руйнування озонового шару у верхніх шарах атмосфери;
- збільшення вмісту озону в нижніх шарах атмосфери (навколоземні простори).
Вчитель. Вплив на людину руйнування озонового шару:
- Рак шкіри. Вплив ультрафіолетових променів створює підвищений ризик розвитку декількох типів раку шкіри, у тому числі злоякісної меланоми, базально-і плоскоклітинного раку клітин.
- Пошкодження очей. Прямий вплив УФ-випромінювання може призвести до фотокератиту (сніжної сліпоти) і катаракти.
- Пошкодження імунної системи. Збільшення впливу ультрафіолетових променів послаблює захисну реакцію імунної системи.
- Прискорює старіння шкіри. Постійний вплив УФ-випромінювання може призвести до фото алергії, що призводить до висипу у світлошкірих людей.
- Інші ефекти. Озонові хімічні речовини можуть викликати утруднення дихання, біль у грудях, подразнення в горлі і перешкоджають функціонуванню легенів.
Проблемне питання: Які заходи може вжити кожен з Вас,щоб сповільнити зміни клімату та руйнування озонового шару?
Приклади відповідей:
- купувати місцеві та сезонні продукти там, де це можливо. Купівля несезонних продуктів означає те, що вирощують їх у теплицях або імпортують, часто повітряним транспортом.
- Обирайте душ, а не ванну, та не використовуйте більше гарячої води,ніж вам потрібно.
- Використовуйте акумулятори, що заряджаються. Використані батарейки забруднюють навколишнє середовище, оскільки містять важкі метали.
- Перегляньте користування особистим автомобілем. Автомобілі є одним із найбільших джерел викидів С02 та інших парникових газів.
- Утеплюючи будинок, зменшуючи потужність обігрівача чи кондиціонера, ви заощаджуєте енергію та гроші.
- Вимикайте кондиціонер, коли залишаєте кімнату,це заощаджує електроенергію. Коли купуєте новий холодильник або кондиціонер, переконайтеся, що він не містить ХФМ.
- Уникай те упакованих виробів та пластикових пакетів.
- Висаджуйте дерева у своєму саду, шкільному дворі або землях громади. Дерева поглинають вуглекислий газ при зростанні, що значно уповільнює кліматичні зміни.
- Закріплення знань
- Гра «Вірю – не вірю» - письмово у зошитах.
- Кисень добре розчиняється у воді (не вірю)
- Він легший за повітря (не вірю)
- Рідкий кисень притягується магнітом (вірю)
- Молекула трьохатомна (не вірю)
- Білий газ (не вірю)
- Має різкий запах (не вірю)
- У твердому стані – сині кристали (вірю)
- Молекула двохатомна (вірю)
- Трохи важчий за повітря ( вірю)
- Солодкий на смак
2.Гра «Визнач елемент і речовину» - учні отримують картки на яких написана певна особливість чи характеристика, потрібно визначити про що йдеться у картці – про хімічний елемент Оксиген чи про речовину кисень. Карту прикріплюють на магнітній дошці у відповідну графу.
- Входить до складу повітря.
- Погано розчиняється у воді.
- Утворює дві прості речовини.
- Утворюється у результаті фотосинтезу рослин.
- Проявляє валентність ІІ.
- Має заряд ядра +8.
- Підтримує дихання.
- Підтримує горіння.
- Входить до складу молекули води.
- Входить до складу молекул багатьох органічних речовин.
- Розташований у ІІ періоді.
6. Узагальнення знань
Наголошуємо учням, що Оксиген – типовий неметалічний елемент. Проста речовина його кисень – неметал. Виявляє всі фізичні властивості типових неметалів: безбарвний, не має запаху і смаку, важчий за повітря, має здатність зріджуватися і тверднути за низьких температур.
- Підсумок уроку


про публікацію авторської розробки
Додати розробку
