Урок "Кристалічні гратки. Залежність фізичних властивостей речовин від типів кристалічних граток"
Тема уроку: Кристалічні ґратки. Залежність фізичних властивостей речовини від типів кристалічних ґраток
Мета уроку:
- навчальна:використовуючи інтерактивні технології, показати взаємозв’язок між будовою речовин та їх фізичними властивостями на підставі знань про типи хімічних зв’язків у неорганічних речовинах та встановити залежність властивостей речовин від їхньої будови, розширити й поглибити уявлення про зумовленість фізичних властивостей речовин, типом хімічного зв’язку та кристалічних ґраток, закріпити знання про основні типи кристалічних ґраток (атомна, молекулярна, йонна, металева),
- розвивальна: сформувати вміння характеризувати фізичні властивості речовин за типом кристалічних ґраток і видом хімічного зв’язку, розвивати вміння аналізувати, робити висновки, формувати навички самостійної роботи й самоконтролю; розвивати пізнавальну активність; стимулювати реалізацію творчих здібностей учнів, вміння проводити аналіз, узагальнювати, робити висновки; вміння працювати з опорною таблицею, карткою-інструкцією.
- виховна: відкрити багатогранний світ молекулярної хімії, виховувати любов і повагу до природи, до процесів, що відбуваються в ній, виховання самостійності, наполегливості в досягненні своєї мети, культури праці.
Тип уроку: комбінований (з використанням інтерактивних технологій).
Форми роботи: бесіда, розповідь, демонстрації,методи швидке письмо, зведена таблиця, кейс-метод, гра «Вірю не вірю», гра «Хімічна естафета», лабораторний дослід.
Методи та прийоми: словесні: бесіда, розповідь; наочні: демонстрація, комп’ютерна програма; практичний: лабораторний дослід.
Обладнання та матеріали: Періодична система хімічних елементів
Д. І. Менделєєва, моделі кристалічних ґраток, приклади речовин з різними типами кристалічних ґраток, комп’ютерна програма(презентація), дидактичний роздатковий матеріал.
Мультимедійні засоби навчання: Комп'ютер, мультимедійний проектор, екран
Програмні ресурси: Презентація
Друкований роздатковий матеріал: Інструкції по визначенню кристалічних граток
Структура уроку:
- Організаційна частина уроку.
- Актуалізація знань.
- Формулювання теми уроку, мети.
- Аналіз, конкретизація отриманої раніше інформації.
- Засвоєння нового матеріалу.
- будова твердих речовин;
- будова кристалічних граток;
- залежність фізичних властивостей речовин від типів кристалічних ґраток
- Демонстраційні досліди, що підтверджують отриману інформацію.
- Робота в лабораторних зошитах із закріплення.
- Узагальнення інформації з теми уроку, корекція отриманих знань.
- Домашнє завдання.
- Підбиття підсумків уроку
Хід уроку.
1. Організаційний момент
Організація класу. Емоційна рефлексія.
Шановні учні, сьогодні на уроці ми працюватимемо разом, я розраховую на вашу підтримку та допомогу. Генрі Форд писав: «Зібратися разом – це початок, триматися разом – це прогрес, працювати разом – це успіх». То ж я вам бажаю:
Не просто слухати, а чути,
Не просто дивитися, а бачити,
Не просто відповідати, а міркувати,
Дружно і плідно працювати! (Слайд 2).
2.Актуалізація опорних знань
1.Вправа.Розумова розминка
- Як ти розумієш зміст поняття «хімічний зв'язок»?
- Які типи хімічного зв'язку ви знаєте?
- Які види ковалентного зв΄язку ви знаєте? Чим вони відрізняються?
- Між якими елементами здійснюється ковалентний зв΄язок? ( Слайд 3)
2. Метод «Швидке письмо». ( Слайд 4)
Гра « Вірю –не вірю»
1. Йонний зв’язок виникає між йонами (так)
2. Йони – це нейтральні частинки (ні).
3. Йони – це заряджені частинки (так ).
4. Ковалентний зв’язок буває двох типів – полярний і неполярний( так ).
5. Ковалентний полярний зв’язок утворюється між атомами з однаковою електронегативністю (ні).
6. Ковалентний неполярний зв’язок утворюється між атомами одного і того ж неметалу (так).
7. Ковалентний неполярний зв’язок утворюється між атомами з різною електронегативністю (ні).
8. NaCl – сполука з йонним зв’язком (так).
9. О2 – сполука з ковалентним полярним зв’язком (ні).
10. HCl –сполука з йонним зв’язком (ні).
Відповіді. 1. Так 2. Ні 3. Так 4. Так 5. Ні 6.Так 7. Ні 8. Так 9. Ні 10.Ні. ( Слайд 5)
Мотивація навчальної діяльності.
Бесіда
- Здогадайтесь, які речовини перед вами? (Слайд 6)
Це три величезні кристали: кухонної солі, льоду і алмазу. Зовні вони подібні.
- Яким чином їх можна розрізнити? (нагріти, розчинити, спробувати розколоти)
- Чим викликана така відмінність?
Це ми сьогодні з’ясуємо.
3. Повідомлення теми уроку.
Отже, існують різні типи зв’язку. Чи впливає тип хімічного зв’язку на будову речовини та її властивості? Саме цю проблему ми повинні з вами розв’язати на уроці.
Тема нашого уроку: Кристалічни гратки. Залежність фізичних властивостей від типів кристалічних граток.(записуємо в зошитах,на дошці ) ( Слайд 7)
Знати: поняття кристалічні гратки,типи кристалічних ґраток
Уміти: визначати типи кристалічних краток, прогнозувати властивості речовин залежно від виду хімічного зв'язку і типу кристалічних ґраток.
Розуміти: залежність фізичних властивостей речовин від їх кристалічної будови. ( Слайд 8)
Вивчення матеріалу нової теми
- Перегляд відеосюжету «Три агрегатних стани води». ( Слайд 9)
З роси, з морів, річок і плес
Вода як перейде у пару,
Одразу ж лине до небес.
Щоб утворити в небі хмари.
І впасти з хмар на ниви
Як сніг, як град, як злива.
Знов перейти у пару
І повернутись в хмару,
І впасти з хмар на ниви
Як сніг, як град, як злива.
Цей шлях, що вона робить,
І зветься колообіг.
З уроків природознавства та фізики які ви знаєти агрегатні стани хімічних сполук? ( Слайд 10)
Якщо гази характеризуються повною невпорядкованістю розташування молекул одна відносно одної, то в рідинах деяка впорядкованість частинок спостерігається. Адже для рідин характерна наявність певного об'єму, хоча й відсутня певна форма. Рідини займають проміжне місце між газами і твердими тілами, яким властивий суворий порядок розташування частинок, що утворюють речовину.У твердих речовинах частинки розташовані у просторі суворо закономірно для кожної речовини.
Твердих речовин найбільше. При певних умовах будь-яка речовина може стати твердою.
Ось так. Камінь – об'єкт оточуючого світу. І, оскільки, у нас урок хімії, ми розглянемо цей об’єкт з хімічної точки зору. Які запитання ми можемо поставити?
- Які частинки утворюють тверді речовини?
- Як вони сполучаються між собою?
- Як це впливає на властивості?
- Якщо лід розтане, чи збережеться його кристалічна будова? ( Ні)
Висновок: кристалічна будова властива речовинам в твердому агрегатному стану
- Чи для всіх твердих речовин можлива кристалічна будова? ( Слайд 11)
Тверді речовини можуть мати будову аморфну та кристалічну.
- Чим це визначається? (розташуванням структурних частинок)
Аморфні речовини не мають чітко вираженої структури, навіть у твердому стані
- Усі речовини у твердому стані можуть мати таку будову:
|
|
Будова твердих речовин |
|
||
|
|
||||
|
Аморфна |
|
Кристалічна |
||
|
Структурні частинки речовини розміщуються безладно |
|
Структурні частинки речовини розміщуються впорядковано |
||
|
Приклад: глина |
|
Приклад: кухонна сіль |
||
Відомо, що у твердих речовинах частинки, що їх утворюють, розташовані у просторі суворо закономірно для кожної речовини.
Кожна тверда речовина має свою кристалічну гратку. Структурну впорядкованість кристалічних речовин називають кристалічними гратками.
( Слайд 12)
- Класифікація кристалічних ґраток. ( Слайд 13)

Самостійна робота. ( Слайд 14,15,16)
Завдання :
- Які частинки розміщені у вузлах кристалічної ґратки, яку ви вивчаєте?
- Назвіть вид хімічного зв’язку та тип хімічних елементів що утворюють даний тип кристалічної ґратки.
- Вкажіть характерні фізичні властивості речовин з даним типом кристалічної ґратки.
- Наведіть приклади речовин.
Після закінчення роботи, кожна група звітує і записує на дошці отриману інформацію в таблицю:
|
Особливості кристалічної гратки |
молекулярна |
атомна |
йонна |
|
Частинки у вузлах гратки |
Молекули
|
Атоми
|
Йони
|
|
Хімічний зв'язок |
Слабка міжмолекулярна взаємодія
|
Міцний ковалентний
|
Міцний йонний
|
|
Фізичні властивості речовин
|
Гази, рідини, (якщо тверді, то крихкі), леткі, легкоплавкі, пластичні, мають низькі tпл і tкип
|
Тверді, іноді крихкі, міцні, не розчинні у воді, мають високі tпл і tкип
|
Тверді, тугоплавкі, розчинні у воді, високі tпл і tкип, розплави і розчини електропровідні |
|
Приклади речовин |
більшість неорганічних т а органічних речовин, водаH2O, більшість неметалів воденьH2,азот N2, кисеньO2, хлорCl2, фосфор P4,сірка S8 та інші, крім Si та C . |
Алмаз графіт, кремній, пісок германій, бор, силіцій карбід. |
Сполуки металічних і неметалічних елементів:солі, оксиди металів, луги |
Йонна кристалічна гратка
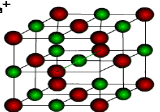 Кухонна сіль
Кухонна сіль
У вузлах йонних кристалічних граток лежать йони, тому гратки і отримали таку назву – йонні. Йонні кристалічні гратки характерні для речовин з йонним зв’язком.
Оскільки йони заряджені протилежно, між ними виникають значні сили притягання. Зруйнувати таку гратку нелегко. Для того, щоб зруйнувати кристал, необхідно затратити велику кількість енергії, саме тому всі речовини з йонною граткою є твердими. Температура плавлення їх досить висока. Наприклад, кухонну сіль можна розплавити при температурі 801˚С. Рекордсмен по тугоплавкості серед йонних сполук – магній оксид. Його можна розплавити при температурі 2800˚С.
Це нелеткі речовини, тому не мають запаху. Вони крихкі. Більшість добре розчиняється у воді, розчини таких речовин проводять струм.
Речовини з йонною кристалічною граткою можна зустріти в природі, в побуті. Приклад: кухонна сіль – натрій хлорид, інші солі , луги, оксиди металів.
Атомна кристалічна гратка
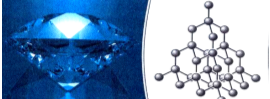 Алмаз
Алмаз Оксид Силіцію (SiO2)
Оксид Силіцію (SiO2)
Раз гратка називається атомною, то у вузлах гратки лежать атоми. Всі атоми розташовані один від одного на однаковій відстані.
Між атомами діють ще більші сили притягання, утворюються дуже міцні ковалентні зв'язки. Зруйнувати їх ще важче, ніж зв'язки між йонами. Тому всі речовини з атомними кристалічними гратками дуже тверді, дуже тугоплавкі, нелеткі. Наприклад, температура плавлення алмаза становить 3500˚С. Крім того, алмаз є самою твердою речовиною в природі.
Ці речовини не розчиняються у воді. Вони не проводять струм, або бувають напівпровідниками.
Атомні гратки має невелика кількість речовин. Це алмаз, з якого роблять діаманти, алмазом ріжуть скло, бурять гірські породи .Графіт, який знаходиться в олівцях. Нам добре знайомий пісок – SіO2. Це також речовина з атомною граткою. Цей предмет, я думаю, вам також знайомий. Ним точимо ножі, сапи завдяки його великій твердості. Називається речовина – силіцій карбід. У його кристалічній гратці чергуються атоми Карбону і Силіцію. Саме ці атоми утворюють атомну кристалічну гратку.
Молекулярна кристалічна гратка
Оксид Карбону (CO2)


1. Ще один тип граток, що існує в природі, – молекулярні кристалічні ґратки. Речовини з такими гратками дуже відрізняються від речовин з йонними та атомними гратками. Причина полягає в тому, що у вузлах лежать молекули. Молекулярні кристалічні гратки можуть утворювати речови, що мають ковалентні зв’язки.
2. Між молекулами діють дуже слабкі сили міжмолекулярного тяжіння. Їх називають силами Ван-дер-Ваальса. Якщо сили притягання слабкі, то й зруйнувати їх дуже легко. Тому всі речовини із молекулярною кристалічною граткою мають невелику твердість, вони легкоплавкі. Наприклад, кристали йоду можна розплавити про 30˚С, а лід плавиться вже при 0˚С. Це леткі речовини, тому майже всі мають запах. Пригадайте нафталін, яким відлякують міль від одягу, що зберігається в шафах. Речовини з молекулярною граткою не проводять струм. Вони мають різну розчинність у воді.
3. Речовини з молекулярною граткою дуже поширені. кристали йоду, цукор, лід.
- Інструкція з визначення типу кристалічної ґратки( Слайд 17)
Визначити до якої групи відноситься дана речовина:
-
Проста речовина – визначити метал чи неметал:
- Ме – мають металічну кристалічну гратку;
- неМе – мають молекулярну кристалічну гратку;
- винятки – деякі неМе мають атомну кристалічну гратку.
-
Складна речовина – визначити клас речовини:
- неМехОу – молекулярну кристалічну гратку; P2O5
- МехОу – йонну кристалічну гратку; Al2O3
- Ме(ОН)х – йонну кристалічну гратку; Cu(OH)2
- НхAn – йонну кристалічну гратку; H2SO4
- MeхAnу – йонну кристалічну гратку. Na2SO4
( Слайд18)
IV. Закріплення нового матеріалу
На закріплення теми виконаємо ряд завдань
- Хімічна естафета ( Слайд 19)
- Кейс-метод( Слайд 20)
Це обговорення учнями ситуацій, що вимагає від них проведення аналізу і прийняття рішень (знаходження розв’язку).
1.Азот переходить у твердий стан за низької температури (-210˚С). Який тип гратки має азот? (молекулярна)
2.Яка з речовин характеризується більшою твердістю – лід чи пісок? Як ви це можете пояснити? (лід має молекулярну, а пісок атомну гратку)
- Елементи С і Sі утворюють схожі за складом оксиди СО2 і SіО2, але СО2 плавиться при -78.5˚С, а SіО2 при +1700˚С. Як ви це можете пояснити? (різні кристалічні гратки)
- Білий фосфор плавиться при +44,2˚С. Яку кристалічну гратку має білий фосфор? (молекулярну)
- Червоний фосфор плавиться при +600˚С. Яку кристалічну гратку має червоний фосфор? (атомну)
6.Якщо розбити кубічний кристал NaCl, він розсипеться на менші кристали. Цікаво, але всі вони матимуть кубічну форму менших розмірів. Чому?
- Лови помилку ( Слайд 21).
Знайдіть зайву речовину в переліку:
- Cl2 , N2, H2O, NaCl;
- AgІ, KCl, O2, NaBr;
- C, Cl2O7, NH3, CO2;
- H2O, MgCl2, CrO3, Al2O3.
V. Узагальнення та систематизація знань
-
Є такий афоризм: Практика без теорії сліпа, теорія без практики мертва.
Кожна гіпотеза тільки тоді стає теорією, коли вона перевірена практикою. ( Слайд 22) - Виконаємо лабораторний дослід
- Техніка безпеки. ( Слайд 23)
Лабораторний дослід ( Слайд 24)
Тема.Ознайомлення з фізичними властивостями речовин атомної ,молекулярної та йонної будови.
Мета: дослідити властивості речовин з різними типами кристалічних граток.
Обладнання: штатив з пробірками, склянка з водою, спиртівка, тримач, зразки речовин ( кухонна сіль – NaCl , цукор – С12Н22О11, графіт – С).
Хід роботи
- Поділіть видану вам речовину на дві пробірки.
- У першу пробірку долийте води. Спостерігайте, чи розчиняється речовина у воді.
- Другу пробірку затисніть тримачем і нагрійте в полум’ї спиртівки. Спостерігайте , чи розплавляється речовина.
- На основі спостережень зробіть висновок про будову речовини. Назвіть тип кристалічної гратки.
- Дані запишіть в таблицю та зробіть висновок.
|
Речовина, Формула |
|
|
|
|
|
Фіз. власти-вості речовин
|
|
|
|
|
|
Тип кристал. Ґратки |
|
|
|
|
|
Вид хім. зв’язку |
|
|
|
|
- Висновок: ( Слайд 25).
Проаналізувавши сьогоднішню роботу з вами, можна підвести висновок, що між складом, будовою, властивостями речовин існує тісний взаємозв’язок, який можна пояснити на підставі будови речовини.
- Давайте встановимо причиново-наслідкові зв’язки між будовою та властивостями речовин( Слайд 26)

- VI. Домашнє завдання ( Слайд 27)
1) Вивчити § 19 підручника, опрацювати конспект.
2) Виконати завання 4-7 с.75.
VII. Підбиття підсумків уроку
Я хочу подякувати вам за урок.
На згадку про наш урок я дарую вам ще один рецепт успіху:
„Успіх - це тільки 10% таланту і 90% щоденної наполегливої праці."


про публікацію авторської розробки
Додати розробку
