Урок "Місце металічних елементів у періодичній системі, особливості будови атомів, металічний зв’язок. Фізичні властивості металів."
Мета уроку:
- поглибити знання учнів про металічні елементи, їх розташування у періодичній системі, загальні фізичні властивості металів, особливості будови атомів і речовин;
- розширити уявлення про види хімічного зв'язку з допомогою поняття про металічний хімічний зв'язок; показати вплив зв'язку на фізичні властивості речовин, утворених металічними елементами;
- ознайомити учнів зі сполуками металічних елементів у природі;
- розвивати в учнів наукове світосприйняття,уміння аналізувати, порівнювати, узагальнювати й робити висновки на підставі здобутих знань;
- прищеплювати навички пошукової роботи;
- сприяти формуванню вмінь доводити свою думку, аргументувати її.
Тема: Місце металічних елементів у періодичній системі, особливості будови атомів, металічний зв’язок. Фізичні властивості металів.
Мета:
- поглибити знання учнів про металічні елементи, їх розташування у періодичній системі, загальні фізичні властивості металів, особливості будови атомів і речовин;
- розширити уявлення про види хімічного зв'язку з допомогою поняття про металічний хімічний зв'язок; показати вплив зв'язку на фізичні властивості речовин, утворених металічними елементами;
- ознайомити учнів зі сполуками металічних елементів у природі;
- розвивати в учнів наукове світосприйняття,уміння аналізувати, порівнювати, узагальнювати й робити висновки на підставі здобутих знань;
- прищеплювати навички пошукової роботи;
-
сприяти формуванню вмінь доводити свою думку, аргументувати її.
Тип уроку: засвоєння нових знань.
Форми роботи: індивідуальна, групова, фронтальна.
Методи: лекція, евристична бесіда, робота з текстом підручника, демонстраційний експеримент, брейн – ринг, розв’язок хімічного кросворду.
Обладнання: періодична система хімічних елементів Д.І. Менделєєва, ряд активності металів, моделі металевих кристалічних ґраток, таблиці «Метали»,
«Металічні кристалічні ґратки», колекція металів та їх сплавів, підручник «Хімія. 10 клас» О.Г.Ярошенко
Хід уроку
І. Організаційний момент.
Привітання, перевірка присутніх та готовності учнів до заняття. Створення позитивного емоційного настрою учнів.
Діагностика налаштування учнів на урок: виявлення психо – емоціонального стану групи. У кожного учня на столі лежить набір смайликів, які символізують настрій і емоційний стан (здивування, задоволення, невдоволення, радості). На початку і в кінці уроку визначаємо психо – емоційний стан учнів.




ІІ. Мотивація навчальної діяльності школярів
Епіграфом сьогоднішнього уроку є слова Дмитра Івановича Менделєєва про працю: «Шлях до розвитку і, врешті – решт, до щастя людини пролягає через її працю».
Не було б у світі великих гарних міст, струнких хмарочосів, якби не наполеглива праця винахідників, інженерів та робочих. Природа дарує людині воду, землю, каміння, залізну руду, але тільки праця здатна перетворити їх на речі складніші, цивілізовані. Без праці ми не могли би пересуватися за допомогою літаків, пароплавів, машин. Та що там – навіть колесо не придумали би, не доклавши зусиль. Праця все може – за її допомогою перемагають труднощі, знаходять рішення проблем, які здавалися тупиками, досягають добробуту. Праця насправді творить, удосконалює людину, а людина – про це казали мислителі всіх часів – за своєю природою жадає вдосконалення.
Тому, діти, нам потрібно гарно попрацювати, адже лише ту роботу, яка приносить людям користь, можна назвати працею. Тому я бажаю вам успіху сьогодні та позитивних емоцій на шляху до досягнення своєї мети. Ну що ж почнімо!
ІІІ. Актуалізація опорних знань
Уявіть, що ви працюєте на хлібозаводі. Сьогодні на вашому підприємстві має відбутися екскурсія для учнів першого курсу і перед вами стоїть завдання пояснити дітям, з чого саме виготовляють посуд, пічі, машини. (учні висловлюють свої думки)
• Як ви вважаєте, чому ми сьогодні почали розмову про метали?
Правильно. Ви вже багато знаєте про широке застосування металів. Проте, чи знаєте ви, що їх доцільне використання обумовлене будовою та властивостями металів. Наприклад,
• Чому дроти роблять із металів, а не з пластику?
• Чому молоток, цвяхи, пилку виготовляють із металу?
• Чому ручку сковорідки найчастіше покривають спеціальним покриттям?
Пояснення усім цим явищам ми дамо сьогодні на уроці.
ІV. Оголошення теми та мети уроку
Ми будемо вивчати загальну характеристику металічних елементів за їх розташуванням у періодичній системі та будовою атома, метали як прості речовини, металічний зв'язок, металічні кристалічні ґратки, а також загальні фізичні властивості металів, їх поширеність у природі.
Досягати позитивного результату ми будемо за таким планом:
1. Розташування хімічних елементів у періодичній системі
2. Будова атомів металічних елементів
3. Метали у природі
4. Метали як хімічні елементи та прості речовини:
a) особливості будови атомів металів;
в) металічний зв'язок і кристалічні ґратки.
4. Загальні фізичні властивості металів.
Деякі наші учні отримали випереджальне домашнє завдання. Тому, у нас у гостях сьогодні будуть історик, філолог та біолог, які розкажуть нам про роль металів у житті людини.
V. Сприйняття й усвідомлення учнями нового матеріалу
Філолог. Метали відіграють настільки велику роль у житті людей, що вони склали про них
Прислів'я: «Слово – срібло, а мовчання… (золото). (Залізо) … іржа з'їдає, а заздрий від заздрощів погибає.
Загадки: «Я з металами стою, хоча легкий немов олія. Я трапляюся всюди: у посудині, у склі, у кухонній солі» (Na),
вірші:
Метал
|
Метал – у ритмі тренувань Метал – куди вже важче Метал – не зна розчарувань Метал – ніяких «нащо» Я хочу бути як він – Холодним і мертвим. Хай дні проходять, але щоб без змін До цілі кроком йти упертим Летітиму снарядом, і не заважай, Я напролом, газую повним ходом, Не потребуючи твоєї згоди, Бо ціль – це ти, отак і знай.
|
1. Розташування хімічних елементів у періодичній системі
Подивіться на періодичну систему хімічних елементів й визначте елементи 41 і 54.
• Це металічні чи неметалічні елементи?
Для перевірки ваших відповідей попрацюємо з підручником.
Індивідуально-пошукова робота з підручником та періодичною системою хімічних елементів Д.І.Менделєєва
Прочитайте запитання параграфа на ст. 131, розгляньте мал. 58 і дайте відповіді в зошиті про місце металічних елементів у періодах, групах . Обґрунтуйте вашу відповідь щодо властивостей елементів 41 і 54.
(учні зачитують свої відповіді)
Висновок
У періодичній системі хімічних елементів металічні елементи розташовані на початку періодів (виняток – 1-й період), у всіх побічних підгрупах, переважно в лівій нижній частині періодичної системи. Металічним елементом є елемент 41, тому що він розташований у побічній підгрупі.
2. Будова атомів металічних елементів
Робота біля дошки (три учні)
- Запишіть електронні конфігурації атомів кількох металів. Знайдіть, що є спільного?
11Na 1S22S22P63S1;
12Mg 1S22S22P63S2;
13Al 1S22S22P63S23Р1.
Висновок:
- На зовнішньому енергетичному рівні знаходиться невелике число електронів (звичайно 1 – 3).
- Радіуси атомів металів великі, порівняно з радіусами атомів неметалів того ж періоду.
2) Метали мають невелику електронегативність, тому легко віддають валентні електрони, тим виявляють відновні властивості.
Na – 1e- → Na+ (11Na+ 1S22S22P63So)
Mg – 2e- → Mg2+ (12Mg+ 1S22S22P63So)
АІ – 3e- → АІ3+ (13АІ+ 1S22S22P63So)
Вправа 1. «Хрестики-нулики»
1. а) Виграшний шлях – хімічні елементи, в атомах яких чотири енергетичні рівні.
|
AI |
O |
Ca |
|
H |
He |
Be |
|
C |
Hg |
Ba |
б) Виграшний шлях - схеми атомів лужних металів.
|
1s22s2 |
1s22s22p63s23p1 |
1s2 |
|
1s22s22p63s1 |
1s22s22p1 |
1s22s1 |
|
1s22s22p63s23p3 |
1s22s22p3 |
1s22s22p4 |
Вправа 2. «Хрестики-нулики»
Виправте помилку:
|
1s22s22p1 |
ІІ період |
ІІІ група |
головна підгрупа |
|
1s22s22p4 |
ІІ період |
IV група |
головна підгрупа |
|
1s22s22p3 |
ІІ період |
V група |
головна підгрупа |
3. Метали у природі
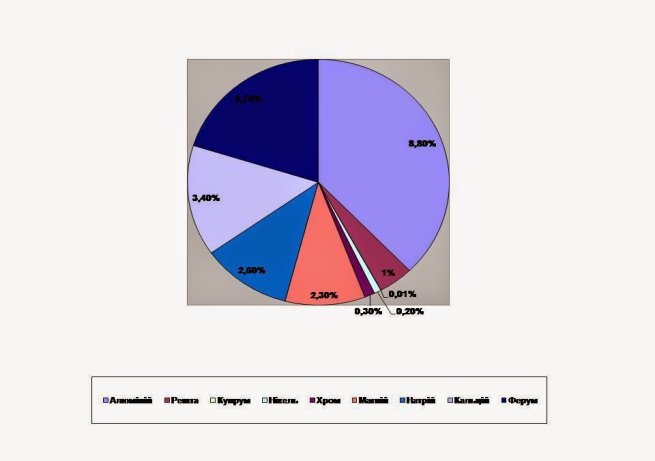
За поширеністю у природі металічні елементи поступаються неметалічним. Розглянемо діаграму «Поширеність металічних елементів у Земній корі».
• Які металічні елементи є найпоширенішими у природі?
• Які елементи трапляються дуже рідко?
• Чи трапляються у природі метали в «чистому» вигляді? Якщо «так», то назвіть їх.
Отже, найпоширеніший на Землі метал – це алюміній. Він важливий стратегічний метаріал, велику роль відіграє в авіації та літакобудуванні.
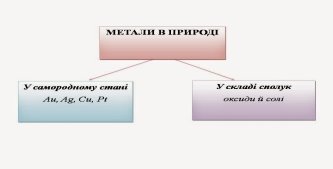
Історик. Відкриття металів є найвидатнішою за своїми історичними наслідками подією в історії людства. Від ударів шматок металу не розбивався, як шматок каменю, а плющився, податливо набуваючи необхідної форми. На зміну кам'яному століттю прийшли бронзове та залізне століття. У давні часи було відомо тільки сім металів. Ця кількість відповідала числу відомих тоді планет: Сонце (золото), Юпітер (олово), Місяць (срібло), Марс (залізо), Меркурій (ртуть), Сатурн (свинець), Венера (мідь). Алхіміки вважали, що під впливом променів планет у надрах Землі народжуються ці метали. Металічні елементи трапляються у природі переважно у складі сполук з іншими елементами.
Біолог. Деякі метали необхідні для нормальної життєдіяльності людського організму: Fe, Mg, Ca, Cu, Na, AI, Co, Mo, Zn. Вони містяться у мікроконцентраціях, їх називають мікроелементами. Кальцій – найпоширеніший в організмі метал, його нестача призводить до карієсу, ламкості кісток. Ферум бере участь у дихальних процесах. Організм дорослої людини містить 3-3,5 г Fe 3+, з них 75% входить до складу гемоглобіну. Найбільш багаті на йони Феруму печінка й селезінка. Нестача Феруму часто є причиною хлорозу у рослин і анемії в живих організмах (тварин і людини).
Проблемне запитання:
- Як ви вважаєте, чому метали як прості речовини у природі трапляються дуже рідко?
Щоб дати відповідь на це запитання, необхідно розглянути ряд активності металів.
К, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb (H2) Cu, Hg, Ag, Au
Зверніть увагу, що метали, які в ряді активності металів розташовані до водню, на Землі як прості речовини не трапляються.
Серед природних сполук вони переважно поширені у складі оксидів і солей (сульфіди, хлориди, карбонати, сульфати, ортофосфати). Висновок запишемо у вигляді схеми:
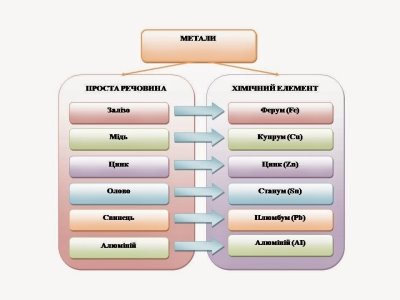
Раніше ви вже вивчали одного із представників класу металів.
• Згадайте назву цього металу (залізо) і назву хімічного елемента, що його утворює (Ферум).
Робота в групах
Розгляньте колекцію металів і складіть у зошиті схему, що пов'язує між собою два знайомі вам поняття «хімічний елемент» і «проста речовина
Дайте визначення поняття «хімічний елемент», «проста речовина» і з'ясуйте взаємозв'язок між ними.
|
Висновок |
Метали, як прості речовини, утворені атомами металічних елементів.
Бесіда з елементами проблемної ситуації
Ви знаєте, що за (н.у.) метали тверді і здатні проводити електричний струм.
• Як ви вважаєте, а яку кристалічну ґратку має твердий метал?
Усі метали мають подібні властивості, які можна пояснити подібністю будови їхніх кристалічних ґраток. У вузлах ґраток розташовані позитивно заряджені йони, а електрони зовнішніх рівнів усіх атомів металу вільно переміщуються по всьому зразку металу. Образно ці електрони «мандрівники» називають «електронним газом» , оскільки вони рівномірно заповнюють увесь простір між йонами. Ці електрони можуть вільно пересуватися по всьому зразку металу, тому вони добре проводять струм і тепло.
Висновок
У вузлах металічної кристалічної ґратки розташовані йони й атоми, а між ними рухаються електрони.
• Поясніть, які сили не дають можливості атомам металів розлетітися?
Отже, металічний зв’язок - це зв'язок між наявними в металах усуспільненими електронами, катіонами й атомами, у яких зберігся зв'язок валентних електронів із ядром. Саме металічний зв'язок визначає фізичні властивості металів.
Фізичні властивості металів
Специфічні фізичні властивості металів
1. Металічний блиск
Метали відбивають промені світла, а не пропускають їх, як скло, і не вбирають, як сажа. Срібло найкраще відбиває світло, тому має найбільший блиск (дзеркала, ялинкові іграшки). У більшості металів сріблястий блиск, але у золота і цезію – жовтий, у міді – червоний.
2. Висока електропровідність і теплопровідність
• Чому при доторканні рукою до металічного предмета відчуваємо холод, а до дерев’яного – ні?
(Тепло долоні швидко передається металу, він стає теплішим, а долоня холоднішає. Дерево погано проводить тепло, тому, торкаючись його рукою, ми не відчуваємо холоду).
Ця властивість металів зумовлена наявністю усуспільнених електронів, що можуть відносно вільно рухатися.
Ag, Cu, Au, Al, Mg, Zn, Fe, Pb……….
Електропровідність - і теплопровідність спадає
3. Ковкість, пластичність
Пластичність – здатність необоротно деформуватися під дією механічних навантажень. Пластичність обумовлена будовою металічної кристалічної ґратки .
Золото – найеластичніший з металів. 1г золота можна витягнути у дріт завдовжки 2 км. Із шматочка величиною із сірникову головку можна отримати лист площею 50 м2, лист в 0,0001мм у 500 раз тонше за волосину.
Найбільш крихкі з металів – хром, манган, стибій.
Неспецифічні фізичні властивості металів
Температура плавлення
Метали
легкоплавкі тугоплавкі
tпл < 1000° С tпл > 1000° С
лужні, лужноземельні метали, Cu, Fe, Cr, Ti, Mo….
Mg, Al, Pb, Sn, Zn…… tпл W ~3400°С
tпл Hg = - 38,87°С
Твердість
Метали
м’які тверді
лужні метали, хром, вольфрам
свинець.
Густина
Метали
Легкі Важкі
ρ < 5 г/см3 ρ> 5 г/см3
літій,натрій, магній, осмій, цинк, залізо, свинець,
алюміній ртуть, золото
ІV. Закріплення і узагальнення знань
Брейн – ринг
1. Скільки електронів мають метали на зовнішньому енергетичному рівні?
(1-3)
2. Яку кристалічну ґратку мають метали? (металічну)
3. Які частинки лежать у вузлах ґратки? (катіони металу)
4. Який метал має найбільшу електропровідність? (Ag)
5. Який метал має найбільший блиск? (Ag)
6. Який метал можна розплавити на руці? (t пл. Cs =28,5°C, t пл.Ga =29,7°C)
7. Які ви знаєте порівняння , де застосовуються назви металів?
Золоте серце
Золоті руки
Міцний як криця
Залізна воля
Залізний характер
Сивина як срібло
Швидкий, як ртуть
8. Які метали є в складі різних органів людини?
Са – в кістках, Сu – в печінці, Mn – в серці, Zn – в зубах, Fe – в крові,
As – в нирках, Au – в крові.
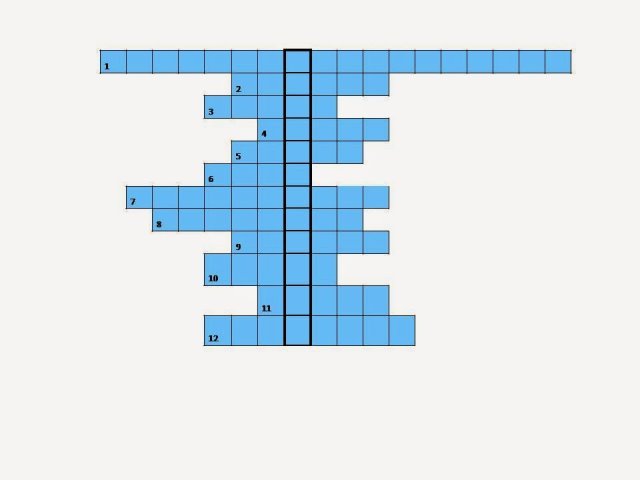
Хімічний кросворд (назвати ключове слово)
|
|
1.Одна із найважливіших фізичних властивостей металів (електропровідність).
2. Який метал має найбільшу пластичність? (Au)
3. Твердий розчин одного металу в іншому (сплав)
4. Найважчий з металів? (Os)
5. Найлегший з металів? (Lі)
6. Які частинки лежать у вузлах металічної ґратки? (катіони)
7. Особливий тип хімічного зв’язку, властивий металам та їхнім сплавам
(металічний)
8. Метал, що характеризується легкістю, високими електропровідністю та теплопровідністю, пластичністю, широко застосовується в побуті і промисловості (Al)
9. Метал, що за електропровідністю стоїть на першому місці, має сильний металічний блиск (Ag)
10. Фізична властивість металів, що зумовлена здатністю відбивити світлові промені (блиск)
11. Який метал найбільш легкоплавкий? (Hg)
12. Який метал найбільш тугоплавкий? (W)
V. Рефлексія за методом «Мікрофон»
Що нового ви дізналися про метали під час уроку?
V І. Підбиття підсумків уроку. Оцінювання роботи учнів, мотивація виставлення оцінок.
V ІІ. Домашнє завдання, інструктаж до його виконання
- Опрацювати §16,17;
- Виконати вправу №1 ст. 137 (всім); вправу №2 ст. 138 (для ІІІ – ІV рівня).


про публікацію авторської розробки
Додати розробку