Урок "Молекули. Атоми. Як вивчають речовини. Спостереження і експеримент."
Урок № 5
Тема: Молекули. Атоми. Як вивчають речовини. Спостереження і експеримент.
Мета:
- Навчальна: : поглибити та узагальнити знання про атоми й молекули, сформувати уявлення про будову атома, про речовини молекулярної та немолекулярної будови, про хімічний елемент як сукупність атомів з однаковим зарядом ядра, ознайомити учнів із сучасною номенклатурою.
- Розвивальна: розвивати логічне мислення та усне мовлення; продовжувати розвивати інтерес до вивчення предмета.
- Виховна: виховувати громадянську свідомість; відповідальне ставлення до малої батьківщини; повагу до людської гідності; доброзичливість і позитивне ставлення; відповідальність за власні вчинки і поведінку.
Тип уроку: комбінований.
Форми роботи: бесіда, самостійна робота, групова робота, розповідь, демонстрація.
- Очікувані результати: здобувач освіти знає і розвиває розуміння суспільного життя, прав і обов’язків; усвідомлює відчуття власної гідності; уміє висловлювати та аргументувати власну позицію; розрізняє поняття «атом», «молекула»; вміє розрізняти речовини за їх властивостями за допомогою спостереження та експерименту.
Обладнання: комп`ютер, мультимедійна дошка, мережа інтернет, періодична система.
Хід уроку
І. Організаційний момент.
Привітання класу. Перевірка готовності до уроку.
Психологічний настрій. Кольорові смужки:
-червона — сумний, агресивний настрій;
-зелена — веселий, доброзичливий настрій;
-жовта — невизначений настрій.
ІІ. Актуалізація опорних знань.
Ви ознайомилися з предметом вивчення хімії ще на уроках природознавства. То ж спробуємо пригадати:
1. Що називається речовиною?
2. Наведіть приклади речовин, що оточують вас.
3. В якому агрегатному стані можуть перебувати речовини за нормальних умов?
4. Назвіть кілька речовин, з якими ви зустрічаєтеся в побуті?
5. Як ви розумієте поняття: «речовина», «матеріал», «тіло»? Наведіть приклади?
6. Поясніть, чим відрізняються поняття «речовина» і «тіло». Наведіть приклади.
ІІІ. Мотивація навчальної діяльності.
Ви вже маєте початкове уявлення про речовину та її властивості. Тепер з’ясуємо, від чого вони залежать.
ІV . Вивчення нового матеріалу.
Розповідь
Уявлення про будову речовини сформульовано на трьох основних положеннях:
1. Всі речовини складаються із структурних частинок (структура = будова).
2. Всі частинки безперервно і хаотично рухаються.
3. Всі частинки взаємодіють між собою.
Обговорення СЛС (словесно-логічної схеми):
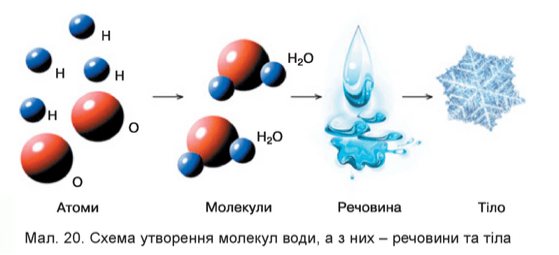
(Атоми Гідрогену –« сині кульки» взаємодіють з атомами Оксигену – «червоні кульки» → утворюються молекули, між якими виникають зв’язки → утворюється речовина вода, краплина якої взимку перетворюється на сніжинку (тіло).
Вправа « Мозковий штурм»
- Чому рука золотої статуї в стародавньому грецькому храмі, яку цілували прихожани, за десятки років стала худішою?
- Чому зношується підошва у взуття і стираються до дір лікті піджаків?
Розповідь
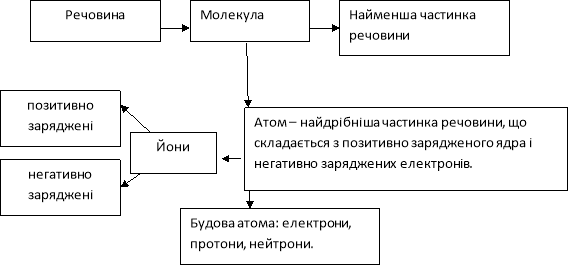
Отже, молекули – найменші частинки речовини, що визначають її властивості і здатні до самостійного існування. Молекула цукру – солодка, молекула оцтової кислоти – кисла, молекула капсаїцину, який міститься в плодах стручкового перцю, - пекуча, молекула хініну, який міститься в корі хінного дерева, - гірка.
! Властивості речовини обумовлені властивостями молекул.
Які факти підтверджують існування молекул?
- явище дифузії
- броунівський рух
- розчинення речовин
- поширення запаху
- зміна агрегатного стану
- стискання та розширення газів
- можливість механічного подрібнення речовин
- Між молекулами виникають сили притягання ( тверді тіла зберігають форму, рідина збирається в краплини, скотч прилипає до парти, чорнило залишає слід на папері), і сили відштовхування ( молекули повітря не збираються в одному місці, не «злипаються», губка після стискання відновлює свою форму).
Дослівно слово « молекула» з латинської перекладається «маленька маса».
Цікаві факти:
- Якщо розміри молекули збільшити до розмірів крапки, то товщина людської волосини дорівнювала би 40 м, а пропорційно збільшена людина, стоячи на Землі, головою впиралася би до Місяця.
- Якщо з дитячого гумового м’ячика, заповненого воднем масою 3 г, випускати по 1 млн. молекул, то знадобиться 30 млрд. років.
- В 1 см3 повітря міститься 27 тисяч трильйонів ( або 27 мільйонів мільярдів) молекул! Якщо запускати 1 мільйон молекул щосекунди в склянку об’ємом 1 см3, то для заповнення усієї склянки треба витратити аж 900 років.
- На Землі проживає 7405107650 людей. Такою ж кількістю молекул повітря можна заповнити кульку діаметром 0,007 мм.
Порівняйте розміри молекули (0,0000003 мм) з розмірами яблука (61 мм) і Землі (12742 км).
Такі мікрочастинки не можна побачити навіть під оптичним мікроскопом, який дає збільшення до 3000 разів, але в ХХ ст. винайдений електронний тунельний мікроскоп, що дозволяє побачити зображення молекул.
Бесіда.
Чи всі речовини складаються з молекул?
Кристали льоду та кухонної солі прозорі, але на долоні сніжинка розтане, а сіль – ні. Зовнішня схожість не означає подібність властивостей! Пригадайте, з якої речовини утворена сніжинка? Вода складається з молекул, між якими існують зв’язки. Якщо сніжинка так швидко тане, тобто знову стає рідиною, ці зв’язки міцні?
! Сили міжмолекулярної взаємодії у воді слабкі.
Відмінні властивості кристалів солі та льоду підтверджують різницю у будові цих речовин.
Ми вивчаємо мікросвіт, частинки якого побачити неможливо. Але, якщо провести уявні лінії між частинками кристалу, можна створити модель, схожу на гратку (демонстрація моделей кристалічних граток кухонної солі)
Розгляньте кристалічну гратку кухонної солі. В уявних вузлах гратки знаходяться заряджені частинки, які називаються йони. Вони утворюються з атомів або молекул. Як це відбувається, ви дізнаєтесь у 8 класі.
Протилежно заряджені йони притягуються. Виникають міцні зв’язки, тому сіль плавиться при tплавл. = 801ºС. А яка tплавл.льоду?.
Але кухонна сіль поступається алмазу, який є найтвердішим мінералом у природі і має t плавл. = 3500ºС. Проте необережний удар може розбити це диво природи на дрібні камінчики (кристалики). Модель одного з них ви бачите. Кристалічна гратка алмазу утворена атомами. Між атомами зв’язки ще міцніші.
У алмазу і кухонної солі не можна виділити окремі сполучення атомів, які називаються молекулою. Тому такі речовини належать до речовин немолекулярної будови.
Бесіда-повторення
- Чому вода в чайнику закипає й перетворюється на пару, а металевий посуд від нагрівання на плиті навіть не плавиться?
- Чому вода влітку рідка, а взимку перетворюється на лід?
- Чому повітря завжди – і влітку, і взимку – газувате?
Який же висновок можна зробити?
- Не всі властивості речовин обумовлені тільки властивостями молекул. Деякі властивості залежать від зв’язків молекул одна з одною.
- Не всі речовини складаються з молекул – деякі складаються з атомів або йонів.
- Але всі речовини складаються з атомів. Атом – це найдрібніша частинка речовини.
Розповідь
Атом – частинка, ще дрібніша за молекулу. Якщо збільшити його до розмірів крапки, то пропорційно збільшена людина матиме зріст приблизно 7 км. Якщо розташувати 10 млн. атомів в один ряд, то його довжина буде лише близько 1 мм. Якщо забрати простір з усіх атомів людського тіла, то все, що залишиться зможе пролізти крізь вушко голки.
Демокрит – давньогрецький філософ вважав, що існують найдрібніші частки, поділити які неможливо. Ці частки розділені небуттям – порожнечею. Він вперше ввів поняття «атом», що означало в перекладі з грецької atomos – «неподільний».
Російський вчений-хімік Михайло Ломоносов розвинув і вперше застосував в хімії атомно-молекулярне вчення (молекули він називав «корпускулами», а атоми –«елементами»).
Англійський хімік Джон Дальтон через 67 років після Ломоносова вперше використав термін «атом» у науці, як данину поваги до Демокрита.
Але виявляється, що атоми не є суцільними, такі маленькі частинки містять ще дрібніші – їх називають субатомні частинки.
Британський фізик Ернест Резерфорд у 1911 році встановив, що атом складається з щільного ядра, оточеного орбітами електронів, подібно до того, як Сонце оточене орбітами планет і запропонував «планетарну модель» атома.
Як же влаштований атом, що він собою уявляє?
«Хімік без знання фізики схожий на людину, яка все повинна шукати навпомацки». Цей вислів належить М.В. Ломоносову. А Ернест Резерфорд після отримання повідомлення про присудження йому Нобелівської премії з хімії у 1908 році висловився так: «Усі науки поділяються на фізику і колекціонування марок». Його називають «батьком ядерної фізики».
Саме фізики з’ясували, що атом має складну будову і складається з трьох типів частинок: протонів, нейтронів і електронів.
Перед вами малюнок, на якому зображена модель атома Гелію. В центральній частині атома знаходиться простір, який назвали ядром. В ядрі містяться 2 протони (червоні кульки) і 2 нейтрони (зелені кульки). Ядро оточено електронною оболонкою, в якій рухаються 2 електрони. Розміри ядра значно менші відстані, на яку віддалені електрони від ядра. А розмір атома визначається розмірами електронної оболонки: чим більше відстань між ядром і електронами, тим більший радіус атома. Маса електрону майже у 2000 разів менша за масу протону та нейтрону. Тому вся маса атома зосереджена в його ядрі.
Важлива характеристика субатомних частинок – їх заряд. Протони мають позитивний заряд, нейтрони заряду не мають, електрони мають негативний заряд. Зверніть увагу: число протонів дорівнює числу електронів ( в атомі Гелію їх по два ), тому атом не має заряду ( атом електронейтральний ) .
Як вивчають речовини?
За допомогою спостережень людина накопичує інформацію, яку потім систематизує, виявляє загальні закономірності. Речовини вивчаються за допомогою наукового спостереження, що проходить в умовах, які контролюють і можуть змінюватись за бажанням спостерігача. Найчастіше його проводять у спеціальному приміщенні – лабораторії, де проводяться і експерименти.
Експеримент – наукове відтворення явища з метою його дослідження. Він допомагає підтвердити чи спростувати гіпотезу, що виникла під час спостереження, та сформулювати висновок. Наприклад, спостереження за свічкою, яка горить.
Демонстрація досліду. З’ясувати, яка частина полум’я найгарячіша.
Внести у полум’я на 1-2 секунди сірники, побачимо, що обвуглилася та частина сірників, яка знаходилась зовні. Отже, зовнішня частина полум’я найгарячіша.
V. Узагальнення і систематизація знань.
Виконати завдання:
1. Які з наведених виразів не мають сенсу: атом Гідрогену, атом Сульфуру, атом цукру, атом нафти, атом Феруму, молекула хлору, молекула повітря, молекула кисню.
2. З даного переліку виписати речовини молекулярної будови: вода, кухонна сіль, цукор, кисень, залізо, мідь, водень, вуглекислий газ, алюміній, спирт.
А зараз, пропоную вам, завантажити Гру «Хімічна лабораторія», яка допоможе нам наочно розглянути утворення молекул з атомів, їх якісний та кількісний склад. Для цього нам потрібно зайти на сайт Google Play та в пошуковому рядку ввести назву гри «Хімічна лабораторія», або перейти за посиланням https://play.google.com/store/apps/details?id=com.monsterbraingames.chemistrylabsciencegame .
Щоб виконати домашнє завдання ми маємо дізнатись про ще одне визначення «скріншот».Зні́мок екра́на (англ. screenshot, скріншот, зняток) — зображення, отримане комп'ютером, що зображує дійсно те, що бачить користувач на екрані монітора. Це зображення створене із запису видимих елементів екрана комп'ютера або іншого візуального пристрою виведення інформації.
VІ. Підведення підсумків уроку.
Підводиться підсумок уроку, виставляються оцінки.
VІІ. Домашнє завдання.
- Опрацювати відповідний параграф підручника.
2*. Пройти три рівні гри «Хімічна лабораторія», зробити скріншот та переслати його вчителю в соціальній мережі Facebook або на блог «Проста хімія».

про публікацію авторської розробки
Додати розробку
