Урок на тему "Будова, властивості та використання оксидів"
Урок хімії у 8 класі на тему:
«Будова, властивості та використання оксидів»
Мета уроку: Створити умови для вивчення залежності фізичних та хімічних властивостей оксидів від їхньої будови , для засвоєння хімічних властивостей основних та кислотних оксидів , для розуміння реакціі обміну та сфер використання оксидів людиною; сприяти формуванню критичного мислення через проблемний та диференційований підхід, інтерактивні форми та методи роботи; розвитку навичок та умінь складання формул та рівнянь хімічних реакцій, розвитку комунікативної компетентності; сприяти вихованню толерантного ставлення до оточуючих та природи.
Тип уроку. Засвоєння нових знань.
Форми роботи: розповідь вчителя, створення проблемних ситуацій, демонстраційний експеримент, лабораторні досліди.
Обладнання: періодична система, таблиця розчинності, ряд активності металів, розчини реактивів, пробірки.
Структура уроку:
І. Організаційний етап……………………………………………...………….1 хв
ІІ. Актуалізація опорних знань………………………………………………..5 хв. ІІІ. Формулювання мети і завдань …………………………………….……..5 хв. ІV. Мотивація навчальної діяльності…………………………….…………..5 хв
V. Вивчення нового матеріалу……………………………………………….20хв.
1. Будова оксидів та фізичні властивості
2. Хімічні властивості
3. Використання оксидів
VІ. Усвідомлення і закріплення знань………………………………………..5 хв VII. Підсумки (рефлексія)………………………………………………………3 хв.
VIІІ. Домашнє завдання………………………………………………………….1хв.
Хід уроку
І. Організаційний етап
Учитель пояснює, що буде вивчатися в новій темі, називає тему уроку, просить сформулювати питання, які слід, на думку учнів, розглянути на уроці.
-Добрий день, діти! Я сьогодні до вас прийшла не сама, а з казковим персонажем, чи є у вас варіанти?
(діти вдарують героя)
-Даю підказку: середовищем життя даної особи є оксид (вода). Дихає зябрами.
(діти вгадують)
Дійсно, до нас завітала золота рибка, яка буде допомагати, але тільки тим дітям, які будуть уважні та працьовитими.
ІІ. Актуалізація опорних знань
- Так як наша героїня живе в середовищі оксиду, то давайте пригадаємо, що таке оксиди, які вони бувають. (складання асоціативного куща)
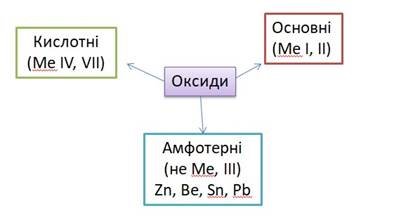
ІІІ. Формулювання мети і завдань
- На минулому уроці ми розглянули фізичні властивості оксидів. А які ще властивості характерні речовинам? (хімічні)
- А від чого залежать властивості речовин? ( від будови)
- Ваші відповіді підказують нам тему сьогоднішнього уроку (формулювання теми) – Будова, властивості та використання оксидів.
- Що б ви хотіли дізнатися про будову та хімічні властивості оксидів? - Я хочу на уроці дізнатися……………….. - Я хочу краще володіти ………… - Я хочу розібратися……………….
- Бажаю вам досягти тих цілей, які щойно визначили для себе. Думаю, у цьому нам допоможе наша золота рибка.
План:
1. Будова оксидів та фізичні властивості
2. Хімічні властивості
3. Використання оксидів
ІV. Мотивація навчальної діяльності
- Чи зустрічаєте ви оксиди в побуті та житті? (Вода, негашене вапно, вуглекислий газ)
- Чи взаємодіють вони з одним одним? (створення проблемної ситуації)
Щоб дати правильну відповідь на це питання – треба уважно вивчити новий матеріал.
V. Вивчення нового матеріалу
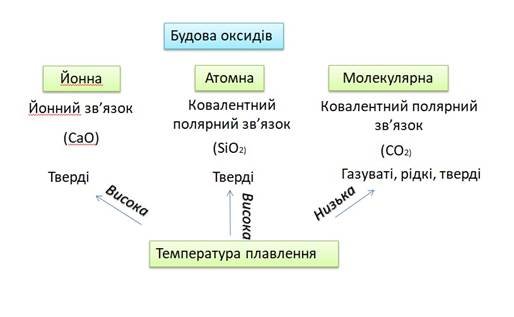
1. Будова оксидів та фізичні властивості
(Діти досліджують будову та фізичні властивості за малюнком та таблицею підручника.)
- Розглянувши інформацію підручника, нам треба створити опорну схему будови оксидів та їх фізичних властивостей. (бажаючі учні виходять до дошки для створення схеми)
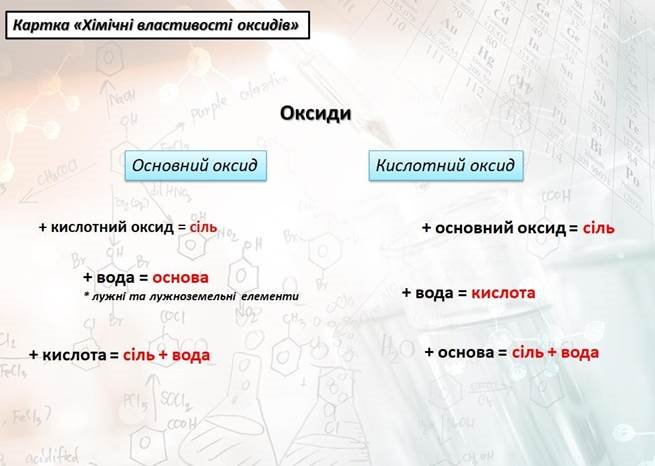
2. Хімічні властивості
(Діти отримують картки хімічних властивостей оксидів, яку опрацьовують, підбираючи відповідні рівняння реакції)
1. Властивості основних оксидів
- Перед вами стоїть завдання: підбілити дерева весною. Який з оксидів ви запропонуєте розчинити у воді? (разом з учителем складають рівняння реакції) СаО + Н2О = Са(ОН)2
негашене вапно гашене вапно
Висновок: основні оксиди під час реакції з водою утворюють основи
- А чи можуть основні оксиди реагувати з кислотними?
СаО+СО2 = СаСО3
Висновок: основні оксиди взаємодіють з кислотними, утворюючи солі
Наступна властивість – це реакції з кислотами (такі реакції називаються реакціями обміну – це реакції, під час яких сполуки обмінюються своїми першими частинками):
 СаО+ 2НNO3= Ca(NO3)2 +H2O
СаО+ 2НNO3= Ca(NO3)2 +H2O
Висновок: основні оксиди взаємодіють з кислотами, утворюючи солі та воду
2. Властивості кислотних оксидів
- Коли ви відкриваєте пляшку з мінеральною водою – виділяється дуже багато газу. Як ви вважаєте, звідки він утворюється?
Цікаво буде дізнатися, що газована вода з’явилася у 1833 році у США. Для цього вуглекарбонатна кислота з балону подавалась в охолоджену воду. Це робили для того, щоб продовжити термін зберігання води, щоб вона не псувалась швидко. Але ця кислота не стійка: вона рокзадається на вуглекислий газ і воду. Саме його ми спостерігаємо під час відкривання пляшки. Тому дана реакція можлива в двох напрямках. CO2+H2O = H2CO3.
Висновок: кислотні оксиди взаємодіють з водою, утворюючи кислоти. Винятком є SiO2 – складова піску.
- Кислотні з основними ( дивись основні оксиди)
- Кислотні оксиди також реагують з основами. Пропоную зробити цікавий дослід з вапняною водою. (Учень виходить до дошки та видихає повітря через трубку у вапняну воду. Через деякий час утвориться білий осад.) Давайте розберемося, звідки ж взявся осад!?
СО2+Са(ОН)2 = СаСО3 ↓ + Н2О.
Сіль, яка утворилась – і є осадом.
Висновок: кислотні оксиди взаємодіють з основами, утворюючи сіль та воду. Загальний висновок: то які ж зі згаданих на початку оксидів, взаємодіяли між собою? (діти називають оксиди та їх властивості)
3. Використання оксидів
- Окрім раніше згаданих сполук (вуглекислий газ, вода, пісок) є ще більш привабливі, дорогоцінні оксиди. Це рубіни, сапфіри, аметисти. А зараз про цю цікавинку розповість ваш товариш. (випереджаюче завдання)
VІ. Усвідомлення і закріплення знань
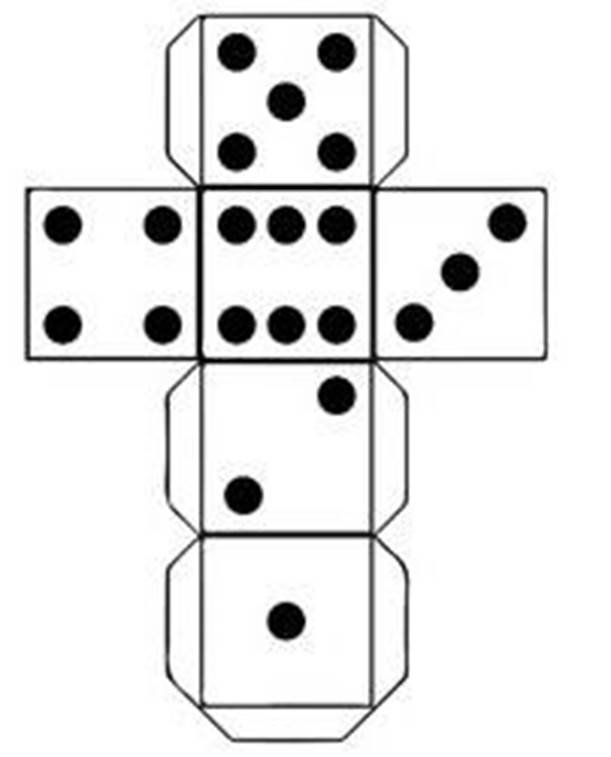
Гра з розумним кубиком. Діти по черзі підкидають кубик, випадає грань, яка вказує на номер реакції, яку треба дописати.
1. Cl2O7 + H2O =
2. MgO+H3PO4 =
3. P2O5 +K2O =
4. FeO + SO2 =
5. SiO2 + H2O =
6. N2O5 + Ba (OH)2 =
VII. Підсумки (рефлексія)
Золота рибка уважно прослухавши наш урок – підготувала вам конверти зі своїми запитаннями. Хто бажає відкрити перший ? (учні за бажанням відкривають по черзі конверти, зачитують та продовжують речення)
- Можу розповісти іншим про..
- Мені було важко зрозуміти …
- Мені зрозуміло що…
- Мій настрій змінився на …
VIІІ. Домашнє завдання
Основне завдання: опрацювати параграф 26, виконати вправу 192, 193.
Творче завдання: Підготувати повідомлення незвичайну основу – нашатирний спирт.
Додаток 1
Додаток 2
Випереджаюче завдання
Рубін це дорогоцінний камінь, який є різновидом корунду. Причому червоний корунд - це рубіни, а сині корунди - це вже сапфіри.
Вважається, що рубіни відомі людині ще з бронзового століття. В Індії ще до нашої ери їх називали царями дорогоцінних каменів і часто застосовували в талісмани. Цінували красу цього дорогоцінного каменю також римляни і греки. Рубін став частим супутником королівських осіб і знаті.
Слово «корунд», правда, кілька видозмінене, і прийшло до нас від людей, що населяли в давнину Південно-Східну Азію. Так вони називали непрозорі сіруваті камені винятковою твердості, які зустрічалися в тому регіоні. Прийшовши в Європу, в середні віки, цей камінь отримав сучасну назву від Rubeus що по латині означає «червоний». Часто вбудований у мечі, він був там камінь лицарів мужні і вірні своїм ідеалам, вважаються здатними захистити їх від будь-яких негараздів, оскільки вони є охоронцями божественний вогонь.
Рубіни можуть мати особливі характеристики завдяки наявності голчастих включень, які відбивають світло і створюють ефект шестипроменевої зірки. Рідкісний камінь, який виявляє цей оптичний ефект, називається зірковий рубін. Згідно з повір'ями, зірковий рубін має величезну магічну та цілющу силу. Навіть сьогодні він вважається найдорожчим рубіном, а також найбільш бажаним колекціонерами.
Дорогоцінний рубін можна зустріти на всіх континентах, окрім Антарктиди. А найбільш цінними вважаються рубіни, добуті в Азії. Головні постачальники червоних корундів - Таїланд, М'янма і Шрі-Ланка. З давніх часів також відомо родовище рубінів на території сучасного Таджикистану.
Рубіну приписують здатність виліковувати хвороб суглобів, травної системи, нирок, хребта, печінки. Також він має кровоспинні властивості. Він здатний запобігати лихоманку, позбавляє від кошмарів, депресії, покращує роботу нервової системи.
Використовують його також у лікуванні виразки шлунка, шкірних хвороб, серцевосудинних захворювань, для зняття високої температури. Існує думка, що рубіновий червоний промінь позитивно позначається на обміні речовин, імунітет, допомагає зняти запалення і регенерує тканини.
Є кілька способів перевірки достовірності цього каменю. Наприклад, якщо помістити його в ємність з коров'ячим молоком, колір молока стане рожевим. А тріщини в справжньому рубін зигзагоподібні і ніколи не сяють.
Додаток 3


про публікацію авторської розробки
Додати розробку
