Урок на тему "Етилен і ацетилен. Молекулярні та структурні формули, фізичні властивості."
Розробка уроку на тему "Етилен і ацетилен. Молекулярні та структурні формули, фізичні властивості" має на меті формувати знання учнів про гомологічні ряди алкенів і алкінів на прикладі етилену і ацетилену; ознайомити учнів з природою кратного зв'язку, ізомерією за місцем положення кратного зв'язку і між класовою ізомерією; удосконалювати навички і вміння складати структурні формули і давати їм назви. Ознайомити з фізичними властивостями алкенів і алкінів.
УРОК 4
Тема: Етилен і ацетилен. Молекулярні та структурні формули, фізичні властивості.
Мета: формувати знання учнів про гомологічні ряди алкенів і алкінів на прикладі етилену і ацетилену; ознайомити учнів з природою кратного зв’язку, ізомерією за місцем положення кратного зв’язку і між класовою ізомерією; удосконалювати навички і вміння складати структурні формули і давати їм назви. Ознайомити з фізичними властивостями алкенів і алкінів.
Тип уроку: урок вивчення нового матеріалу.
Обладнання: Таблиці «Будова алкенів і алкінів», «Типи гібридизації», шаростержневі моделі, мультимедійна презентація до уроку.
Очікувані результати: наприкінці уроку учні мають називати перших 10 представників гомологічних рядів алканів та алкенів їх та загальні формули; складати та пояснювати електронні та структурні формули етилену та ацетилену; збирати моделі їх молекул; знати види ізомерії; характеризувати фізичні властивості ненасичених вуглеводнів.
Хід уроку
І. Актуалізація опорних знань
- Графічний диктант. ( слайди 2 – 3 )
![]()
![]()
![]()
![]()
![]()
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]()
![]() 1 2 3 4 5 6 7 8 9 10
1 2 3 4 5 6 7 8 9 10
![]() Позначте значком « » вірну відповідь, значком « » невірну.
Позначте значком « » вірну відповідь, значком « » невірну.
1. Алкани відносяться до хімічно активних речовин.
2. Наявність в молекулах алканів лише одинарних (простих) зв’язків обумовлює особливості хімічних властивостей алканів.
3. Під дією метану фіолетовий розчин калій перманганату знебарвлюється.
4. Всі алкани горять, вивільняючи значну кількість теплоти, реакції горіння – це екзотермічні реакції.
5. Реакція С2Н6 + Cl2 → С2Н5Cl + НCl називається реакцією хлорування.
6. Метан та його гомологи розкладаються при сильному нагріванні без доступу кисню на водень і сажу.
7. Алкани можуть вступати в реакції приєднання галогенів.
8. Алкани застосовуються як паливо завдяки здатності вступати в реакції термічного розкладу.
9. Якщо через розчин брому, що має бурий колір, пропустити метан, то розчин знебарвиться.
10. Гомологи метану С5 ─ С11 є основою пального для автомобільних двигунів.
ІІ. Мотивація навчальної діяльності
Вуглеводні містять Гідроген і Карбон. Якщо речовина має склад СnH2n+2, то це алкан (СН4, С2Н6…)
 А чи можна віднести до алканів речовини С2Н4 і С2Н2 ? Чому?
А чи можна віднести до алканів речовини С2Н4 і С2Н2 ? Чому?
Ці речовини належать до інших гомологічних рядів – алкенів і алкінів.
Мета уроку: познайомитися з алкенами та алкінами. Навчитися складати їх формули, називати, описувати особливості будови. Розглянути типи ізомерії характерні для ненасичених вуглеводнів.
ІІІ. Вивчення нового матеріалу
- Гомологічні ряди алкенів і алкінів ( слайди 5 – 6 )
 Алкени (або етиленові вуглеводні) – вуглеводні із загальною формулою СnН2n, в молекулах яких між атомами Карбону є один подвійний зв’язок. Щоб дати назву алкенам, у назві відповідного алкану суфікс -ан замінюють на –ен.
Алкени (або етиленові вуглеводні) – вуглеводні із загальною формулою СnН2n, в молекулах яких між атомами Карбону є один подвійний зв’язок. Щоб дати назву алкенам, у назві відповідного алкану суфікс -ан замінюють на –ен.
 Алкіни (або ацетиленові вуглеводні) – вуглеводні із загальною формулою СnН2n-2, в молекулах яких між атомами Карбону є один потрійний зв’язок.
Алкіни (або ацетиленові вуглеводні) – вуглеводні із загальною формулою СnН2n-2, в молекулах яких між атомами Карбону є один потрійний зв’язок.
Щоб дати назву алкінам, у назві відповідного алкану суфікс -ан замінюють на –ин або –ін.
 Заповнити таблицю « Гомологічні ряди вуглеводнів» (слайд 7 )
Заповнити таблицю « Гомологічні ряди вуглеводнів» (слайд 7 )
(учні під керівництвом вчителя заповнюють таблицю та дають назву вуглеводням.
Чому немає алкенів і алкінів з одним атомом Карбону?
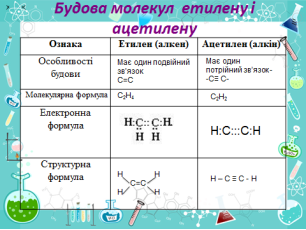
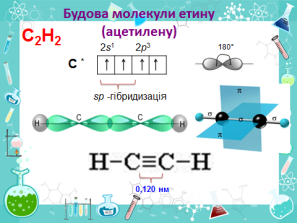
- Будова молекул етилену і ацетилену ( слайд 8 )
- Порівняння будови алканів, алкенів, алкінів
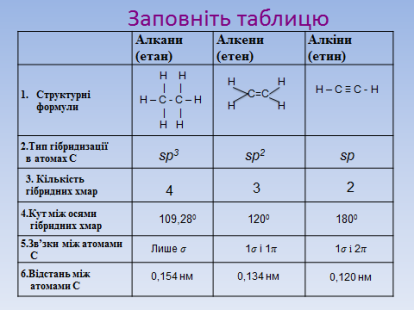
 Заповнити таблицю «Порівняння будови алканів, алкенів, алкінів» під час пояснення, використовуючи мультимедійну презентацію та власні спостереження під час виконання лабораторного досліду. (слайди 9 - 11)
Заповнити таблицю «Порівняння будови алканів, алкенів, алкінів» під час пояснення, використовуючи мультимедійну презентацію та власні спостереження під час виконання лабораторного досліду. (слайди 9 - 11)
Лабораторний дослід
«Складання молекул моделей вуглеводнів»
Мета: скласти моделі молекул етану, етену, ацетилену, порівняти будову і міцність зв’язку між атомами Карбону.
1. Складіть моделі молекул етану, етену, ацетилену.
2. Зробіть висновок про відмінність в будові й міцності зв’язків у цих молекулах.
-
 Види ізомерії ( слайди 14 – 17 )
Види ізомерії ( слайди 14 – 17 )
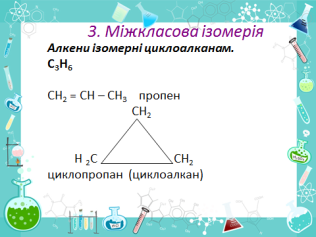


- Фізичні властивості етилену і ацетилену ( слайд 18 )
Робота з підручником ст. 124, 135
- Гази – прозорі. Безбарвні
- Майже без запаху (С2Н4 слабкий солодкуватий запах)
- Малорозчинні у воді
-
 Легші за повітря : М(С2Н4) = 28 г/моль
Легші за повітря : М(С2Н4) = 28 г/моль
М (С2Н2) = 26 г/моль
М(повітря) = 29 г/моль
ІV. Закріплення та узагальнення знань ( слайди 20, 21 )
 Бесіда
Бесіда
1. Чим подібні етилен і ацетилен за складом?
2. Чим відмінні етилен і ацетилен за складом?
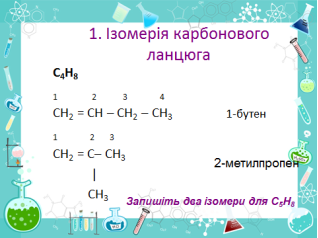
 3. Складіть молекулярні формули алкену і алкіну, що містять по п’ять атомів Карбону. Напишіть структурні формули можливих ізомерів.
3. Складіть молекулярні формули алкену і алкіну, що містять по п’ять атомів Карбону. Напишіть структурні формули можливих ізомерів.
5. Визначте молекулярну формулу алкену, якщо його відносна молекулярна маса дорівнює 56.
6. Обчисліть масові частки Карбону і Гідрогену в молекулі ацетилену.
Домашнє завдання: ( слайд 22 ) § 20 ст. 122 – 124 ( до хім. власт. ), з. 188 ст. 127; § 22 ст. 133 – 135 ( до хім. власт. ) з. 201 ст. 138 ( підручник «Хімія» П.П. Попель, Л.С.Крикля )
Використані джерела:
1. Березан О.В. Органічна хімія: Посібник для вчителів хімії та учнів загальноосвітніх шкіл, ліцеїв, гімназій, слухачів і викладачів підготовчих відділень вузів/ Березан О.В. – К.: Абрис, 2000.
2. Боєчко Ф.Ф. та ін. Органічна хімія: Проб. Підручник для 10 – 11 класів (шкіл) хімічних профілів та класів (шкіл) з поглибленим вивченням предмета/ Ф.Ф. Боєчко, В.М. Найдан, А.К. Грабовий. – К.: Вища школа, 2001.
3. Попель П.П. Хімія: підручник для 9 кл. загальноосвітніх навчальних закладів/ П.П. Попель, Л.С. Крикля. – К.: ВЦ «Академія», 2009.
4. Шаблон презентації [Електронний ресурс] – Режим доступу http://pedsovet.su/load/97


про публікацію авторської розробки
Додати розробку
