Урок "Хімічні властивості алкенів і алкінів"
Урок "Хімічні властивості алкенів і алкінів" має на меті ознайомлення учнів з хімічними властивостями алкенів і алкінів на прикладі етилену і ацетилену: реакціями окиснення і приєднання. Формувати навички й уміння складати рівняння хімічних реакцій.
УРОК 5
Тема: Хімічні властивості алкенів і алкінів
Мета: познайомити учнів з хімічними властивостями алкенів і алкінів на прикладі етилену і ацетилену: реакції окиснення і приєднання. Формувати навички й уміння складати рівняння хімічних реакцій.
Тип уроку: комбінований
Обладнання : комп’ютер, проектор, мультимедійна презентація уроку.
Очікувані результати: наприкінці уроку учні мають характеризувати хімічні властивості етилену, ацутилену та їх гомологів; ілюструвати властивості речовин рівняннями хімічних реакцій; визначати дослідним шляхом ненасичені вуглеводні; порівнювати властивості насичених і ненасичених вуглеводнів; встановлювати причинно-наслідкові зв’язки між складом, будовою та властивостями речовин; знати та дотримуватися правил безпечного поводження з органічними речовинами.
Хід уроку
І. Актуалізація опорних знань
Кросворд (слайд 2 )
По горизонталі:
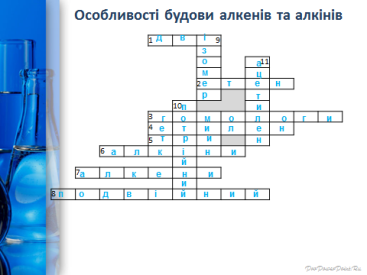 1. Кількість гібридних хмар в атомі С в молекулі ацетилену.
1. Кількість гібридних хмар в атомі С в молекулі ацетилену.
2. Міжнародна назва алкену, що містить два атома С.
3. Як можна назвати одним словом наступні речовини: етен, пропен, бутен, пентен.
4. Перший представник гомологічного ряду алкенів.
5. Кількість гібридних хмар в атомі С в молекулі етилену
6. Ненасичені вуглеводні, в молекулах яких між атомами С є 1 потрійний зв’язок.
7. Ненасичені вуглеводні, в молекулах яких між атомами С є 1 подвійний зв’язок.
8. Який зв’язок обов’язково є в алкенах.
По вертикалі:
9. Як можна назвати речовину СН2 = СН – СН2 – СН3 по відношенню до речовини до речовини СН2 = С– СН3
|
СН3
10. Який зв’язок обов’язково є в молекулах алкінів
11. Перший представник гомологічного ряду алкінів.
ІІ. Мотивація навчальної діяльності (слайд 3 )
Властивості речовин визначаються будовою речовини. Пригадайте алкани. Який зв’язок між атомами С в молекулах алканів? (простий) Як це позначилося на хімічній активності? ( не дуже активні речовини ).
Який зв’язок між атомами С у алкенів і алкінів? (подвійний і потрійний).
 Мета уроку: з’ясувати як поява кратних зв’язків в будові речовини відображається на її хімічних властивостях? В які реакції вступають етилен та ацетилен, а також їх гомологи. Що при цьому утворюється? Навчитися писати найпростіші рівняння реакцій.
Мета уроку: з’ясувати як поява кратних зв’язків в будові речовини відображається на її хімічних властивостях? В які реакції вступають етилен та ацетилен, а також їх гомологи. Що при цьому утворюється? Навчитися писати найпростіші рівняння реакцій.
ІІІ. Вивчення нового матеріалу.
Хімічні властивості алкенів та алкінів. ( слайди 4 – 10 )
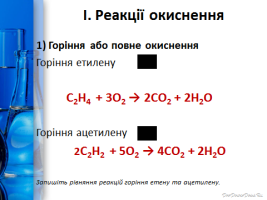 І. Реакції окиснення
І. Реакції окиснення
1) Горіння або повне окиснення
С2Н4 + 3О2 → 2СО2 + 2Н2О +Q світне полум’я
2С2Н2 + 5О2 → 4СО2 + 2Н2О +Q кіптяве полум’я
 Проблемне питання:Чому етан горить майже безбарвним полум’ям, алкени – світнім, а алкіни – кіптявим?
Проблемне питання:Чому етан горить майже безбарвним полум’ям, алкени – світнім, а алкіни – кіптявим?
Пригадайте масові частки Карбону у етані, етені та етині, які ви розраховували на попередніх уроках. ( В етані – 80%, в етені – 86%, в етині – 92% )
Пригадайте, як горять рідкі алкани в складі молекул яких білше 10 атомів Карбону? ( кіптявим полум’ям )
Чим більша масова частка Карбону, тим більш кіптявим буде полум’я.
 2) Часткове окиснення
2) Часткове окиснення
КMnO4
С2Н4 + Н2О + О → CH2 – CH2
| |
OH OH
Якісна реакція на кратний зв’язок. Фіолетовий колір калій перманганату знебарвлюється.
ІІ. Реакції приєднання
-
 Приєднання водню ( гідрування, гідрогенізація)
Приєднання водню ( гідрування, гідрогенізація)
К
СН2 = СН2 + Н2 → СН3 – СН3
етен етан
К
СН ≡ СН + Н2 → СН2 = СН2
ацетилен етен
К
СН ≡ СН + 2 Н2 → СН3 – СН3
ацетилен етан
-
 Приєднання галогенів (галогенування)
Приєднання галогенів (галогенування)
СН2 = СН2 + Br2 → СН2Br – СН2Br
СН ≡ СН + Br2 → СН2 Br = СН2 Br
СН ≡ СН + 2Br2→ СНBr2 – СНBr2
Якісна реакція на кратний зв’язок. Бурий колір брому знебарвлюється.
-
 Приєднання галогеноводнів (гідрогалогенування,
Приєднання галогеноводнів (гідрогалогенування,
гідрогенгалогенування)
СН2 = СН2 + НBr → СН3 – СН2Br
СН ≡ СН + НBr → СН2 = СНBr
-
 Приєднання води (гідратація)
Приєднання води (гідратація)
СН2 = СН2 + Н2О → СН3 – СН2ОН
Добування етилену і ацетилену. ( слайди 11 – 12 )
- Дегідрування алканів (відщеплення водню)
 к
к
С2Н6 → С2Н4 + Н2
к
С2Н6 → С2Н2 + 2Н2
- Етилен добувають нагріванням етилового спирту з Н2SO4 конц - дегідратація
Н2SO4, t
С2Н5ОН → С2Н4 + Н2O

- Ацетилен добувають з кальцій карбіду
СаС2 + 2Н2О → С2Н2 + Са(ОН)2
- Ацетилен добувають термічним розкладом метану.
1500°С
2СН4 → С2Н2 + 3Н2
 Закріплення набутих знань
Закріплення набутих знань
( слайди 13 – 15 )
(Фронтальна бесіда, виконання вправ і задач )
1.Порівняйте хімічну активність насичених вуглеводнів (алканів) і ненасичених вуглеводнів (алкенів і алкінів).
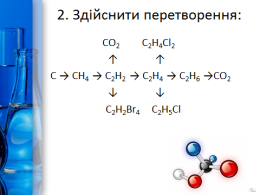 2. Здійснити перетворення:
2. Здійснити перетворення:
CО2 С2Н4Cl2
↑ ↑
С → СН4 → С2Н2 → С2Н4 → С2Н6 →СО2
↓ ↓
С2Н2Br4 С2Н5Cl

4. Вкажіть, яку масу хлору може приєднати етен кількістю речовини 0,1 моль.
5.Визначте невідомий вуглеводень у реакції
2СхНу + 11О2 → 8СО2 + 6Н2О
Домашнє завдання: § 20 ст. 124-127 § 22 ст. 135-138 ( підручник «Хімія» П.П. Попель, Л.С. Крикля ) з. 187 ст. 127, з. 199 ст. 138 ( слайд 16 )
Використані джерела:
- Березан О.В. Органічна хімія: Посібник для вчителів хімії та учнів загальноосвітніх шкіл, ліцеїв, гімназій, слухачів і викладачів підготовчих відділень вузів/ Березан О.В. – К.: Абрис, 2000.
- Боєчко Ф.Ф. та ін. Органічна хімія: Проб. Підручник для 10 – 11 класів (шкіл) хімічних профідів та класів (шкіл) з поглибленим вивченням предмета/ Ф.Ф. Боєчко, В.М. Найдан, А.К. Грабовий. – К.: Вища школа, 2001.
- Попель П.П. Хімія: підручник для 9 кл. загальноосвітніх навчальних закладів/ П.П. Попель, Л.С. Крикля. – К.: ВЦ «Академія», 2009.
- Видеоуроки по органической химии [Електронний ресурс] – Режим доступу http://www.himikatus.ru/org_video.php
- Шаблон презентації [Електронний ресурс] – Режим доступу http://pedsovet.su/load/97

про публікацію авторської розробки
Додати розробку
