Урок на тему :" ФЕНОЛ, властивості, застосуваня"
ТЕМА : ФЕНОЛ
Мета: Закріпити знання учнів про вуглеводні та спирти, добитися засвоєння учнями знань про склад, властивості, застосування та добування фенолу, сформувати знання про взаємний вплив атомів у молекулі. Дати уявлення про вплив фенолу на організм людини.
Розвивати вміння прогнозувати властивості речовини, виходячи із їх будови, удосконалювати уміння писати рівняння реакції, формувати самоосвітню компетентність учнів, розвивати логічне мислення.
Виховувати екологічну свідомість, колективізм.
Обладнання та матеріали: мультимедійний проектор, штатив з пробірками, тримач для пробірок, спиртівка, фенол кристалічний, розчин фенолу, металевий натрій, розчин натрій гідроксиду, розчин ферум(ІІІ) хлориду.
Методи навчання: проблемно-пошукові методи, наочні, словесні, демонстраційний експеримент.
Форми роботи: вибірковий хімічний диктант, інтерактивні вправи «Злови помилку», «Впізнай мене», «Аукціон ідей», «Метод Прес», робота в групах гетерогенного складу, рольова гра «Прес-конференція».
Тип уроку: урок засвоєння нових знань
Хід уроку.
І. Організація класу.
ІІ Актуалізація опорних знань.
Вправа «Безодня формул»
Розподілити формули за класами органічних сполук: алкани, алкени, алкіни, арени, алканоли. Назвати речовини.
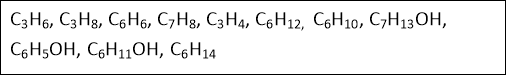
Вправа «Злови помилку».
(Деякі рівняння реакцій написані неправильно. Учень повинен знайти помилки і виправити їх)
![]() 2СН4 Tемпер. 1500 С2Н4 + 2Н2
2СН4 Tемпер. 1500 С2Н4 + 2Н2
![]() СН2=СН-СН3 + НСl → CH2 – CH2 – CH3
СН2=СН-СН3 + НСl → CH2 – CH2 – CH3
Cl
![]() CH2 Ξ CH2 + HOH → CH2 = CH
CH2 Ξ CH2 + HOH → CH2 = CH
OH
CH3 – CH2 –OH + NaOH → CH3 – CH2 –ONa + H2O
C6H6 + HO – NO2 Конц.Н2SO4 C6H5 – NO2 + H2O
Задача.
При згоранні 9,4 г органічної речовини утворилося 26,4 г карбон(ІV) оксиду та 5,4 г води. Відносна густина пари речовини за воднем 47. Знайти формулу речовини.
Експрес-опитування.
- Що таке органічні речовини?
- Хто ввів у науку поняття «органічні речовини»?
- Яким було вчення Берцеліуса?
- Хто розбив віталістичне вчення?
- Хто є автором теорії хімічної будови органічних сполук?
- Атоми в молекулах розміщені не безладно, а ….
- Атом Карбону в органічній хімії завжди …
- Які типи формул є в органічній хімії?
- Ізомерія – це …
- Ізомери – це …
- Які гомологічні ряди вуглеводнів ми вивчили?
- Як ще називаються насичені вуглеводні?
- Загальна формула алканів …
- Формула та назва п’ятого представника алканів …
- Формула октану …
- Яка будова молекули метану?
- Тип гібридизації атома Карбону у молекулі метану …
- Загальна формула алкенів …
- Просторова будова молекули етену…
- Загальна формула алкінів…
- Просторова будова молекули етину …
- Як утворити алкільний радикал від вуглеводню?
- Що таке радикал?
- Які оксигеновмісні сполуки вивчили? Яка функціональна група характерна для спиртів?
- Що таке функціональна група?
- Як класифікуються спирти?
Вибірковий диктант.
Записати рядок із цифр, вибравши номери тверджень, що належать представникам певного класу речовин.
Варіант 1 – алкани; вар.2 – алкени чи алкіни, вар 3 – арени, вар.4 –алканоли.
- Вони малоактивні і для них найбільш характерні реакції заміщення.
- В назвах представників – суфікс –ен.
- Для них характерні реакції приєднання.
- Вони мають один потрійний зв’язок.
- Мають циклічну будову.
- Мають функціональну групу -ОН.
- Для них характерний крекінг.
- З галогенами вступають в реакції заміщення і приєднання, продукт реакцій залежить від умов перебігу реакції.
- Вони мають один подвійний зв’язок.
- Серед їх представників немає газів.
- Для них характерний водневий зв’язок.
- Знебарвлюють бромну воду.
- Для них характерна реакція Кучерова.
- Реакції приєднання гідрогенгалогенідів відбуваються у них за правилом Марковнікова.
- Вони використовуються для виробництва пестицидів.
- Для них властива цис -, транс- ізомерія.
- Для них характерна орто-, мета-, пара-ізомерія.
- Усі атоми Карбону у них перебувають в стані sp3-гібридизація.
- Вступають у реакції внутрішньомолекулярної та міжмолекулярної дегідратації.
- Його синтезують тримеризацією ацетилену.
- Отруйна речовина, що спричиняє сліпоту і смерть.
- Одержують реакцією спиртового бродіння глюкози.
Відповідь: Алкани:1, 7, 18
Алкени: 2, 3, 9, 12, 14, 16
Алкіни: 3, 4, 12, 13, 14
Арени: 5, 8, 17, 20
Алканоли: 6, 10, 11, 19, 21, 22.
Задача.
При згорання 9,4 г органічної речовини утворилося 26,4 г карбон(ІV) оксиду та 5,4 г води. Відносна густина пари речовини за воднем 47. Знайти формулу речовини. (відп.: С6Н6О)
ІІІ. Мотивація навчальної діяльності.
Упродовж попередніх уроків ми досліджували цілий ряд класів органічних речовин, тому ваші знання з органічної хімії вже чималі. Спробуємо сьогодні максимально використати набуті знання при вивченні іще однієї, дуже важливої і потрібної речовини.
До того, як лікарі дізналися про існування мікробів, будь-яка рана чи операція могла виявитися смертельною, бо хворим загрожувала смерть від бактеріальної інфекції. У середині 19 ст. Луї Пастер довів, що хвороби викликають мікроскопічні організми, які можна знищити. У 1865 р. шотландський хірург Джозеф Лістер знайшов речовину, яка вбиває мікроби. Це була речовина, про яку сьогодні ми поведемо мову. Ця речовина завдяки своїм протимікробним, дезінфікуючим властивостям врятувала життя мільйонам людей. То чи заслуговує ця речовина того, щоб ми її досконало вивчили?
А назву цієї речовини та її молекулярну формулу сьогодні ви визначили самі. Зверніть увагу на формулу, яку ви отримали , розв’язавши задачу, і порівняйте її з формулою, яку не змогли віднести до жодного відомого вам класу неорганічних сполук у завданні «Безодня формул» (С6Н6О та С6Н5ОН).
- Чи однаковий якісний та кількісний склад її?
- Як ви думаєте, чи одній речовині належить ця формула?
- Назву її ви дізнаєтеся, склавши слово із літер, які вказують на правильні відповіді у вправі «Впізнай мене»: ФЕНОЛ.
Отже, тема нашого уроку: «Фенол, його склад, будова, властивості».
Давайте разом попробуємо визначити мету та наші завдання.
Вправа «Що? Які? Як? Де?». «Які вміння розвинути?»
Учні за ключовими запитаннями формують мету та завдання уроку:
- Дізнатися, що собою являє фенол?
- Які фізичні та хімічні властивості фенолу ?
- Як його можна добути в лабораторії?
- Де застосовується фенол?
- Як впливає фенол на організм людини?
Зверніть увагу на девіз уроку, слова російського ученого Б.М.Кедрова: «Будь-яка речовина від найпростішої до найскладнішої має три відмінні, але взаємозв’язані сторони: склад, будова, властивості»
Отже, сьогодні на уроці ми повинні розв’язати проблему: як впливають склад та будова фенолу на його властивості?
ІV. Засвоєння нових знань.
- Що таке феноли?
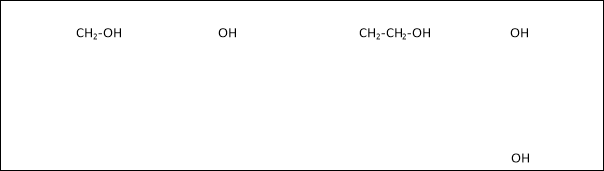
Зверніть увагу на формули (проектуються на екран)








![]()
![]()
![]()
![]()
![]()
- Чим відрізняються ці формули?
( У другій та четвертій формулах гідроксильні групи зв’язані безпосередньо з бензеновим ядром, а в інших двох формулах – через групи атомів)
- Сполуки, у яких гідроксильні групи зв’язані безпосередньо з бензеновим ядром, відносяться до класу фенолів. Основний представник – фенол С6Н5ОН (гідроксибензен)
- Фізичні властивості фенолу.
Демонстраційний дослід 1.
- Вчитель показує кристалічний фенол, пропонує учням описати його. Розчиняє фенол у холодній воді, потім добавляє гарячу воду. Поміщає пробірку з фенолом у гарячу воду. Складають опорну схему фізичних властивостей фенолу.
С6Н5ОН Ас – кристалічний,
К –білий, на повітрі окислюється і набуває
рожевого кольору.
З – характерний
РН2О – у холодній воді – погано, у гарячій – добре
Tпл. – 420 С
Отруйний.
- Хімічні властивості.
Знову звертаємося до нашої проблеми. Спрогнозуймо хімічні властивості фенолу, виходячи з його будови.
- Які групи атомів входять до складу молекули? (радикал феніл С6Н5- та гідроксильна група ОН-)
- Виходячи з будови, які, на вашу думку, властивості повинен проявляти фенол? (Властивості спиртів та ароматичних вуглеводнів)
- Які властивості спиртів ви знаєте? (взаємодія з металічним натрієм)
- Переконаємося на досліді, чи взаємодіє фенол з металічним натрієм.
Демонстрація 2.
В розплав фенолу додати кусочок металічного натрію. Спостерігається виділення газу.
Висновок: отже, фенол, як і алканоли, взаємодіють з металічним натрієм.
(Учні починають складати опорну схему хімічних властивостей фенолу)
2С6Н5ОH + 2Na = 2С6Н5ОNa + H2↑
- Перевіримо відношення фенолу до лугів.
Демонстрація 3.
До розчину фенолу додати 2-3 краплини 10%-го розчину натрій гідроксиду, в який заздалегідь додали краплину фенолфталеїну.
- Чому змінилося забарвлення розчину?
- Фенолфталеїн знебарвлюється тоді, коли проходить реакція нейтралізації, тобто взаємодія лугу з кислотами.
Висновок: фенол проявляє кислотні властивості (тоді як одноатомні спирти не взаємодіють з розчинами лугів). Дійсно, фенол називають ще карболовою кислотою (карболкою)
С6Н5ОH + NaOH = С6Н5ОNa + H2O
Проблема: чому фенол, на відміну від алканолів, проявляє кислотні властивості? Чому гідроксогрупа по різному поводить себе у спиртах та фенолі?
Вправа «Аукціон ідей»
В групах гомогенного складу учні, користуючись підручником, повинні знайти розв’язання проблеми і висунути свої ідеї. Також написати рівняння реакцій за участю гідроксильної групи фенолу (взаємодія з Na та NaOH)
Розв’язання проблеми:
Це пов’язано із взаємним впливом атомів у молекулі. Гідроксогрупа по іншому поводить себе у фенолі, ніж у спиртах, бо зазнає впливу радикалу фенілу. Єдина π-електронна система ароматичного ядра притягує до себе неподілені електронні пари атома Оксигену, внаслідок чого ковалентний зв’язок О-Н стає більш полярним і атом Гідрогену набуває більшої рухливості. Фенол – дуже слабка кислота, слабша за карбонатну.
Дякую групам за роботу. Перевіримо це на досліді, переконаємося, що карбонатна кислота витісняє фенол з феноляту натрію.
Демонстрація 4.
Через утворений в попередньому досліді натрій фенолят пропустити вуглекислий газ спостерігається помутніння розчину. Бо утворюється вільний фенол. Отже, фенол – слабша кислота, ніж карбонатна.
С6Н5ОNa + CO2+ H2O = С6Н5ОH + NaHCO3
Демонстр. 5
Додати до розчину фенолу невелику кількість розчину калій перманганату. Відбувається знебарвлення розчину.
- Чи знебарвлював бензен розчин калій перманганату?
- Ні.
- Чи вступав бензен у реакцію з бромною водою чи нітратною кислотою при звичайних умовах?
- Ні, з галогенами він вступав у реакції заміщення при наявності каталізаторів, з нітратною кислотою – у жорстких умовах при наявності концентрованої сульфатної кислоти.
- Вірно, а фенол легко знебарвлює бромну воду і легко взаємодіє із конц. нітратною кислотою, причому заміщення відбувається у орто-, мета-, пара-положеннях.
Проблема: чому фенол, маючи у своєму складі радикал ароматичних вуглеводнів, має властивості, відмінні від них?
(Учні самостійно шукають відповідь, працюючи в групах)
Висновок: Гідроксильна група впливає на бензенове ядро так, що атоми гідрогену бензенового ядра стають більш рухливими в положенні 2,4,6 (орто-, мета-, пара-) і легко заміщуються на атоми галогенів чи інші радикали.
![]()
![]() ОН OH
ОН OH

![]()
![]()
 Br Br
Br Br


![]() + 3Br2 → + 3HBr
+ 3Br2 → + 3HBr
Br
2,4,6-трибромфенол


![]()
![]() OH OH
OH OH
 O2N NO2
O2N NO2
![]()
![]()

![]() + 3HO-NO3 → + 3 H2O
+ 3HO-NO3 → + 3 H2O
NO2
2,4,6-тринітрофенол
(пікринова кислота)
Взаємодія з бромною водою, при якій утворюється осад білого кольору, є якісною реакцією на фенол. Друга якісна реакція – взаємодія з розчином ферум(ІІІ) хлориду.
Демонстрація 6.
Приготувати розчин фенолу у воді, добавляючи її доти, доки емульсія не перетвориться на розчин. Потім до розчину додати декілька крапель розчину ферум(ІІІ) хлориду. Спостерігається утворення рідини темно-фіолетового кольору.
Звернемося до початкової проблеми: чи залежать властивості речовини від її будови?
Висновок: Отже, властивості фенолу визначаються складом молекули, наявністю гідроксильної групи та бензенового ядра, а також взаємним впливом їх один на одну.
- Добування фенолу.
В групах опрацювати матеріал про добування фенолу за поданою схемою. Зобразити рівняння реакцій добування фенолу із бензену.
Фенол добувають із кам’яновугільної смоли. Другий спосіб добування фенолу – із бензену за схемою:






![]()
![]()
![]()
![]() Сl ОН
Сl ОН
- Застосування фенолу. Дія його на організм людини.
Запрошуємо вас на прес-конференцію, присвячену застосуванню фенолу. В ній беруть участь: директор фірми «Полімер», хімік інженер-технолог, історик, лікар, еколог. Ну, і як завжди, на прес-конференції присутні всюдисущі журналісти та зацікавлені представники фірм-виробників.
Репортер: Шановні присутні! Сьогоднішня прес-конференція присвячена фенолу як одній з важливих речовин хімічної промисловості. Де ж застосовуються феноли, яке вони значення мають? Слово директору фірми «Полімер»
Директор фірми «Полімер»: Наша фірма виробляє пластмаси на основі фенол- формальдегідної смоли. Фенолформальдегідна смола одержується в результаті реакції поліконденсації фенолу та формальдегіду. Додаючи до смоли наповнювачі, отримують різні види пластмас, які застосовуються у ракето- та машинобудуванні, будівництві, для виготовлення меблів, тощо.
Представник фірми «Полтаваобленерго»: Який матеріал ви можете порекомендувати як електроізоляційний?
Директор фірми «Полімер»: Гетинакс. Це папір, просочений фенолформальдегід-ною смолою та спресований. Багато фірм використовують гетинакс у радіо- та електротехніці.
Представник фірми «Дженерал моторс»: Що б ви запропонували для виготовлення шарикопідшипників, призначених для великих навантажень?
Директор фірми «Полімер»: Текстоліт - бавовняну тканину, просочену фенол- формальдегідною смолою та спресовану при високій температурі. Він стійкий до великих навантажень . А для гальмових накладок машин , мотоциклів, стрічок ескалаторів можна порекомендувати волокніт, який досить міцний.
Представник фірми «Інфотел»: Нас цікавлять матеріали для телефонних апаратів.
Директор фірми «Полімер»: Ми рекомендуємо карболіт – деревне борошно, просочене фенолформальдегідною смолою. З нього виготовляють і телефонні апарати, і контактні плати.
Інженер-технолог-хімік: А я хочу додати, що фенол широко використовують для синтезу капролактаму – сировини для виготовлення синтетичного волокна нейлон, при виробництві пестицидів для сільського господарства, барвників та лакофарбних матеріалів, мийних засобів.
Журнал «Охорона здоров’я»: відомо, що раніше фенол називали карболкою і використовували як дезінфікуючий засіб у медицині. Чи практикується це зараз?
Технолог фірми «Лубнихімфарм»: Так, зараз фенол входить до складу багатьох дезинфікуючих засобів. Також використовується при виготовленні таких препаратів як аспірин, фенолфталеїн, входить до складу крапель для вух та носа, пастилок для горла та інших ліків.
Журналіст газети «ЗОЖ»: але ж фенол є отруйною речовиною. Чи так це? Як впливає він на організм людини?
Лікар: Так, фенол є отруйною речовиною. Причому він потрапляє в організм людини не тільки при вдиханні фенольних парів, через кишково-шлунковий тракт, а може проникати навіть через шкіру. Він викликає опіки на шкірі, негативно діє на нервову систему, при значних кількостях викликає параліч головного мозку і центрів дихання, що приводить до смерті.
Журнал «Охорона здоров’я»: В мене запитання до історика. Що ви можете сказати про так звані «фенольні будинки»?
Історик: Так, у 80-х роках минулого століття у Москві було побудовано експериментальні панельні будинки. В бетон, що використовувався при будівництві, додавали фенолформальдегідну смолу для прискорення тверднення. А міжплиточні щілини заповнили скловатою, просоченою фенолформальдегід-ною смолою. Але вже через незначний час по стінах будинків поповзли тріщини, герметичність швів порушилась і фенольні пари поповзли в середину квартир. Люди, які заселили будинки, отримали проблеми зі здоров’ям: алергії, хвороби очей, нирок, тощо. Причина цього – помилки проектантів та технологів, недосконалість монтажу збірних конструкцій.
Журналіст газети «ЗОЖ»: Дякую за інформацію. В мене запитання до еколога. А які ж допустимі концентрації фенолу є нешкідливими для організму людини?
Еколог: Допустимі концентрації фенолу в повітрі 0,03 мг/м3. Часто фенольні пари появляються в повітрі при користуванні предметами побуту, коли недобросовісні виробники меблів, будівельних матеріалів і навіть дитячих іграшок порушують технологію виробництва і випускають продукцію з недопустимо високим вмістом токсичних речовин, в тому числі й фенолів. Тому якщо ви відчули неприємний запах від недавно придбаних речей, якщо ваше здоров’я після ремонту чи покупки меблів погіршилось, краще провести дослідження на вміст фенолу та інших токсичних речовин.
V. Підведення підсумків.
Таким чином, ми з вами дізналися сьогодні багато про ще одну органічну сполуку – фенол. Вияснили, що він застосовується у багатьох галузях господарства. А також є отруйною речовиною. І зараз я попрошу вас висловити свою думку щодо проблеми: «Фенол – благо чи зло, користь чи шкода ». А допоможе вам у цьому вправа «Метод Прес»
- Я думаю, що …
- Тому що …
- Наприклад, …
- Таким чином, …
VІ. Рефлексія.
- Пригадайте, які завдання ви ставили перед собою на початку уроку. Чи реалізували ми ці завдання?
- Що виявилося складним на уроці?
- Над чим треба попрацювати на наступному уроці?
- Чи знадобляться вам отримані знання в повсякденному житті?
VІІ. Домашнє завдання.
§ 19. Завд. №4 (ст..107).
Творче завдання: Запропонуйте свій метод очищення стічних вод від домішок фенолу.
Завдання вищого рівня: як, маючи алюміній карбід та тільки неорганічні речовини, добути пікринову кислоту? Написати рівняння відповідних реакцій.
Вправа «Впізнай мене»
|
№ п/п |
Напівструктурна формула речовини |
|||||||||
|
1. |
|
а |
ф |
р |
д |
ю |
є |
в |
з |
ч |
|
2. |
СН3 СН3
|
п |
и |
м |
е |
к |
я |
у |
г |
ц |
|
3. |
СН2 СН3
|
м |
ь |
л |
у |
х |
й |
н |
з |
в |
|
4. |
СН3 СН3 СН3 СН3
|
ч |
я |
є |
ш |
в |
о |
а |
щ |
г |
|
5. |
Сl СН3 OH СН3
|
м |
б |
в |
а |
о |
д |
г |
л |
е |


про публікацію авторської розробки
Додати розробку
