Урок на тему «Фізичні властивості основ. Хімічні властивості лугів: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями.»
ПЛАН-КОНСПЕКТ
уроку з хімії,
8 клас
на тему:
«Фізичні властивості основ. Хімічні властивості лугів: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями.»
Тема уроку: Фізичні властивості основ. Хімічні властивості лугів: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями.
Навчальна мета. Ознайомити учнів з фізичними властивостями основ;закріпити знання про класифікацію основ; сформувати вміння складати формули основ, давати їм назви та вміння виявляти луги за допомогою індикаторів; вивчити хімічні властивості лугів, розглянути правила техніки безпеки під час роботи з лугами, розвивати навички складання рівнянь хімічних реакцій.
Розвивальна мета. Активізувати пізнавальну діяльність учнів на всіх етапах уроку, розвивати їх логічне мислення та творчі здібності, продовжити формувати і розвивати прийоми розумової діяльності (аналізу, порівняння, абстрагування, конкретизації).
Виховна мета. Виховувати витримку, уміння співпрацювати та об’єктивно оцінювати свою роботу та роботу інших учнів; сприяти формуванню наукового світогляду, ідей матеріальної єдності світу, виховувати толерантне ставлення учнів у процесі групової роботи.
Тип уроку:комбінований.
Форми роботи: фронтально-колективна робота, індивідуальна робота, групова робота.
Методи навчання:словесний (бесіда, розповідь учителя), наочний (демонстрація таблиць, дослідів), практичний.
Обладнання та реактиви: періодична система хімічних елементів, таблиця розчинності, роздатковий матеріал; штатив з пробірками; індикатори: (лакмус, метилоранж, фенолфталеїн); натрій гідроксид, купрум сульфат, сульфатна кислота, кальцій гідроксид.
Список літератури:
Савчин М. М. Хімія 8 клас : підручн. для загальноосвіт. навч. закл. / М. М. Савчин. – К. ; Харків : Грамота, 2016. – 224с. :іл.
Структура уроку:
І. Організаційна частина (2 хв).
ІІ. Перевірка домашнього завдання (5 хв).
ІІІ. Актуалізація опорних знань (7 хв).
ІV. Вивчення нового матеріалу (15 хв).
V. Закріплення й узагальнення знань (13 хв).
VІ. Підбиття підсумків уроку (2 хв).
VІІ. Повідомлення домашнього завдання ( 1 хв).
Хід уроку
І. Організаційна частина
Учитель. Доброго дня, учні. Сьогодні ми поговоримо з вами про фізичні і хімічні властивості лугів.
ІІ. Перевірка домашнього завдання
Учитель. Щоб перевірити чи були ви уважні і спостережливі на минулих уроках, я перевірю вас на детекторі брехні.
«Детектор брехні»
На столах є кольорові смужки. Відповідати на питання не потрібно, а лише піднімати смужки. «Так» - зелену і «Ні» - червону. Успіхів!
- Сполука, що складається з катіонів металічного елемента і гідроксильної групи називається основою. (Так)
- Карбон (ІІ) оксид або чадний газ – корисний для людини. (Ні)
- Усі кислоти взаємодіють як з основними, так із кислотними оксидами. (Ні)
- В людському шлунку є кислота. (Так)
- Всі гідроксиди розчинні у воді. (Ні)
- Внаслідок взаємодії металу з кислотою завжди утворюється лише сіль і виділяється водень. (Так)
- Кислоти змінюють забарвлення фенолфталеїну на малиновий колір. (Ні)
- Сполуки, що утворюються при горінні простих речовин називають оксидами. (Так)
- Оксиду SO3відповідає сульфатна кислота. (Так)
- Формула Фосфор (V) оксиду – P2O3 . (Ні)
ІІІ. Актуалізація опорних знань
Учитель. А зараз проведемо опитування по темі «Основи». Чи є бажаючі ? (Учитель викликає двох учнів до дошки. )
Опитування учнів
1 учень
- Які класи неорганічних сполук ви знаєте? (Оксиди, кислоти, основи, солі)
- Як класифікують основи за розчинністю у воді? (Розчинні (луги) і нерозчинні(основи))
- Назвіть основи за сучасною українською номенклатурою: KOH, Cu(OH)2, Ca(OH)2, Cr(OH)2, Fe(OH)3, Mg(OH)2. ( калій гідроксид, купрум(II) гідроксид, кальцій гідроксид, хром (ІІ) гідроксид, ферум (ІІІ) гідроксид, магній гідроксид)
2 учень
- Які речовини називають основами? ( Основи – складні речовини, до складу яких входить атом металу і одна або кілька гідроксильних груп)
- Від чого залежить кількість гідроксильних груп в основі? (Від валентності металу у складі гідроксиду)
- Складіть формули гідроксидів за їх назвами: натрій гідроксид, барій гідроксид, ферум (ІІІ) гідроксид, літій гідроксид, цинк гідроксид, алюміній гідроксид.(NaOH, Ba(OH)2, Fe(OH)3, LiOH, Zn(OH)2, Al(OH)3)
ІV. Вивчення нового матеріалу.
Учитель. Зараз ми поговоримо про фізичні властивості основ та на їх основі пригадаємо як потрібно поводитися з лугами.
Розповідь вчителя
Фізичні властивості основ
За стандартних умов усі луги — тверді речовини білого кольору, добре розчинні у воді. NaOH і КОН — милкі на дотик, дуже їдкі. Вони роз'їдають шкіру, тканини, папір та інші матеріали. За цю властивість їх називають їдкими лугами. Так, натрій гідроксид NaOH — їдкий натр, а калій гідроксид КОН — їдке калі.
Нерозчинні основи також тверді речовини, але вони по-різному забарвлені. Так, купрум(ІІ) гідроксид Сu(ОН)2 має блакитний із зеленкуватим відтінком колір, ферум(ІІІ) гідроксид Fe(OH)3 — бурий, a Fe(OH)2 — блідо-зеленкуватий, майже білий.
У зв'язку з тим, що кристалічні їдкі луги, що потрапили на шкіру, спричиняють опіки, їх не можна брати руками, а тільки пінцетом. Якщо ж розчин лугу все ж таки потрапив на шкіру, необхідно відразу ж змити його великою кількістю води, аж доки щезне відчуття милкості, а потім нейтралізувати розчином оцту або борної кислоти Н3ВО3.При попаданні в очі лугу необхідно промити очі струменем види (великою кількістю) і висушити рушником, після чого звернутися за медичною допомогою. Також забороняється пробувати розчини на смак.
Учитель. Ну що ж. Тепер, коли ви пригадали техніку безпеки і знаєте як себе поводити з лугами, ми можемо перейти до їх хімічних властивостей.
Хімічні властивості лугів
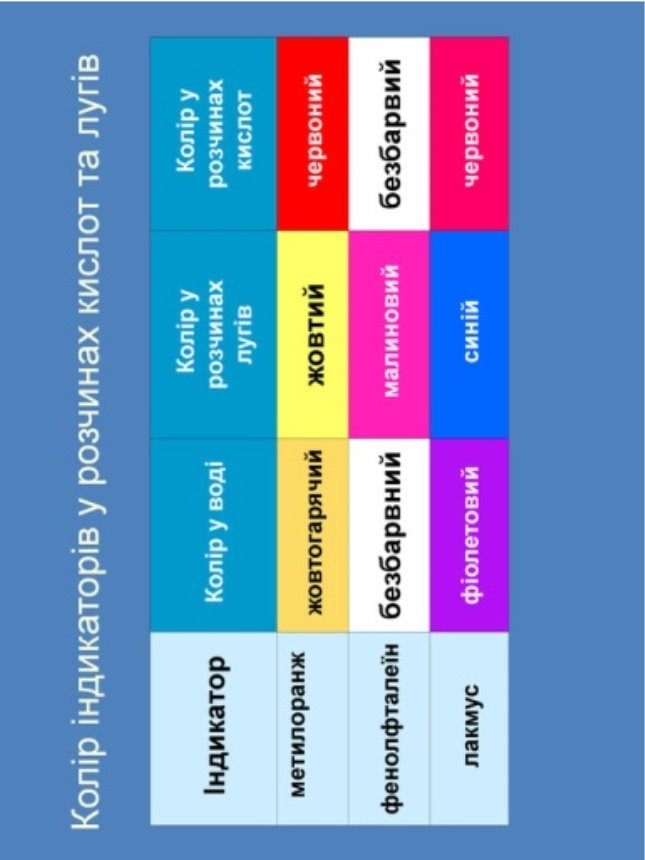
Учитель. І перша властивість, з якою ми познайомимось, - це зміна забарвлення індикаторів. Давайте пригадаємо що таке індикатори і які індикатори ви знаєте? (Індикатор – це речовини, що змінюють забарвлення в певному середовищі. Середовище може бути нейтральним, кислим або лужним. Приклади індикаторів: лакмус, фенолфталеїн, метилоранж.)
Лабораторний дослід 1. Дія розчинів лугів на індикатори.
Проведення досліду.
У 3 пробірки наливаємо по черзі розчин натрій гідроксиду.
У першу пробірку додаємо кілька крапель розчину лакмусу універсального. Спостерігаємо зміну забарвлення.
NaOH + лакмус = синє забарвлення.
У другу пробірку додаємо кілька крапель розчину метилоранжу.
NaOH + метилоранж = жовте забарвленя.
У третю пробірку додаємо кілька крапель розчину фенолфталеїну.
NaOH + фенолфталеїн = малинове забарвлення.
Висновок: розчинні у воді основи (луги) змінюють забарвлення індикаторів (табличка зміни забарвлення індикаторів у розчинах кислот і лугів в додатках)
Учитель. Другою властивістю лугів є взаємодія з кислотами з утворенням солі та води.
Лабораторний дослід 2. Взаємодія лугів зкислототами.
Проведення досліду.
У пробірку наливаємо 1 мл натрій гідроксиду та додаємо 2-3 краплі фенолфталеїну. Що спостерігаємо? (Розчин змінив забарвлення на малинове, що свідчить про лужне середовище.) Краплями доливаємо розчин сульфатної кислоти до зникнення забарвлення. Спробуємо написати рівняння цієї реакції.
2NaOH + H2SO4 = Na2SO4 + 2H2O
Висновок: основи реагують з кислотами. Реакція між кислотою і основою, у результаті якої утворюється сіль і вода, називають реакцією нейтралізації. У розчині лугу фенолфталеїн має малинове забарвлення. Коли забарвлення зникає від однієї краплі кислоти, то відбувається реакція нейтралізації. Вода не змінює забарвлення індикатора.
Учитель. Наступна властивість лугів – взаємодія з кислотними оксидами з утворенням солі та води
Лабораторний дослід 3.Взаємодія розчинів лугів з кислотними оксидами.
Проведення досліду.
У пробірку наливаємо 1 мл вапняної води (прозорий розчин кальцій гідроксиду Са(ОН)2). Через одноразову скляну трубочку (або поліетиленову для коктейлю) обережно видихаємо повітря у вапняну воду.
Са(ОН)2 + С02 = СаС03↓ + Н20
Висновок: луги взаємодіють з кислотними оксидами з утворенням солі та води. Розчин каламутніє, оскільки утворюється нерозчинна сіль СаС03 — кальцій карбонат.
Учитель. І остання властивість лугів – це взаємодія з солями. Реакція відбувається у тому випадку, якщо один з продуктів реакції випадає в осад.
Лабораторний дослід 4. Взаємодія лугів з розчинами солей.
Проведення досліду.
У пробірку наливаємо 1 млкупрум сульфату CuSO4. Потім краплями додаємо до нього натрій гідроксид NaOH. Які ознаки реакції спостерігаємо? (Утворення нерозчинного осаду синього кольору).Запишемо рівняння реакції на дошці
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Висновок: луги взаємодіють з розчинами солей, якщо при цьому утворюються нерозчинні основи.
Учитель.Ми з вами розглянули всі хімічні властивості лугів. Давайте тепер зробимо кілька вправ на закріплення матеріалу.
V. Закріплення й узагальнення знань
- Миючі засоби для очищення труб та дезінфекції містять в своєму складі речовини на основі лугів. При неправильному використанні такі засоби можуть спричинити опіки. Якими речовинами потрібно надати першу медичну допомогу при опіках лугами? (Необхідно відразу ж змити його великою кількістю води, аж доки щезне відчуття милкості, а потім нейтралізувати розчином борної кислоти Н3ВО3.)
- Яким оксидам відповідає гідроксид загальної формули Ме(ОН)2?
Na2O, MgO, CaO , K2O, Li2O ( MgO, CaO)
- Укажіть гідроксиди, яким відповідає оксид загальної формули Me2O3?
KOH, Cr(OH)3, Fe(OH)3, Cu(OH)2, NaOH (Cr(OH)3, Fe(OH)3)
- Укажіть луги серед гідроксидів:
Al(OH)3, Fe(OH)3, KOH, NaOH, Ca(OH)2, Ba(OH)2 (KOH, NaOH, Ba(OH)2)
- Завдання на картках .Закінчити рівняння реакцій ( індивідуальна робота)
1 варіант:
- Be(OH)2+2HCl=(BeCl2 + 2H2O)
- CuSO4+ 2NaOH= ( Na2SO4 + Cu(OH)2↓)
- Ba(OH)2+H2SO3= (BaSO3 + 2H2O)
- 2KOH+CO2= ( K2CO3 + H2O)
- Mn(OH)2+2HI= (MnI2 + 2H2O)
- 2NaOH+SO2= (Na2SO3 + H2O)
2 варіант:
- Mg(OH)2+2HCl = (MgCl2 + 2H2O)
- CuSO4+2KOH= (Cu(OH)2↓ + K2SO4)
- NaOH+HBr= (NaBr + H2O)
- H3PO4+3NaOH= (Na3PO4 + 3H2O)
- Ca(OH)2+2HNO3= (Ca(NO3)2 + 2H2O)
- Ba(OH)2+2HCl= (BaCl2 + 2H2O)
- Розв’язати задачу ( робота на дошці)
Барій гідроксид масою 34,2г повністю нейтралізували розчином сульфатної кислоти. Обчисліть масу і кількість речовини продуктів реакції.
Дано:
![]() m(Ba(OH)2)= 34,2 г34,2г xг у г
m(Ba(OH)2)= 34,2 г34,2г xг у г
![]() Ba(OH)2 + H2SO4→BaSO4↓ + 2H2O
Ba(OH)2 + H2SO4→BaSO4↓ + 2H2O
m(BaSO4) - ?1 моль 1 моль 2 моль
m(H2O) - ?M=171 г/моль М=233г/моль М= 18г/моль
n(BaSO4) -?m=171г m=233г m=36г
n(H2O) - ?
![]() =
= ![]() ;x =
;x = ![]() = 46,6 (г)
= 46,6 (г)
![]() =
= ![]() ;y =
;y = ![]() = 7,2 (г)
= 7,2 (г)
n(BaSO4) = ![]() =
= ![]() = 0,2 (моль)
= 0,2 (моль)
n( H2O) = ![]() =
= ![]() = 0,2 (моль)
= 0,2 (моль)
Відповідь: m(BaSO4) = 46,6 г , m(H2O) = 7,2 г, n(BaSO4) = 0,2 моль, n(H2O) = 0,2 моль.
VІ. Підбиття підсумків уроку
Висновки:
- Властивості речовин залежать від їх будови.
- Луги – основи, які розчиняються у воді.
- Луги змінюють колір індикаторів (фенолфталеїн стає малиновим, метилоранж – жовтим, а лакмус - синім).
- Луги реагують з кислотними оксидами та кислотами з утворенням солі та води.
- Реакція між кислотою та основою називається нейтралізацією.
- Луги реагують з солями за умови утворення нерозчинного продукту реакції.
( Учитель оцінює учнів і виставляє оцінки в журнал. Оцінюються учні, які активно працювали на уроці)
VІІ. Повідомлення домашнього завдання
Опрацювати матеріал параграфа 32, відповісти на запитання до нього, виконати завдання 2, 4 ст. 180.
Підготувати повідомлення «Побутова хімія: небезпека чи допомога господині?»
Додаток


про публікацію авторської розробки
Додати розробку
