Урок на тему: « Хімічний зв’язок. Будова речовини».
1
Урок на тему:
« Хімічний зв’язок. Будова речовини»
Як правило виділяють чотири рівня:
1 рівень - рівень узнавання. Завдання типу: виділіть, узнайте, розпізнайте на основі отриманих знань.
2 рівень - завдання на застосування знань в стандартній, типовій ситуації . Можуть бути присутні елементи самостійної роботи.
3 рівень - включаються завдання, в яких потрібно виконання завдань на порівняння, доведення і застосування знань, умінь і навичок в нестандартних ситуаціях. На даному рівні обов'язковими є проблемні завдання.
4 рівень - завдання високої теоретичної і практичної складності.
За змістом завдання можуть бути алгоритмічними, програмованими, дослідницькими, аналітичними та ін.
За формою: колективними, груповими, індивідуальними.
Якість знань учнів визначається їх самостійною роботою.
Відбір предметного змісту із урахуванням психологічних закономірностей формування понятий підвищує ефективність навчального процесу за рахунок забезпечення комфортного режиму розумової праці. Комфортність забезпечують дві ключові умови: вибір і успіх. Учні мають можливість вибору форми представлення матеріалу, способу навчальної діяльності, рівня складності і форми контролю. На кожному етапі формування понять запропонують не менше трьох варіантів завдань, що різняться не тільки рівнів складності, але і способом кодування інформації. Успіх кожного учня гарантуються емоційною підтримкою і дозованою допомогою учителя – від направляючої підказки і допоміжних задач до корекції навчальних завдань і прямих указань.
Задачі уроку:
Закріпити знання учнів по темі «Хімічний зв’язок. Будова речовин», здійснити перевірку знань і умінь по даній темі, намітити шляхи ліквідації «білих плям» в знаннях учнів.
Розвиток компетенції :
Мотиваційний компонент: потреба в пізнанні, прагнення до самовираження і індивідуальності.
Знаньєвий компонент: типи хімічних зв’язків, схеми утворення зв’язків.
Діятельнисний компонент: пояснити природу і способи утворення хімічних зв’язків; знаходити причино - наслідкові зв’язки між складом речовини і типом хімічного зв’язку; правильно використовувати хімічну символіку; розвивати загально навчальні уміння, креативність, уміння виступати перед аудиторією, формувати пізнавальний інтерес, використовуючи нестандартну форму уроку і включаючи у його зміст елементи новизни знань.
Виховувати комунікативну культуру, толерантне відношення до оточуючих людей, цілеспрямованість і ініціативність.
Учні повинні знати і вміти:
- знати визначення понять електронегативність, ковалентний, йонний, металічний зв’язки;
- визначати тип хімічного зв’язку за формулою ,
- записувати схеми утворення зв’язків,
- за описом фізичних властивостей речовини визначати тип кристалічної гратки та навпаки,
- знати, які частинки розміщуються у вузлах молекулярної, йонної, атомної, металічної кристалічних граток, які зв’язки утримують ці частинки в кристалі
Х О Д У Р О К А :
|
Час |
Діяльність учнів |
Методи,засоби навчання |
Розвиток компетенції |
|
20 хв |
Розвиток понять: електронегативність; хімічний зв’язок; ковалентний, йонний, металічний зв’язки;полярний, неполярний зв’язок.
|
Взаємоперевірка знань по теорії питання (система «учень - учень» ; парна робота)
|
Знанієвий компонент: типи хімічного зв’язку, електронегативність. Інформаційна компетенція. Комунікативна компетенція: уста, мовна Соціальна компетенція: роль відповідаючого, роль перевіряючого. |
Постановка 1 задачі та її рішення.
- Розкажіть про хімічний зв’язок, наведіть приклади.
- Дайте відповідь на питання команд - супротивників.
- І тур « Розминка»
І команда
- найкоротша відстань між ядрами атомів, які утворюють ковалентний зв’язок
- зв’язок за рахунок електростатичного притягання між йонами
- атом, що при утворенні зв’язку надає у спільне користування вільну орбіталь
- перекривання, що здійснюється по лінії, що з’єднує ядра атомів
- зв’язок, що виникає в металах та їх сплавах між атомами - йонами Ме та вільними усуспільненими електронами
2 команда
- зв’язування атомів за допомогою спільних (поділених між ними) електронних пар.
- асиметричний розподіл електронної хмари між ядрами атомів по осі зв’язку
- визначається числом неспарених електронів в нормальному і збудженому стані
- зв’язок, що утворений за допомогою трьох спільних електронних пар
- зв’язок, що характеризується ненасиченістю і ненапряленістю
3 команда
- атом, що надає у спільне користування неподільну електронну пару
- кількість енергії, яка необхідна для розриву зв’язку, або яка виділяється при його утворенні
- зв’язок, при якому відбувається асиметричний розподіл електронної густини спільної електронної пари
- це здатність атома елемента утворювати з іншими атомами певне, обмежене число ковалентних зв’язків
- найбільш електронегативний атом в Періодичній системі
4 команда
- число спільних електронних пар між атомами , що зв’язуються
- перекривання, що здійснюється над і під лінією, що з’єднує ядра атомів
- заряджені частинки, на які перетворились атоми в результаті віддачі та прийняття електронів
- здатність атома відтягувати до себе електронну густину спільної пари
- система із двох зарядів, однакових за величиною і протилежних за знаком
|
15 хв |
Розпізнавання на основі отриманих знань: відповіді на тестові запитання |
Програма-визначення.
|
Знанієвий компонент: типи хімічного зв’язку, схеми утворення зв’язків. Толерантність. Інформаційна компетенція. Комунікативна компетенція: уста, мовна Мотиваційний компонент: потреба у пізнання, прагнення до самовираження і індивідуальності. |
|
|
«УГАДАЙ РЕЧОВИНУ» Конкурс капітанів |
Програма - класифікація
|
Аналіз, доведення, спостереження, причино - наслідкові зв’язки |
«УГАДАЙ РЕЧОВИНУ»
Визнач тип хімічного зв’язку та схематично покажи механізм його утворення.
- Учасники міжпланетної експедиції виявили на поверхні планети Марс копалини твердої білої речовини. За н.у. вона легко перейшла у газоподібний стан і виявилась безбарвною та без запаху, важче за повітря. Дослідження показали, що в результаті взаємодії сполуки з лугом утворюється біла сіль. А після того, як до добутої сілі долили хлоридну кислоту знову виділився вихідний газ. Що за речовину виявили на поверхні Марсу?
- Німецька зброя - вбивця ФАУ-2 працювала з використанням цієї речовини. Отримана в 1818 році французьким хіміком Луї - Жаком Тенаром і названа "окислена вода". Використовують в американських космічних кораблях для отримання двох важливих для життя речовин.
- Ця проста речовина є алотропною модифікацією Оксигену. Її назва перекладається «пахучий». Нестійкий газ блакитного кольору з різким «металічним запахом». В природі зустрічається у верхніх шарах атмосфери.
- Несолетвірний оксид, отруйний газ навіть у невеликих кількостях, що утворюються при поганій роботі газових горілок, пічок. Викликає задуху.
Команди виконують завдання:
|
Програма-добудовування
|
Письмова, мовна комунікативна компетенція
|
Виникають між атомами різного виду. Утворюються за рахунок спільної електронної пари. Відбувається зміщення електронів. Виникають заряди. Міцний зв’язок |
Програма-подібність
|
Аналіз
|
|
Програма-осмислення |
порівняння |
|
Слайд-схема |
Письмова, мовна комунікативна компетенція
|
Видатний англійський хімік Хемфрі Деві завдяки цьому газові влаштовував спеціальні сеанси. От як зображував дію ГАЗА один із сучасників Деві: «Одні джентльмени скакали на столи й стільці, інші говорили без упину, треті виявили надзвичайний потяг до бійки». Назвіть цей газ мовою оригіналу й українською мовою.
Laughing gas (лафинн гез) (англ.) Веселильний газ (укр.) N2O
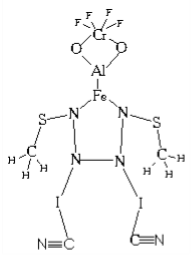
Сашко намалював свій хімічний автопортрет і сказав, що з часом обов’язково синтезує таку речовину. Вона буде володіти якимись надзвичайними властивостями. Знайдіть помилку, обґрунтуйте, що така речовина існувати не може.
Що вам відомо про взаємодію?
- Виберіть тип зв’язку, виходячи з типу атомів



![]()
![]()
![]()



- Поміркуйте про електронну структуру атомів, що беруть участь у взаємодії. Знаючи її можна знайти:



- Обміркуйте, які частинки знаходяться у вузлах кристалічної гратки.


- Опишіть взаємодію



- Встановіть, наскільки великі сили взаємодії



![]()
Цифровий диктант
1. Молекулярна гратка 1,7
2. Йонна гратка 2,4
3. Атомна гратка 5,6
4. Металічна гратка 3
Питання:
- гратка , в вузлах якої знаходяться як полярні, так і неполярні молекули.
- типові представники цієї гратка - солі.
- гратка , в вузлах якої знаходяться йони і атоми металів, в середині вільні електрони, що належать всьому кристалу.
- гратка , в вузлах якої знаходяться йони
- гратка , в вузлах якої знаходяться окремі атоми, що сполучаються між собою ковалентними зв’язками.
- Представниками цієї гратки є прості речовини: бор, карборунд, кремній .
- Представниками цієї гратки є – інертні гази, лід, сухий лід та інші.
V тур « Кіт у мішку»
- Яка речовина хімічно активніше – алмаз чи графіт?
- Який кристал механічно міцніше – алмазу чи кремнію? Відповідь обґрунтуйте
- Порівняйте температури плавлення галогенів та зробіть висновок про їх залежність від відносної молекулярної маси.
|
|
F2 |
Cl2 |
Br2 |
I2 |
|
Температура плавлення |
|
|
|
113,7°C |
- Кисень одержують випаровуванням рідкого повітря. В якому порядку відбувається випарювання компонентів ( азоту, кисню) із рідкого повітря? Чому?
- Як змінюються температури плавлення в ряду HCl – HBr – HI . Відповідь обґрунтуйте.
- Яка речовина кипить при більш низькій температурі SO2 чи SO3? Чому?
- Із яких йонів побудовані кристалічні гратки речовин: NaH, KOH, Li3N, MgO, Na2SO4, CaCO3.
- Порівняйте агрегатні стани солей, основ і кислот при кімнатній температурі. Наприклад, NaOH, NaCl, CaSO3, H2SO4, Ca(OH)2, HCl. Чим можна пояснити різницю?
- Чому при переході в межах груп Періодичної системи хімічних елементів зверзу вниз температури плавлення лужних металів зменшуються, а галогенів зростають?
Третій зайвий
Показані сірка, кварц, алмаз, графіт. Всі — речовини атомної будови, а сірка — молекулярної будови.
Додаткові матеріали
Задачі - хвилинки
- В архівах пожежної частини м. Бенд (США) зберігається запис про пожежу, яку викликав сніг. Ями з якою речовиною були у стін будинку?
У стін будинку були ями з речовиною, яка реагує з водою з виділенням великої кількості теплоти. Під дією води, яка утворюється із снігу, почалась екзотермічна реакція і теплоти було так багато, що почалася пожежа. (негашене вапно)
- Вона не солодка, не гірка, не солона, її можна приймати до, і після, і під час їжі. Рекомендується дорослими і дітям будь-якого віку, причому лікувальний ефект прямо пропорційний дозі й не було випадку, щоб надлишок ліків мав побічні ефекти. Люди приймають його з незапам’ятних часів, хоча ще жоден лікар не виписав на нього рецепта й жодна аптека не продала ні грама цього дивовижного препарату. Що це за суміш? (повітря)
- Тверда речовина у вогні не горить, у воді не тоне, не окислюється ні концентрованою сульфатною, ні нітратною кислотами. А при розчиненні в ній розплаву безбарвної сполуки Купрум (ІІ) утворюється забарвлену речовину. Про яку водневу сполуку йде мова. (вода)
- Учасники міжпланетної експедиції виявили на поверхні планети Марс копалини твердої білої речовини. За н.у. вона легко перейшла у газоподібний стані виявилась безбарвною та без запаху. Дослідження показали, що в результаті взаємодії сполуки з лугом утворюється сіль. А після того, як добуту сіль змішали з розчином алюміній хлориду, випав осад і знову виділився вихідний газ. Що за речовину виявили на поверхні Марсу? (вуглекислий газ)
- В Донбасі є величезні терикони (купи відпрацьованої гірської породи), які димлять, як справжні вулкани. Стояти на поверхні териконів у звичайному взутті неможливо, оскільки земля під ногами буквально горить. Всередині териконів t° ~ 800-1200°С. Звідки береться така кількість тепла?
Джерелом є повільне окислення піриту та органічних порід киснем і водяною парою повітря. А це процеси, що йдуть з виділенням тепла.
Завдання „Хімічний Буаяр ”
- Намагаючись використати найменшу кількість підказок, установіть, про який метал Х йде мова.
Підказка 1( історична)
Давньоримський письменник-вчений Пліній Старший (23-79 р. р. н.е.) писав, що імператор Тиберій (41 р. до н.е.) отримав в дарунок від одного ремісничого гарний блискучий кубок. Виготовлений цей кубок був з легкого металу Х, але за зовнішнім виглядом подібного до срібла. Ремісничий пояснював, що загадковий метал він отримав з білої глини. Імператор, боячись знецінення срібла через невідомий метал, наказав відрубати голову реміснику. Так було втрачено шляхи, які вели до відкриття нового металу.
Підказка 2 (хімічна)
Метал Х має високу спорідненість до кисню. Внаслідок цього він забирає Оксиген від оксидів неметалів і оксидів менш активних металів,
відновлюючи їх до вільного стану. Цей процес застосовується для добування деяких металів (Cr, Mn, V, Fe тощо), наприклад:
8Х + 3 Fe3O4 = 9 Fe + 4 X2O3
Підказка 3 (ювелірна)
До винайдення способу одержання металу Х методом електролізу вартість його була на рівні золота. На Всесвітній виставці в Парижі в 1855 р. метал Х демонструвався для виготовлення ювелірних виробів. На королівських прийомах шанованим персонам ставили прибори, виготовлені з Х, а всім іншим - із золота та срібла.
Підказка 4 (військова)
Метал Х у період російсько-японської війни (1905 р) використовували з метою отримання водню для аеростатів, використовуючи суміш Х та КОН (тв.). Ці компоненти тверді і їх зручно було транспортувати, а при додаванні води отримували бажаний продукт.
Підказка 5 (поетична)
Його нелегко добувати,
Відомий він лиш двісті літ,
М’який, активний і крилатий,
Він завойовує весь світ.
Підказка 6 (геологічна)
Метал Х – поширений серед металів у земній корі
Підказка 7 (енергетична)
Якщо порошок металу Х та заліза під тиском вилітає зі сталевої труби і згоряє в атмосфері кисню, то температура полум’я досягає 3000-3500 С. Такий “вогняний ніж ” легко ріже кількаметрові бруски бетону чи граніту.
(Відповідь: алюміній).


про публікацію авторської розробки
Додати розробку
