Класифікація хімічних реакцій за різними ознаками. Реакції сполучення, розкладу, заміщення, обміну
Урок 20
Тема: Класифікація хімічних реакцій за різними ознаками. Реакції сполучення, розкладу, заміщення, обміну
Мета: узагальнити й систематизувати знання учнів про хімічні реакції, розвивати вміння й навички визначення типів хімічних реакцій за рівняннями хімічних реакцій, формувати знання учнів про хімічні рівняння на прикладі класифікації рівнянь реакції за тепловим ефектом, наявністю каталізатора, зміною ступенів окиснення атомів у процесі хімічної реакції, розвивати навички складання рівнянь хімічних реакцій
Обладнання: мультимедійна дошка, комп’ютер, періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності, картки-завдання, реактиви: мідна спіраль, цвях, купрум сульфат, натрій гідроксид, пробірки, бенгальські вогники
Тип уроку: комбінований
Хід уроку
І. Організаційний момент
Доброго дня! У мене в руках парасолька. Як ви думаєте навіщо вона мені?
А парасолька для того, аби ніяка мряка, похмура погода не зіпсувала сонячного настрою, який я сподіваюсь буде царювати у нас на уроці. Ми будемо плідно старатися, щоб сьогоднішній урок для вас був продуктивний, а багаж знань та настрій після закінчення уроку відповідав смайлику № 2


№ 1 № 2
Отож, до роботи!
ІІ. Актуалізація опорних знань
А зараз, закрийте очі і уявіть: середина XІІІ ст., старовинний замок, а в ньому розмістилася величезна хімічна лабораторія, в якій день і ніч працюють найвидатніші алхіміки того часу. І вони дозволили нам попрацювати в цьому замку. Але, перед тим як вирушити до замку й розпочати працювати там, ми повинні переконатися, чи вистачить у вас знань.
За два роки знайомства з хімією ми вивчили величезну кількість речовин, познайомилися з їх фізичними і хімічними властивостями, навчилися писати рівняння хімічних реакцій. Давайте дещо пригадаємо: Світ такий різноманітний й таємничий. А наука хімія розкриває деякі його таємниц
Вправа «Мозковий штурм»
- Хімічна реакція-це…
- Які речовини називаються реагентами?
- Які речовини називаються продуктами?
- Які бувають речовини?
- Які речовини називають простими?
- Які речовини називають складними?
- Які ознаки протікання хімічних реакцій ви знаєте?
ІІІ. Мотивація навчальної діяльності
Стародавня легенда розповідає, що цариця Клеопатра , яка була відома не тільки своєю красою, а ще й освіченою, виграла оригінальне парі, з'ївши дорогоцінний «сніданок», який коштував 100 000 сестерцій. (Грошова одиниця на той час)
Ось як це описано в книзі Генрі Хаггарда «Клеопатра»: «…Вона вийняла з вуха одну з тих величезних перлин і опустила перлину в оцет. Запанувала тиша, вражені гості, завмерши спостерігали, як незрівнянна перлина повільно розчиняється у міцному оцті. Від неї не залишилось і сліду, і тоді Клеопатра підняла келих, покрутила його і випила весь до останньої краплі».
Що сталося з перлиною? До якого типу можна віднести цю хімічну реакцію?
Щоб відповісти на ці питання здійснимо класифікацію хімічних реакцій і зупинимось на першій класифікації
ІV. Вивчення нового матеріалу
Учитель. Кожна хімічна реакція індивідуальна, оскільки в неї беруть участь конкретні хімічні речовини з притаманними їм властивостями . Разом з тим, різні хімічні реакції мають багато спільних ознак, що дає змогу класифікувати їх на підставі тієї чи іншої ознаки.
У вас на столах у роздатковому матеріалі лежить «Хімічне лото», необхідно знайти відповідність правої та лівої сторін.
А зараз ми перевіримо чи є виграшною складена вами комбінація, розглянувши схему класифікації хімічних реакцій.
Класифікація хімічних реакцій
За кількістю та складом реагентів і продуктів реакції
сполучення розкладу
заміщення обміну
За тепловим ефектом
екзотермічні ендотермічні
За зміною ступеня окиснення
окисно-відновні без зміни ступеня окиснення
За наявністю каталізатора
каталітичні некаталітичні
За напрямом протікання
оборотні необоротні
Висновок. Таким чином, враховуючи певні ознаки ми склали схему найважливіших класифікацій хімічних реакцій.
Учитель. У 7 класі ви ознайомились з реакціями , у кожній з яких кількість продуктів і реагентів неоднакова. Давайте пригадаємо їх. А в процесі роботи складемо структурно-логічну схему «Павучок», яка схарактеризує хімічні реакції за кількістю та складом реагентів і продуктів реакції. М.В.Ломоносов російський письменник, вчений, поет, стверджував: «Хімії жодним чином навчитися неможливо, не бачивши самої практики і не беручись за хімічні операції.»
Учитель. Зараз ми будемо працювати з таким металом, який зустрічається частіше в природі ніж золото, срібло, залізо. Цей метал був перший з яким познайомились найдавніші люди. В цього металу висока електропровідність, його використовують при проводжені електричного струму, мобільних телефонах. Це є мідь – Купрум.
Дослід 1. Перейдемо до хімічного експерименту. Ваше завдання уважно спостерігати, скласти рівняння реакцій і визначити тип.
Візьмемо скручену мідну спіраль, закріпимо її в щипцях та нагріємо її. Нагріваємо у верхній частині (тому що найбільша температура). Через забарвлення і появу чорного кольору на кінчику спіралі, який ми нагріваємо. Утворюється чорний наліт – це купрум оксид. Якщо почистити наліт н білий листок паперу ми отримаємо порошок купрум оксид.
Запишемо рівняння реакцій 2Cu + O2 =2CuO
Умови перебігу: нагрівання
Ознаки: зміна кольору
Тип реакції: сполучення
Реакції сполучення – хімічні реакції, в результаті яких із двох або кількох речовин утворюється одна нова речовина
Заповнюємо схему Павучка
Дослід 2. Я проведу реакцію між залізом і розчином купрум сульфату(мідний купорос). Опускаю цвях в розчин мідного купоросу синього кольору. Цвях сірого кольору та металічним блиском. Залишимо цвях з розчином купрум сульфату для проходження хімічної реакції. Зверніть увагу шляпка не була покрита розчином і залишилась сірого кольору, а всьому іншому зявилося риже забарвлення. Це не іржа-це відклалася мідь. Так як атом Феруму більш активніший метал витісняє з розчину Купрум. Тобто відбулась реакція заміщення
Запишемо рівняння реакцій Fe+ CuSO4= Cu +FeSO4
Умови перебігу: приведення в систему
Ознаки: зміна кольору, утворення осаду
Тип реакції: заміщення
Реакція заміщення – це реакція між простою і складною речовинами, у процесі якої атоми простої речовини заміщують атоми одного з елементів у процесі якої атоми простої речовини заміщують атоми одного з елементів у складній речовині.
Заповнюємо схему Павучка
Дослід 3. Візьмемо розчин натрій гідроксид і додамо розчин купрум сульфат. Спостерігаємо утворення двох нових речовин – драглистий осад з блакитним забарвленням та прозорий розчин
Запишемо рівняння реакцій 2NaOH + CuSO4=Cu(OH)2 + Na2SO4
Умови перебігу: приведення в систему
Ознаки: зміна кольору утворення осаду
Тип реакції: обміну
Реакція обміну – це реакція, у процесі якої дві складні речовини обмінюються своїми складовими частинами.
Заповнюємо схему Павучка
Дослід 4. Візьмемо свіжоприготовлений розчин купрум гідроксид, який ми добули в попередньому досліді. Почнемо нагрівати. Хочу нагадати, що дуже багато реакцій відбувається при нагріванні. Прогріємо всю пробірку, а потім там, де знаходиться речовина. Ми бачимо, що в пробірці утворюється речовина чорного кольору. Це відбувся розклад купрум гідроксиду на купрум оксид і воду
Запишемо рівняння реакцій Cu(OH)2 =CuO + H2O
Умови перебігу: приведення в систему
Ознаки: зміна кольору, утворення води
Тип реакції: розкладу
(NH4 )2 Cr2O7 → Cr2O3 + N2 ↑ +4H2O
Заповнюємо схему Павучка
Реакції розкладу – це реакції, коли з однієї складної речовини утворюється декілька нових речовин.
Отже, ми сьогодні з вами розглянути класифікацію хімічних реакцій за кількістю та складом реагентів і продуктів реакції.
А зараз повернемось до легенди про яку я вам розповідала на початку уроку.
«Вона вийняла з вуха одну з величезних перлин і опустила в оцет. Запанувала тиша, вражені гості завмерли, спостерігаючи, як незрівнянна перлина повністю розчинилася в оцті. От від неї не залишилось і сліду, і тоді Клеопатра підняла келих, покрутила його і випила все до останньої краплі»
Учитель. За хімічним складом природні пери мають 85-90% кальцій карбонату, 4-6% органічної речовини і 3-4% води. Нескладно провести аналогічний дослід на уроці-замість перлини буде крейда, а замість органічної кислоти-мінеральна:
CaCO3 + 2HCl=CaCl2 + H2O+ CO2
Клеопатра чудово знала хімію, адже продукти реакції-зовсім нешкідливі, а кальцій хлорид застосовують у медицині як ліки. Відбулася реакція йонного обміну.
![]() обміну
обміну

![]()
![]() сполучення розкладу
сполучення розкладу
![]()
заміщення
V. Узагальнення і систематизація знань
Завдання 1.
До якого типу реакцій можна віднести реакції, що подані схемами, послідовно з'єднуючи букви, що є відповідями ви отримаєте назву хімічного елемента.
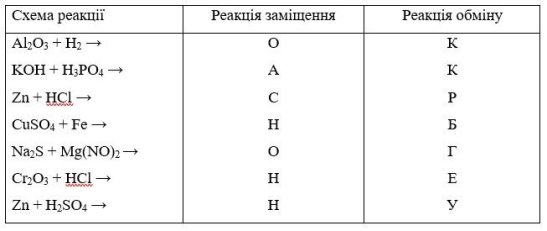
ОКСИГЕН
Завдання 2.
– Визначте про яку реакцію йдеться в уривку літературного твору. Запишіть її хімічне рівняння. Класифікуйте цю реакцію за кількістю та складом реагентів і продуктів
«Шипить та куриться вапно, що його гасять у великих дощаних скринях» (І.Франка)
Оксид кальцію CaO - негашене вапно, при взаємодії з водою утворюється гашене вапно- гідроксид кальцію
Гашене вапно використовують в будівництві
CaO + H2O Ca(OH)2
Реакцію взаємодії оксиду кальцію з водою в техніці називають «гашенням» вапна
Завдання 3.
До складу антацидних (проти печії) лікарських препаратів «Маалокс» і «Алмагель» входять магній гідроксид і алюміній гідроксид. Складіть рівняння реакцій цих сполук із хлоридною кислотою – головною складовою шлункового соку. Класифікуйте реакції за кількістю та складом реагентів і продуктів. Запишіть їхні рівняння у повній і скороченій йонній формах. Визначте, які йони у складі шлункового соку є причиною печії
а) ( Mg(OH)2 +2HCl →MgCl2 + 2H2O
Mg(OH)2 +2 H+ + 2Cl- →Mg2+ +2Cl- + 2H2O
Mg(OH)2 +2 H+ →Mg2+ + 2H2O
б) Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + 3H+ + 3Cl - → Al3+ + 3Cl- + 3H2O
Al(OH)3 + 3H+ → Al3+ + 3H2O
VII. Підбиття підсумків (оцінювання)
VIII. Домашнє завдання
1. Вивчити параграф Si, номер сторінки Au, номер завдання He, Li, N
2. Творче завдання :
а) Дати відповідь на запитання - Чому яблуко темніє?
б) Уявіть себе художником, якому доручили ілюструвати підручник хімії для дев`ятикласників. Намалюйте комікси, які зображують хімічні реакції сполучення, розкладу, заміщення, обміну. Можете створити анімаційний фільм.


про публікацію авторської розробки
Додати розробку
