Урок на тему "Масова частка розчиненої речовини"
тема "Розчини" вивчається у 7, 9 класі.
Актуальним є вивчення поняття концентрація, розв'язування задач. В розробц показано урок засвоєння нових знань. Може бути використано дану інформацію під час викладання хімії у 9 класі
1
Середня загальноосвітня школа №3
м. Івано-Франківськ
КОНСПЕКТуроку хімії
на тему:
„ МАСОВА ЧАСТКА РОЗЧИНЕНОЇ РЕЧОВИНИ”
 9 КЛАСС
9 КЛАСС
підготувала вчитель хімії СЗШ №3
м. Івано-Франківська
Галюк Наталія Ярославівна
Тема уроку: Масова частка розчиненої речовини
Девіз уроку: Кількість обумовлює якість
Закон розвитку природи
Мета уроку: закріпити та поглибити знання учнів про розчини. Ознайомитися з кількісною характеристикою розчинів, навчити розв'язувати задачі, використовуючи поняття "масова частка розчиненої речовини". Сформувати практичні вміння і навички роботи з розчинами. Розвивати уміння спостерігати, розмірковувати, логічно мислити. Виховувати дбайливе ставлення до зелених насаджень, формувати елементи екологічної культури.
Тип уроку: урок засвоєння нових знань.
Засоби навчання:
ТЗН - кодоскоп, завдання до кодоскопа,
Наочність — опорний конспект, карточки,
Обладнання - 3 склянки з цукровими забарвленими напоями, склянки з дистильованою водою і сіллю, колба, мірний циліндр, наважка сульфату калію, паличка з гумовим наконечником. На столі в учнів набори: хімічний стакан з водою, колба з паличкою, наважка речовини.
Форми
Навчання: фронтальна бесіда, самостійна словникова робота з термінами, робота з опорним конспектом, робота з підручником, виконання експерименту.
Міжпредметні
ЗВ'ЯЗКИ: математика, фізику, біологія, екологія, медицина.
Хід уроку
I. Організаційний момент.
II. Актуалізація опорних знань учнів.
Доброго дня, діти! Прошу сідати. Звати мене - Наталія Ярославівна. У нас
сьогодні незвичайний, конкурсний урок, то ж і розпочати його я пропоную
оригінально - проведемо дегустацію.
На столі представлені їстівні напої у побутових склянках, напої готові до
вживання. Усі вони приготовлені у домашніх умовах. Завданням дегустатора
буде посмакувати напої і поділитися з нами своїми враженнями.
До дегустації запрошую -...
Питання до обговорення дегустації:
- Ви куштували чисті речовини чи суміші?
- Як називаються ці однорідні суміші?
- Назвіть компоненти цих розчинів.
- Що є подібного між представленими розчинами?
- Яка різниця? Що на смак ви відчули?
Дякую. Прошу сідати.
III. Мотивація навчальної діяльності.
Діти! По-науковому не кажуть "менш солодкий, найсолодший,
солоденький, мало цукру - більше води". У науці таких виразів ми не
зустрінемо.
Отож, ми сьогодні спробуємо визначити наукове трактування
співвідношення між розчиненою речовиною і масою розчинника.
IV. Вивчення нового матеріалу.
(на партах знаходиться опорний конспект з логічним викладом матеріалу). Опорний конспект - додаток №1
Запишіть у зошит тему уроку.
Прошу звернути увагу на запропонований девіз уроку. Це один із діалектичних законів розвитку природи - "Кількість обумовлює якість". У процесі дегустації ми лише частково торкнулись залежності якості від кількості. А я звертаюсь до вас із проханням - зауважити до кінця уроку усі подібні приклади, які дадуть нам змогу переконатися у тому, що кількість
визначає якість.
Ми нагадаємо певні поняття, що зустрічались на попередніх уроках і з якими будемо працювати і сьогодні.
Складемо для цього у зошиті словник.
Розмістіть у стовпчик поняття, які ви бачите на дошці і навпроти кожного дайте визначення. Ці завдання можете виконувати самостійно, або скористайтесь підручником на сторінці 67-69. Можете звернутися до опорного конспекту.
Словник: Розчин -
Розчинник -
Концентрований розчин -Розбавлений розчин -
Масова частка одного із компонентів у суміші -
(Учні виконують роботу на протязі 3 хвилин). Прослухаємо відповіді.
Вираз для визначення масової частки одного із компонентів
у суміші прошу записати на дошці.
W=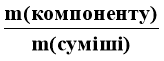
Скажіть, будь ласка, а розчин - то суміш?
А розчинена речовина - це компонент розчину?
То чи могли би ми цю формулу застосувати для знаходження співвідношення
між масою розчиненої речовини і масою розчину?
Спробуємо перевести, спроектувати цей математичний вираз на тему
сьогоднішнього уроку.
W=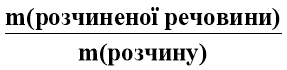
Нагадайте, які компоненти входять до складу розчину? Отож, маса розчину - це маса розчиненої речовини і маса розчинника. Запишіть ще один вираз для обчислення масової частки розчиненої речовини
![]()
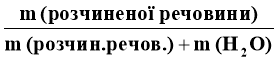
.
(Усі формули учні записують у зошит і використовують для розв'язування задач).
Маса розчиненої речовини завжди менша маси розчину, отже, масова частка розчиненої речовини менша одиниці. Оскільки масова частка є відношенням однотипних величин, то формально не має власної одиниці виміру. Виражають її у частках від одиниці, від якої легко перейти до вираження масової частки розчиненої речовини у відсотках - помножити на 100%.
Чи є у вас запитання?
V. Застосування знань у стандартній ситуації.
Запропоную завдання.
Маємо стакан чистої дистильованої води. Яка тут масова частка розчиненої речовини?
Інше завдання, пов’язане з нашою темою. Але розрахунків не проводемо - спробуємо підключити логічне мислення.
Ось у хімічному стакані знаходиться 80 г солі, води не має. Яка масова частка розчиненої речовини тут?
Ці завдання допомогли нам перейти до проведення більш складних розрахунків, які часто мають дуже суттєве значення.
Всі ми радіємо, коли кабінет, кімнату прикрашають живі квіти, тому і займаємось вирощуванням кімнатних рослин: систематично поливаємо, підживлюємо.
Та й ми з вами можемо приготувати розчин, який використаємо для
підживлення рослин у вашому кабінеті. Отже, розв'язуємо задачу на приготування розчину. Умова задачі запропонована в опорному конспекті.
Ознайомтесь.
Учень рішає задачу біля дошки.
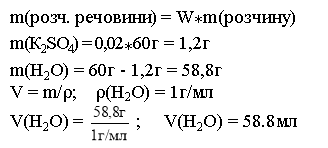 Дано:
Дано:
![]() m(р-ну) = 60г
m(р-ну) = 60г
W(К2SО4) = 0,02
![]() m (К2SО4) - ?
m (К2SО4) - ?
m (Н20) - ?
На столі знаходиться зважена маса сульфату калію і відміряний об'єм води.
(Учень демонструє приготування розчину: висипає сіль у хімічний стакан,
доливає по паличці воду, розмішує).
Наголошую, що все в кабінеті хімії, у лабораторіях має бути підписано. Тому
на колбу з приготовленим розчином наклеюємо етикетку, де вказана формула
речовини і масова частка.
Де ми використаємо цей розчин?
Хід розв’язку задачі вам зрозумілий?
Прошу сідати.
VI. Застосування знань у нестандартній ситуації.
Проведення точних розрахунків відіграє важливу роль у підвищенні
врожайності, у боротьбі з хворобами і шкідниками рослин, при збереженні
врожаю. Неправильні розрахунки призводять до того, що ми можемо
знищити не тільки шкідників і бур’яни, але й рослини, які вирощуємо,
нанести непоправну шкоду всім тим, хто споживає ті рослини.
Грамотного і уважного підходу до приготування розчинів підтримуються і
фармацевти. Вони певній речовині задають дозування, яке дає відповідний
ефект.
Ви знаєте з курсу біології, що втрата крові небезпечна для організму, при
цьому відбувається зневоднення. При невеликій втраті крові вводять
внутрішньовенне фізіологічний розчин.
Що це за розчин?
Фізіологічний розчин - розчин хлориду натрію з масовою часткою розчиненої речовини 0,9 %. Тобто у фізіологічному розчині масою 100г знаходиться 0,9г хлориду натрію. Для приготування цього важливого розчину точно відміряну наважку солі розчиняють у дистильованій воді при абсолютно стерильних умовах, герметично упаковують. Такий розчин
придатний для ін'єкцій, санітарної обробки, дезинфекції. Але невелика неточність, помилка в процесі його готування може коштувати людині життя.
Отож, позитивний результат, очікувана якість можливі тільки тоді, коли розрахунки будуть точними, чіткими, грамотними.
VII. Закріплення та поглиблення знань.
Давайте, діти, і ви спробуєте приготувати розчин і визначити масову частку розчиненої речовини у ньому.
Для цього ви маєте на парті наважку речовини з вказаною масою, хімічний стакан з необхідним в задачі об'ємом води, колбу, де приготуєте розчин, паличку, текст задачі. Прошу визначити масову частку розчиненої речовини у добутому вами розчині і записати на етикетку.
Алгоритм приготування розчину описаний в опорному конспекті. (Учні проводять розрахунки, готують розчин).
Перевірка відповідей усно, порівняння з відповідями до завдань на кодоскопі.
Оцінювання. Аргументація оцінок.
VIII. Підсумки уроку. Питання до класу:
- Яке питання розглядали на уроці?
- Компонентом чого є розчинена речовина?
- Розчин чого ми сьогодні разом готували?
-
Щоб обчислити масову частку розчиненої речовини, які величини ми
повинні мати? -
На початку уроку я акцентувала вашу увагу на тому, що наш урок
проходитиме під девізом "Кількість визначає якість". Як ви зрозуміли
наш девіз?
Кількісні зміни призводять до змін якісних.
Зараз ви намагались аргументовано давати відповіді на запитання.
Отже, мета уроку - ознайомитись з поняттям "масова частка розчиненої речовини" і навчитись розв'язувати задачі - досягнута.
На наступних уроках вас чекає контрольна робота, під час якої ви
продемонструєте набуті сьогодні теоретичні знання і практичні навички, і я сподіваюсь з успіхом виконаєте її.
X. Домашнє завдання.
(Проектується на екран)
Учнів, котрих ця тема зацікавила, і попередні завдання виявляться
неважкими, прошу виконати зав. 107.
Ще одне завдання: пропоную виступити автором задачі. Скласти умову і
розв'язати задачу, спираючись на тему сьогоднішнього уроку. Невелика
порада: ви можете звернутись до мамів, бабусь з питанням про те, які
розчини вони використовують, наприклад, при консервуванні, солінні, для
медичних цілей.
Це завдання творче, якщо воно буде виконано правильно - може бути оцінено
дванадцятьма балами.
Вдячна за урок. Бажаю успіхів у вивченні такої цікавої і потрібної в житті науки - хімії.
Кількість набутих вами знань неодмінно переросте у їх якість і поповнить ваш інтелект.
До побачення!


про публікацію авторської розробки
Додати розробку
