Конспект заняття з хіміії для 8 класу на тему: «Хімічний зв`язок і будова речовини»
«Все пізнається в порівнянні. Від аналізу до структури,
а від неї – до властивостей і застосування».
- Конспект заняття.docx docx
- Презентація.pptx pptx
Тема заняття: Хімічний зв'язок і будова речовини
Мета заняття: систематизувати знання учнів про види хімічного зв’язку й типи кристалічних ґраток, продовжити формувати елементи наукового світогляду учнів про єдність будови речовини та її властивостей; розвивати уміння прогнозувати властивості речовин залежно від виду хімічного зв'язку і типу кристалічних, навички учнів застосовувати отримані знання для виконання завдань різної складності; виховувати культуру спілкування.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, роздатковий матеріал, картки із завданнями, речовини з різними видами зав’язків та типами кристалічних ґраток, кулькова модель пропану, мультимедійний проектор, презентація, пластилін, сірники.
Тип заняття: 2А-П
Хід заняття:
І Організаційний етап. Рефлексія
ІІ Актуалізація опорних знань та мотивація навчальної діяльності
Хімічний зв'язок і будова речовини Постановка проблемного питання: “Що
![]()
![]()
![]()
![]() було б якби ми не вивчали цієї теми?”
було б якби ми не вивчали цієї теми?”
“Будь-яка речовина – від найпростішої до найскладнішої –
має три відмінні, але взаємопов’язані сторони:
склад, будову і властивості”
Б. М. Кедров
І разом з вами протягом заняття ми доведемо його актуальність і доцільність.
ІІІ Використання знань, умінь і навичок для виконання завдань різної складності
Завдання 1. «Хімічний каламбур»
Вивчаючи дану тему, ми з вами зустрілися з великою кількістю нових термінів та понять, що створили невпорядкованість, хаос, так званий «каламбур» знань. Я пропоную навести лад з’ясувавши чи правильні твердження та пояснити свою думку.
- Хімічний зв’язок – це взаємодія двох або більше атомів з утворенням стійкої 6-електронної системи.
- Електронегативність – властивість атома зміщувати у свій бік електронну пару, спільну з іншим атомом.
- Хімічний зв’язок буває ковалентним, йонним, металічним та інертним.
- Ковалентний зв’язок буває трьох типів: КП, КНП та йонний.
- КП зв’язок утворюється між атомами з однаковими електронегативностями.
- КНП утворюється між атомами одного і того ж неметала.
- Йонний зв’язок виникає між елементами, які сильно відрізняються своєю електронегативністю.
- Йони – це нейтральні частинки.
- У вузлах молекулярної гратки знаходяться електронейтральні атоми.
- Атомна ґратка характеризується дуже високою міцністю та низькими температурою плавлення та температурою кипіння.
- Н2 – сполука з йонним зв’язком та з молекулярною ґраткою.
- В йонній кристалічній ґратці діють сили електростатистичної взаємодії.
Продовжимо роботу працюючи в групах. Назвіть свою групу та поясніть її вибір.
Завдання 2. «Крилатий вислів»
Відгадай, про що говориться у висловах, та визначте речовину (O2, H2O, NaCl, SiO2)
- «… Мене вразило більше, ніж я міг висловити, що свічка в цьому газі горіла чудово блискучим полум’ям…» Джозеф Прістлі
- «Ти не маєш ні смаку, ні запаху, тебе не опишеш, тобою насолоджуєшся, не розуміючи, що ти є. Ти не просто необхідна для життя, ти і є життя».
Антуан де Сент-Екзюпері
- «Ніколи не вживайте в їжу мертві продукти і звичайно цю речовину. Не купуйте взагалі ніяких продуктів, що містять її. Людський організм абсолютно не потребує цієї речовини, вона є отрутою». Поль Брегг
Насправді ця речовина – це найцінніший дар природи, до якого слід ставитися дуже уважно. Недарма раніше вона цінувалася на вагу золота.
Тіло людини на 70% складається з води і ця речовина підтримує водний баланс в організмі.
- «Ти безбарвна, кристалічна і природа в тебе вічна.
На планеті в великих кількостях існуєш й різноманітністю дивуєш».
Страбон
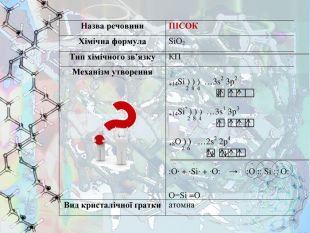
Завдання 3. «Хімічний паспорт»
Вкажіть тип хімічного зв’язку та вид кристалічної ґратки, напишіть механізм утворення зв’язку та опишіть фізичні властивості попередньо визначеної речовини.
Завдання 4. «Уяви собі»
Кожна людина, читаючи твори, часто уявляє собі героїв, про які йдеться мова. Я пропоную вам навчитися не лише зображувати структуру речовини, але й уявляти її. Обведіть руками контури молекули, зображені на листку. Повторіть ці рухи в повітрі з відкритими, а потім з закритими очима.
Завдання 5. «Хімічний конструктор»
З наведених хімічних елементів складіть по дві формули речовин з атомною, молекулярною та йонною кристалічними ґратками, враховуючи валентності.
K, C, O, H, Mg, Si, Cl
Завдання 6. «Творча майстерня»
А тепер поговоримо про креативність. 2011 рік – міжнародний рік хімії. Одним із проектів, що мають популяризувати всю науку, могло б стати виготовлення для дитячої кімнати штор із зображенням моделей молекул добре відомих речовин, які мають практичне значення. Використовуючи пластилін та сірники побудуйте відповідну сполуку.
![]()
![]()
![]()
![]() Н Н O
Н Н O
![]()
![]()
![]()
![]() Н-C-H О=C=O Н-C-C H-C= N.
Н-C-H О=C=O Н-C-C H-C= N.
![]() Н Н O H
Н Н O H
Ми не передаємо просторову структуру, а лише розташування атомів у сполуці.
Завдання 7. «Розрахункова розминка»
Розв’яжіть задачу:
- Біла кристалічна речовина, що має високу температуру плавлення (2585˚С), розчинна у воді. Її можна зустріти у складі різноманітних порошків, які застосовуються для випічки. Основні обсяги цієї речовини застосовуються в будівельній сфері під час виробництва силікатної цегли.
Знайдіть формулу цієї сполуки, якщо відомо, що це оксид елемента ІІ групи. Масова частка Оксигену становить 28,57%.
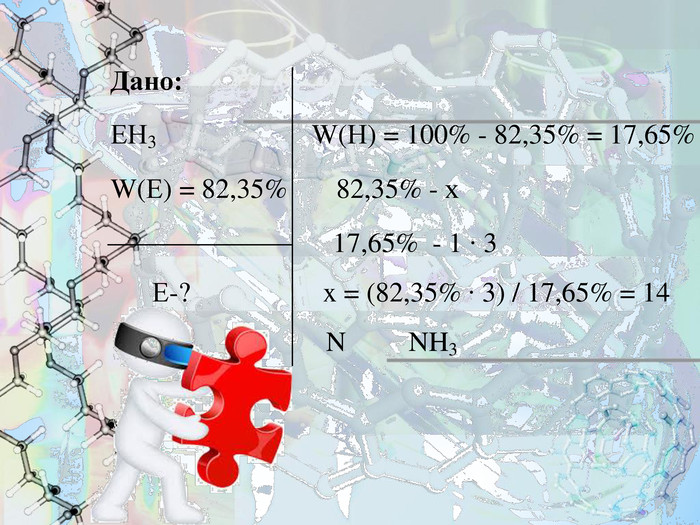
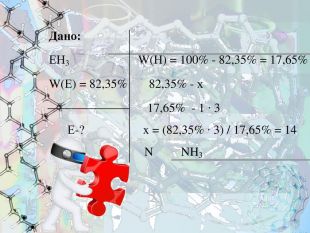
- Безбарвний газ з характерним різким запахом, добре розчинний у воді, використовується у медицині.
Знайдіть формулу цієї бінарної леткої сполуки з Гідрогеном, в якій масова частка невідомого елемента V групи становить 82,35%.
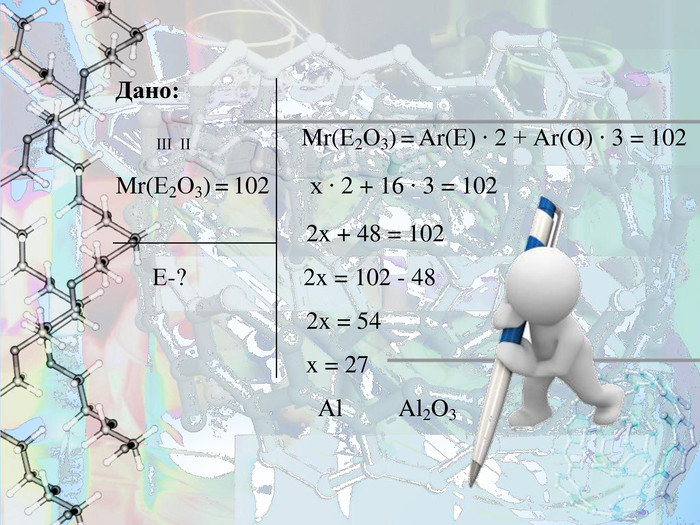
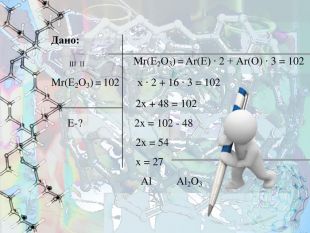
- Біла кристалічна речовина, хімічно дуже стійка, температура плавлення 2050 °C. У воді не розчиняється. Використовується для виробництва багатьох видів кераміки, різних сортів скла, нанесення покриттів для захисту металів від окиснення, дії агресивних середовищ і ерозійного зносу.
Знайдіть формулу цієї сполуки, якщо відомо, що це оксид елемента ІІІ групи. Відносна молекулярна маса оксиду становить 102.
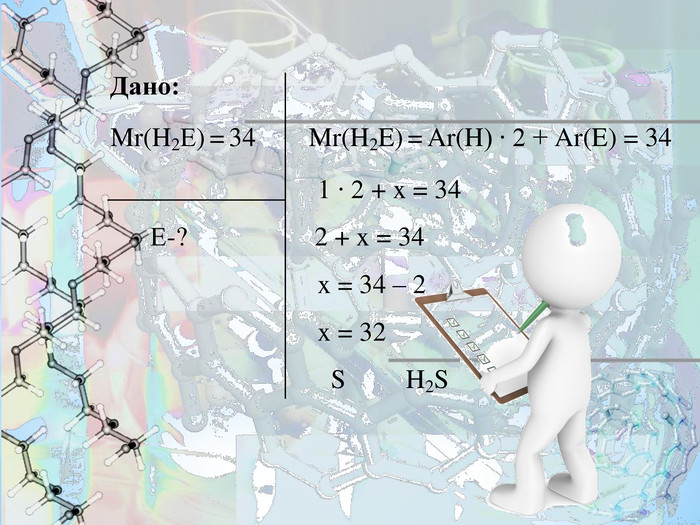
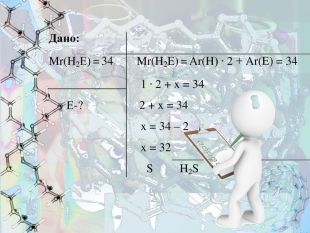
- Безбарвний, дуже отруйний, горючий газ з характерним неприємним запахом, мало розчинний у воді. Цей газ утворюється в результаті вулканічної активності, входить до складу природного газу і деяких вод.
Знайдіть формулу речовини, якщо відомо, що це летка сполука з Гідрогеном, що утворює елемент VІ групи. Відносна молекулярна маса становить 34.
Завдання 8. «Візуальна розминка»
Я називатиму предмети або сполуки, що пов’язані з вивченням нашої теми, а ви відшукайте їх у класі та вкажіть поглядом. (Періодична система, кулькова модель пропану, кристалічна ґратка, формула вуглекислого газу)
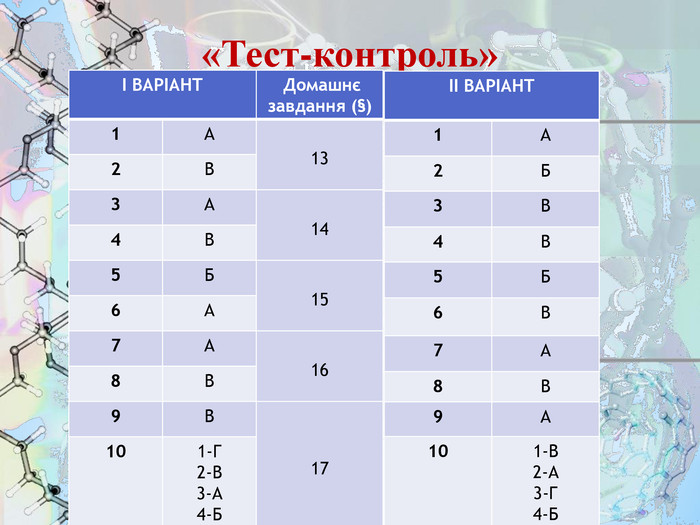
Завдання 9. «Тест-контроль»
Виконайте тести за варіантами
|
ВАРІАНТ І |
||||||||||||||||||||||
|
1. |
Укажіть групу атомів, які можуть утворювати лише позитивно заряджені йони А К, Na, Са B Cl, K, Na Б К, N, Mg Г Н, Сl, Вr |
|||||||||||||||||||||
|
2. |
Спільним у будові йонів К+ і Сl- є А кількість протонів В кількість електронів Б кількість нейтронів Г кількість протонів і нейтронів |
|||||||||||||||||||||
|
3. |
Речовина, утворена елементами з електронними конфігураціями ...2s1 і …3s23p4, має кристалічну ґратку А йонну В молекулярну Б металічну Г атомну |
|||||||||||||||||||||
|
4. |
Укажіть формулу речовини з йонною кристалічною ґраткою: А Н2О Б N2 B KOH Г SiO2 |
|||||||||||||||||||||
|
5. |
Виберіть хімічний елемент, атоми якого під час утворення молекул у хімічних реакціях намагаються набути стійкої зовнішньої оболонки з двох електронів: |
|||||||||||||||||||||
|
6. |
У молекулі брому тип хімічного зв’язку: Б Ковалентний полярний Г Металічний |
|||||||||||||||||||||
|
7. |
Виберіть елемент, що має найменшу електронегативність: А Li Б Сa В Cl Г B |
|||||||||||||||||||||
|
8. |
Вкажіть, як зміщені спільні електронні пари в молекулі НСІ і чому: Б у бік Гідрогену, оскільки його електронегативність вища, ніж у Хлору В у бік Хлору, оскільки його електронегативність вища, ніж у Гідрогену Г у бік Гідрогену, оскільки його електронегативність нижча, ніж у Хлору |
|||||||||||||||||||||
|
9. |
У вузлах кристалічних ґратках алмазу містяться: |
|||||||||||||||||||||
|
10. |
Установіть відповідність між типом кристалічних ґраток та речовиною
|
|||||||||||||||||||||
Завдання 10. «Літературна хвилинка»
Враховуючи профіль вашого класу – поглиблене вивчення предметів філологічного напрямку, хочу запропонувати вам написати невеличкий твір – синкан за схемою, виділяючи із теми головне.
1 рядок – тема синкану (одне слово, іменник);
2 рядок – опис теми в двох словах (прикметники);
3 рядок – опис дії в рамках теми трьома словами (дієслова);
4 рядок – фраза із чотирьох слів, що виражає ваше особисте відношення до теми;
5 рядок – одне слово-синонім, що характеризує суть предмету.
ДОДАТКОВЕ ЗАВДАННЯ
Сторінка майбутнього абітурієнта
Не дивлячись на профіль класу, в якому ви навчаєтесь, хтось з вас в 11 класі вибере здачу ЗНО з хімії. Наприклад, серед завдань ЗНО 2011 року були чотири питання цієї теми. Давайте розглянемо їх і з’ясуємо чи достатньо наших знань для їх розв’язання.
«…7. На якій схемі зображено перекривання електронних хмар атомів у молекулі гідроген броміду?

8. Який тип хімічного зв'язку в сполуці Кальцію з Бромом?
А йонний
Б ковалентний неполярний
В ковалентний полярний
Г металічний
11. Бінарну сполуку Силіцію а Карбоном — дуже міцний і твердий матеріал карборунд — використовують для шліфування та гранування дорогоцінного каміння. Які кристалічні ґратки в цієї речовини?
А атомні
Б йонні
В металічні
Г молекулярні
38. Установіть відповідність між моделями молекул і назвами речовин.
Моделі молекул
1 2 3 4
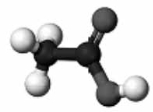
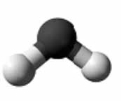
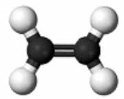
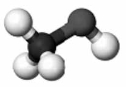
Назва речовин
А чадний газ
Б вода
В етилен
Г оцтова кислота
Д метиловий спирт».
IV Повідомлення домашнього завдання. Рефлексія. Оцінювання

![]() Опрацювати параграф, визначений тестуванням, та оберіть завдання відповідно
Опрацювати параграф, визначений тестуванням, та оберіть завдання відповідно
![]() підсумкової рефлексії
підсумкової рефлексії
![]() Виконати завдання № 91, 100
Виконати завдання № 91, 100
![]()
![]() Виконати завдання № 92, 106
Виконати завдання № 92, 106
Виконати завдання № 93, 115
V Підсумки заняття
Повернемося до епіграфа уроку
Між будовою речовини, яка визначається типом хімічного зв'язку і типом кристалічних ґраток, та її властивостями існує певна залежність: чим міцніший хімічний зв'язок, що утримує частинки у вузлах кристалічних ґраток, тим міцніші кристали, тим твердіша речовина, тим вищі її температури плавлення і кипіння. А тому, якщо відомі властивості речовини, можна зробити висновок про її можливу будову, і навпаки – якщо відома будова речовини, можна прогнозувати її не лише фізичні властивості, але й хімічні.
-
-
Дякую! Дуже вчасно, головне нічого зайвого! Рівно 45 xв.


про публікацію авторської розробки
Додати розробку