Урок на тему: "Оксиген. Кисень, склад його молекули, фізичні властивості"
Розробка уроку за темою:"Оксиген. Кисень, склад його молекули, фізичні властивості" включає в себе самостійну роботу, загадку, повідомлення дітей, ігри "Вірю-невірю", "Займи позицію"
1
Оксиген. Кисень, склад його молекули, фізичні властивості
Кисень – це речовина, навколо якої
обертається земна хімія.
Й.Я. Берцеліус
Мета: закріпити знання учнів про хімічні елементи й прості речовини на прикладі Оксигену, кисню та озону; ознайомити учнів із фізичними властивостями й поширенням кисню в природі; навчити учнів характеризувати хімічний елемент Оксиген за певним планом; розвивати вміння класифікувати речовини, порівнювати, аналізувати, робити висновки; формувати інформаційну компетентність та вміння знаходити необхідний матеріал.
Тип уроку: засвоєння нових знань.
Методи роботи: самостійна робота, повідомлення, слайд-шоу.
Обладнання: періодична система, комп’ютер, презентація, проектор, екран.
Хід уроку:
І. Організаційний момент
ІІ. Активізація знань
Самостійна робота.
Розділіть запропоновані речовини на групи і запропонуйте їх класифікацію:
І варіант
Na, MgО, Al, P2O5, Li2O, C, S, Al2O3, Cu, ZnO.
Прості речовини: Na, Al, C, S, Cu.
Складні речовини: MgO, P2O5, Li2O, Al2O3, ZnO.
ІI варіант
Cr2O3, Ca, BaO, FeO, Cl2, N2, K, Na2O, NO2, Br2.
Прості речовини: Ca, Cl2, N2, K, Br2.
Складні речовини: Cr2O3, BaO, FeO, Na2O, NO2.
ІІІ. Мотивація навчальної діяльності
Відгадай загадку
У чому горять дрова й газ,
Фосфор, водень та алмаз?
Дихає чим кожен з нас
Кожну мить і кожен час?
Без чого мертва природа?
Правильно, без … (кисню)
Отже, як ви вже здогадалися, мова сьогодні піде про Оксиген та кисень. Тому запишіть тему сьогоднішнього уроку: “Оксиген. Кисень, склад його молекули, фізичні властивості.”
ІV. Вивчення нового матеріалу
Давайте зараз подивимося на періодичну систему і знайдемо там зараз Оксиген. Спробуйте охарактеризувати його за цим планом… (виводиться слайд на екран, презентація)
1. Хімічний елемент
2. Хімічний символ елемента
3. Відносна атомна маса
4. Валентність
5. Період
6. Група
Потім виводимо слайд із правильними відповідями:
1. Хімічний елемент – Оксиген,
2. Хімічний символ елемента – О,
3. Відносна атомна маса – 16,
4. Валентність – ІІ,
5. Період – 2,
6. Група – VI, головна підгрупа.
Які прості речовини утворює Оксиген? Та кисень і… Є ще одна речовина, яка називається озон.
На сьогодні ваші однокласники отримали завдання підготувати певні повідомлення. Зараз ми з вами послухаємо, та ще й подивимося яким чином був
відкритий кисень (повідомлення 1).
У серпні 1774 року англійський священик і філософ Д. Прістлі (мал. 1) займався нагріванням різних речовин, збираючи сонячне проміння за допомогою збільшувального скла. Він помістив трохи червоного гідраргіум (II) оксиду під скляною банкою над стовпом металевої ртуті (мал. 2). Потім узяв запалювальне скло і спрямував крізь нього пучок сонячних променів (мал. 3). Коли вони нагріли окис ртуті, з неї почав виділятися газ, який витіснив ртуть із банки. Спочатку Д. Прістлі подумав, що це повітря. Та коли він опустив у посудину з цим газом запалену свічку (мал. 4), то побачив щось незвичайне. “Я взявся вивчати це повітря. І мене здивувало, − писав Прістлі, − більше, ніж я міг передати словами, що свічка в цьому газі горіла надзвичайно блискучим полум'ям”. ("Хімія, 8 клас", Квазар-мікро, 2004)
Д. Прістлі впустив одну мишу в посудину із звичайним повітрям, а другу – в таку саму посудину, але з газом, що його він добув. Перша миша скоро задихнулася, а друга в цей час ще почувала себе добре і жваво рухалася. Д. Прістлі й сам пробував дихати добутим газом і переконався, що дихати ним особливо легко і приємно. Відкритий Д. Прістлі газ і був киснем.
Спершу Прістлі думав, що добуте ним «повітря» містить якусь домішку азотистої речовини. Він думав так тому, що окис ртуті було виготовлено з азотнокислої ртуті. Та зрештою, виділивши кисень із сурика, селітри й інших речовин і переконавшись, що для перетворення закису азоту в його окис “повітря” потрібно в 4 – 5 разів менше, ніж звичайного, Прістлі остаточно дійшов висновку, що добутий ним газ становить чисту речовину.
Прістлі, як і багато його сучасників, перебував у полоні флогістонних поглядів. Тому добутий кисень він назвав “дефлогістованим повітрям”.
Майже одночасно з Прістлі кисень добув шведський хімік Шеєлє (мал. 5). Щоправда, він ішов іншим шляхом, ніж Прістлі. Шеєлє виділив кисень способом нагрівання азотнокислого магнію, розкладанням вуглекислого срібла, прожарюванням селітри. Шеєлє назвав кисень “вогняним повітрям”. Він також був прихильником теорії флогістону і тому не міг дати правильної назви відкритому ним газові.
Повну ясність у цю заплутану проблему судилося внести Лавуазьє (мал. 6). У жовтні 1774 р. Прістлі прибув до Парижа, де зустрівся з Лавуазьє і деякими іншими видатними фізиками і розповів їм про дивовижні властивості “дефлогістованого повітря”.
Лавуазьє невдовзі повторив досліди Прістлі з нагріванням ртуті і кількісно зміряв продукти реакції.
На відміну від Шеєлє і Прістлі Лавуазьє правильно зрозумів суть відкриття кисню.
Лавуазьє цілком чітко уявляв, що повітря складається з двох різних газів.
5 вересня 1777 р. в доповіді, представленій Академії наук, Лавуазьє сказав: “Віднині дефлогістоване повітря, або зручне для вдихання повітря в стані сполучення чи фіксації, я позначатиму іменем кислототворного начала, або, якщо це ж позначення грецьким словом більше до вподоби, я назву його началом оксиген”.
 (мал. 1)
(мал. 1)  (мал. 2)
(мал. 2)  (мал. 3)
(мал. 3)
 (мал. 4)
(мал. 4)  (мал. 5)
(мал. 5)  (мал. 6)
(мал. 6)
Тепер послухаємо повідомлення про поширення Оксигену в природі (повідомлення 2).
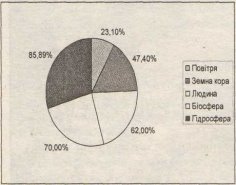
Уміст Оксигену у повітрі, земній корі, організмі людини, біосфері, гідросфері, %
Кисень — друга за кількістю та найважливіша для життя складова повітря, в якому на частку кисню припадає 21 % за об'ємом та 23 % за масою.
Кількість кисню в атмосфері земної кулі оцінюється в більш ніж 1*1015 тонн. Стільки ж важить мільярд пірамід Хеопса ‒ найбільшої споруди давнини (для перевезення матеріалів однієї піраміди потрібно було б 9 тис. товарних потягів). Незважаючи на величезність цієї величини, вага вільного кисню не перевищує 0,0001 % його у земній корі.
Оксиген є найпоширенішим елементом на Землі, оскільки він входить до складу майже всіх речовин, з яких складається літосфера, та майже 90 % маси гідросфери. Земна кора до глибини 10‒15 км майже на 50 % складається з Оксигену. Пісок містить 53 % Оксигену, у глині його ‒ 56 %, у людському організмі ‒ 65 %, у складі води ‒ 89 %, а вона ж вкриває дві третини поверхні земної кулі!
А зараз настала черга послухати про фізичні властивості кисню та його фізіологічні дію (повідомлення 3).
У природі кисень утворюється в процесі фотосинтез, що відбувається в зелених рослинах на світлі. Він являє собою газ, безбарвний, не має запаху й смаку, порівняно погано розчиняється у воді, у 100 об'ємах води за температури, близької до 0 °С, розчиняється близько п'яти об'ємів кисню (4,89).
Літр кисню важить (1,4289) набагато більше за рівний об'єм повітря (1,293).
У разі охолодження до –183 °С кисень перетворюється на блакитну рідину, що притягується магнітом та важча за воду.
За температури –218,9 °С кисень перетворюється на тверду речовину темно-синього кольору, яка також притягується магнітом.
У техніці кисень одержують з рідкого повітря, користуючись більш високою температурою кипіння рідкого кисню (–183 °С) порівняно з рідким азотом (–195,8 °С). Одержують також за допомогою електролізу води, але це значно дорожче.
Кисень є найважливішою речовиною для організмів, оскільки підтримує дихання. Завдяки диханню в живих організмах відбувається реакція окиснення, у результаті чого виділяється енергія, необхідна для життєдіяльності організму, а також тепло для підтримання температури теплокровних тварин.
Один вдих кисню є рівноцінним п'яти вдихам повітря. Тому хворим для збереження сил, необхідних для процесу дихання, та заради достатньої кількості кисню дають дихати чистим киснем.
Чистим киснем постійно людина дихати не може, оскільки він є отрутою для організму. Якщо концентрація кисню в атмосфері Землі підвищиться до 30 %, усі процесі в живих організмах прискоряться і вони почнуть швидше старіти. Крім того, вдихання чистого кисню може призвести до стану ейфорії, тобто кисневого отруєння. Але якщо концентрація кисню в повітрі впаде нижче за 16 %, людина почне задихатися.
Крім цього для кисню характерне явище парамагнетизму – здатність речовини втягуватись в магнетичне поле, що відрізняє його від інших газоподібних речовин. Причина цього явища не розгадана.
Ми з вами згадували про те, що Оксиген утворює дві прості речовини – кисень та озон. Про кисень ми щойно послухали, тепер настала черга озону (повідомлення 5).
Озон був відкритий в 1785 році голландським фізиком Ван-Марумом, а в
чистому вигляді був отриманий лише в 1922 році німецькими хіміками Е. Різенфельдом та Г. Швабом. Він був названий так тому, що грецьке «озо» означає «пахну».
Озон міститься в повітрі в незначних кількостях. У повітрі полів, хвойних лісів та океанів озону більше, ніж поблизу місць проживання людини.
У житті людини й тварин, а також рослин озон відіграє велику роль, про яку багато хто й не підозрює. Озон рятує людину і тварин від сліпоти! Справа в тому, що озон поглинає ультрафіолетові промені, які надзвичайно шкідливі для всього живого. Зникнення озонового шару загрожує загибеллю всього живого на нашій планеті.
Однак і збільшення кількості озону має не меншу загрозу, ніж перша. Ультрафіолетові промені необхідні для утворення вітаміну О, необхідного для формування організму. Відсутність цього вітаміну призвела б до загибелі тварин і людини. І це сталося б, якби ультрафіолетові промені цілком поглиналися б озоном.
Крім цього, перебування в атмосфері з підвищеним вмістом озону викликає відчуття втомленості, головний біль, за більш високих концентрацій з'являються нудота, кровотеча з носа, запалення очей, переродження серцевого м'яза, смерть.
Чистий, газоподібний озон вибухає навіть від подиху, вже не кажучи про струс, контакт з горючими речовинами. Тому використовують озоновий кисень (вміст озону 12,5% і вище).
В середовищі озону натягнута гума розривається, тому що довгі молекули каучуку легко окислюються озоном і руйнуються. Це явище називають «хімічним ножем».
Озон руйнує еритроцити крові, цей небезпечний газ спричиняє глибинні спадкові зміни (мутації) в генах людини, які можуть бути причиною хвороби у дітей. Дослідженням встановлено, концентрація озону в повітрі – 0, 00001% за об'ємом протягом 10 хвилин чинить на людський організм таку ж згубну дію, як і 250 рентген радіації. Тому всі досліди з озоном проводяться надзвичайно обережно, додержуючись всіх правил техніки безпеки.
В газоподібному стані озон має інтенсивний синій колір, але мало хто бачив синій озон, ця речовина нестійка, його дуже важко сконцентрувати.
V. Закріплення знань:
Гра “Вірю-невірю”:
1. Молекулярна формула кисню – О2. (так);
2. Відносна молекулярна маса – 16. (ні. 32);
3. За нормальних умов кисень – тверда речовина. (ні. Це газ);
4. Кисень підтримує дихання та горіння. (так);
5. Кисень виникає в повітрі. (ні. Він виникає в процесі фотосинтезу в зелених рослинах на світлі);
6. Основний компонент повітря – кисень. (ні. Азот);
7. Озон – це модифікація Оксигену. (так);
8. Оксиген – це металічний елемент. (ні. Неметалічний);
9. Кисень здатний проявляти явище парамагнетизму. (так);
10. Озон безпечний для здоров’я. (ні. Він отруйний, руйнує еритроцити крові).
А зараз послухайте невеликий уривок із Ільфа і Петрова “Золоте теля”:
«В маленькому номері, відведеному диригенту симфонічного оркестру, спав Остап Бендер. Він лежав на плюшевому простирадлі, одягнутий, притискаючи до грудей валізу з мільйоном. За ніч великий комбінатор вдихнув в себе кисень, що містився в кімнаті, і хімічні елементи, що залишилися в ній, можна було назвати повітрям лише через ввічливість».
Використовуючи стратегію «Займи позицію» дайте відповідь на запитання «Чи може одна людина за ніч суттєво змінити вміст повітря в кімнаті?»
(Ні. Буде використано приблизно 72л кисню. Це менше 0,5% об’єму повітря кімнати).
VI. Оголошення завдань додому
§ 16, впр. 121 – 126 ст. 101.


про публікацію авторської розробки
Додати розробку
