Урок на тему "Валентність хімічних елементів"
Урок для учнів 7 класу
Тема: «Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів.»
Мета:
- Навчальна: сформувати поняття про валентність як основну властивість атома утворювати хімічні сполуки; дати поняття про валентність атомів хімічних елементів навчити складати формули бінарних сполук за валентністю атомів елементів;
- Розвивальна: встановити причинно-наслідкові зв’язки між місцем знаходження елементів у Періодичній системі хімічних елементів та їх валентностями; розвивати вміння працювати за аналогією та вміння робити логічні висновки;
- Виховна: виховувати любов до праці шляхом залучення всіх учнів до навчальної діяльності;
Обладнання: Інтерактивна дошка, проектор, періодична система Д. І. Менделєєва (короткоперіодичний та довгоперіодичний варіанти).
Тип уроку: комбінований урок.
Хід уроку
- Організаційний етап ( 2хв.)
- Актуалізація опорних знань (10хв.)
- Вивчення нового матеріалу (15хв.)
- Узагальнення та систематизація знань (10хв.)
- Підведення підсумків уроку (5хв.)
- Домашнє завдання (3хв.)
- Організаційний етап
Добрий день, діти! Я рада вітати всіх вас на нашому уроці. Тема сьогоднішнього уроку «Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів.»
- Актуалізація опорних знань
«Експрес – контроль»
Виберіть одну правильну відповідь (кожна правильна відповідь – 1 бал)
1. Виберіть формули простих речовин: а) H2, б)HCl, в)O2, г)NО2, д)N2O
А. а) і в); Б. б) і в); В. а) і д).
2. У якому рядку є лише складні речовини?
А. F, H2O, HCl, H2SO4;
Б. H2, Cl2, O3, CO2, Al;
В. HCl, H2O, H2SO3, KOH;
Г. H2O, CaO, Cu, H3PO4;
3. Виберіть рядок, у якому перелічені символи атомів металічних елементів:
А. Na, P, S, Cu, Al, H; В. H, K, Ca, Ba, Se, Si;
Б. C, Br, P, S, Al, Mg; Г. Na, Ca, Al, Zn, Fe, K.
4. Виберіть рядок, у якому перелічені символи атомів неметалічних елементів:
А. Li, Na, Ca, Si, C, H; В. Si, C, H, Cl2, P, O;
Б. Cr, Mn, Fe, O, C, H; Г. Zn, Al, Cl, P, S, Na.
Виберіть декілька правильних відповідей (кожна правильна відповідь – 1 бал)
5. З поданих нижче речовин виберіть формули простих:
А. Fe; Б. H2O; В. CO2; Г. H2; Д. Al; Е. CaC2; Є. NaCl..
6. З поданих нижче речовин виберіть формули складних:
А. MgO; Б. Zn; В. SO2; Г. Br2; Д. N2O5; Е. P; Є. PH3.
Завдання 7-8 оцінюється у 3 бали.
7. Напишіть формули речовин, до складу яких входять:
А. три атоми Натрію, один атом Фосфору, чотири атоми Оксигену;
Б. один атом Натрію, один атом Нітрогену, три атоми Оксигену;
В. два атоми Фосфору, п'ять атомів Оксигену.
8. Опишіть якісний і кількісний склад молекули за хімічною формулою:
А. B2O3; Б. H2SO4; В. HCl.
Встановіть відповідність
(Завдання 9-10 оцінюється у 3 бали)
9. Встановіть відповідність
1. дві молекули кисню а) 3О;
2. три вільні атоми Оксигену б) СО;
3. один атом Оксигену, що входить в) 2О2;
до складу речовини.
10. Установіть відповідність для запису С2Н6:
1. 2,6; а) індекси;
2. 2; б) загальне число атомів Гідрогену;
3. 6. в) загальне число атомів Карбону в одній молекулі.
- Вивчення нового матеріалу
Для того щоб краще засвоїти новий навчальний метеріал, переглянемо відео за посиланням: https://www.youtube.com/watch?v=3eh446LAojQ
Засновником вчення про валентність вважають німецького хіміка Фрідріха Августа Кекуле, який запропонував теорію валентності у 1857 році (150 років тому).
Отже, валентність – це загальна властивість атомів приєднувати до себе певну кількість атомів іншого хімічного елемента.
Молекулярні формули показують лише якісний та кількісний склад речовин, але хіміки використовують ще один вид формул — структурні формули. Ці формули показують не лише хімічний склад, а й дають наочне уявлення про кількість хімічних зв’язків кожного елемента і про порядок зв'язування атомів один з одним.
У структурних формулах кількість хімічних зв’язків, які утворює атом хімічного елемента позначають рисками, саме кількість рисок і визначає його валентність.
Отже, структурна формула – це формула, яка показує порядок розташування та з’єднання атомів в молекулі. .
Валентність є найважливішою характеристикою хімічних елементів. З розвитком науки зміст цього поняття багаторазово змінювався. Наприклад, раніше валентність визначали як число атомів одновалентного елемента, з якими сполучається один атом даного елемента. У наш час валентність – це число хімічних зв'язків, якими даний елемент сполучається з іншими атомами. Максимальна валентність, як правило, відповідає номеру групи періодичної системи хімічних елементів, у якій знаходиться хімічний елемент. Всі хімічні елементи за властивістю поділяються на дві групи:
І Елементи, що виявляють сталу валентність;
ІІ Елементи, що виявляють змінну валентність.
Елементи, які виявляють сталу валентність
І. Одновалентні:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
I |
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
I |
|
Гідроген - |
H (I) |
|
H |
|
CI |
|
|
|
H |
|
O |
|
H |
|
H |
|
C |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Флуор - |
F(I) |
|
F |
|
O |
|
F |
|
|
|
|
|
|
|
|
|
H |
|
|
Метали І групи головної підгрупи – лужні метали
|
H |
|
F; |
|
Ca |
|
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
|
ІІ. Двовалентні:
|
|
|
|
II |
|
II |
|
Ba |
О |
|
Оксиген – |
О(ІІ) |
|
Ca |
|
BaO 2; |
|
|
|
|
|
|
|
|
|
|
|
О |
Метали ІІ групи
|
Ba |
|
CI; |
|
Zn |
|
S |
|
|
|
|
|
|
|
|
|
CI |
|
|
|
|
|
|
Виняток: Hg валентність І; ІІ.
Виняток: Hg валентність І; ІІ.
ІІІ. Тривалентні:
|
|
|
CI |
|
|
|
III |
|
|
|
|
|
BCI3 |
B |
|
CI |
|
|
|
|
|
|
|
|
|
CI |
|
|
|
|
|
|
|
O |
|
|
|
AI |
|
|
|
III |
|
|
|
|
|
AI2O3 |
|
|
|
O |
|
|
|
AI |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
Елементи, які виявляють змінну валентність
І V група. Валентність: ІІ і І V :
|
II |
II |
II |
II |
II |
|
IV |
IV |
IV |
IV |
IV |
|
CO |
SiO |
GeO |
SnO |
PbO |
|
CO 2 |
SiO 2 |
GeO 2 |
SnO 2 |
PbO 2 |
|
|
|
|
|
|
|
|
|
|
|
|
V група. Валентність ІІІ і V :
|
III |
III |
III |
III |
III |
|
V |
V |
V |
V |
V |
|
N2O3 |
P2O3 |
As2O3 |
Sb2O3 |
Bi2O3 |
|
N2O5 |
P2O5 |
As2O5 |
Sb2O5 |
Bi2O5 |
Виняток: Нітроген
|
I |
II |
III |
IV |
V |
|
N2O |
NO |
N2O3 |
NO2 |
N2O5 |
VІ група. Валентність ІІ, І V , V І.
|
II |
II |
II |
II |
|
IV |
IV |
IV |
IV |
|
VI |
VI |
VI |
VI |
|
H2O |
H2S |
H2Se |
H2Te |
|
SO2 |
SeO2 |
TeO2 |
PoO2 |
|
SO3 |
SeO3 |
TeO3 |
PoO3 |
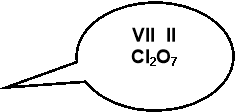
VII група . Валентність : I; III; V; VII.
|
I |
I |
I |
III |
V |
VII |
|
HCI |
HBr |
HI |
CI2O3 |
CI2O5 |
CI2O7 |
Виняток: Флуор
|
I |
|
HF |
Метали побічних підгруп можуть виявляти як парну, так і непарну валентність. Так, атом Феруму може виявляти наступні валентності, які збігаються з такими ступенями окислення:
|
II |
|
III |
|
FeO |
|
Fe2O3 |
Атом хрому:
|
II |
|
III |
|
VI |
|
CrO |
|
Cr2O3 |
|
CrO3 |
Атом мангану:
|
II |
|
IV |
|
VI |
|
VII |
|
MnO |
|
MnO2 |
|
MnO3 |
|
MnO7 |
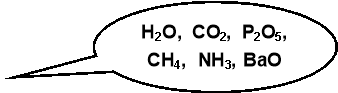
Бінарні сполуки – складні речовини, до складу яких входять атоми двох хімічних елементів.
H2O, CO2, P2O5, CH4, NH3, BaO
*Для неметалів у сполуках з металами або Гідрогеном валентність дорівнює:
Валентність = 8 - № групи. Наприклад : складемо формулу Магнію з Нітрогеном. Магній стоїть у ІІ групі, отже у нього валентність = ІІ. Нітроген стоїть у V групі, отже його валентність буде дорівнювати 8 - 5 = 3. Валентність Нітрогену = III
Складаємо формулу ІІ ІІІ
Mg3 N2
Алгоритм складання формул за валентністю
1. Записуємо поряд два елементи.
|
Fe O |
Si O |
H O |
P H |
2. Над елементом вказуємо його валентність (римськими цифрами).
|
III II |
IV II |
I II |
III I |
|
Fe O |
Si O |
H O |
P H |
3. Знаходимо найменше спільне кратне між числами валентностей елементів.
|
III(6)II |
IV(4)II |
I(2)II |
III(3)I |
|
Fe O |
Si O |
H O |
P H |
4. Ділимо найменше спільне кратне почергово на валентність кожного елемента і знаходимо індекси, які записуємо внизу біля символа даного елемента(індекс «1» не пишуть).
|
III(6)II |
IV(4)II |
I(2)II |
III(3)I |
|
Fe2O3 |
SiO2 |
H2O |
PH3 |
- Узагальнення та систематизація знань
Для того, щоб перевірити рівень засвоєння матеріалу, пропоную заповнити таблицю.
|
Клас_____ Прізвище_____________________ І варіант |
|
Клас_____ Прізвище_____________________ ІІ варіант |
||||||||
|
|
I Br |
I |
O |
II S |
|
III N |
O |
Cl |
F |
|
|
II Fe |
|
|
|
|
Na |
|
|
|
|
|
|
Al |
|
|
|
|
II Pb |
|
|
|
|
|
|
I Ag |
|
|
|
|
III Cr |
|
|
|
|
|
- Підведення підсумків уроку
На сьогоднішньому уроці ви глибше пізнали таємницю будови речовини. Знаєте, що атоми сполучаються не випадково, а на основі їх валентності. За валентністю атомів елементів або груп атомів можна скласти формули хімічних сполук. (В кінці уроку учні отримують завчасно надрукований опорний конспект уроку (такі опорні конспекти дають можливість більше часу приділяти поясненню або закріпленню матеріалу)).
Пропоную до Вашої уваги опорний конспект з теми сьогоднішнього уроку.
Валентність хімічних елементів.
Складання хімічних формул за валентністю атомів елементів.



Э. Франкланд
1825-1899






Існують елементи зі сталою і змінною валентністю
Валентності атомів деяких елементів
|
Валентності деяких хімічних елементів |
||
|
Валентність |
Хімічні елементи |
Приклади речовин |
|
|
Валентність стала |
|
|
І |
H, Li, Na, K, Rb, Cs, Fr, F |
H2O, Na2O, HF |
|
ІІ |
Be, Mg, Ca, Sr, Ba, Ra, Zn, O |
CaO, MgO, ZnO |
|
ІІІ |
B, Al, Ga |
Al2O3, B2O3 |
|
|
Валентність змінна |
|
|
І і ІІ |
Cu |
Cu2O, CuO |
|
ІІ і ІІІ |
Fe, Co, Ni |
FeO, Fe2O3 |
|
ІІ і IV |
C, Sn, Pb |
CO, CO2 |
|
III i V |
P |
PH3, P2O5 |
|
II, III i VI |
Cr |
CrO, Cr2O3, CrO3 |
|
II, IV i VI |
S |
H2S, SO2, SO3 |

 Алгоритм складання формули бінарної сполуки за відомими валентностями
Алгоритм складання формули бінарної сполуки за відомими валентностями





![]()
- Домашнє завдання
За підручником Г.А. Лашевська, А.А. Лашевська опрацювати параграф 13;
Завдання:
- Визначте валентність елементів в бінарних сполуках: Cu2O, FeO, Fe2O3, P2O5,PH3, PbO, PbO2, MnO, Mn2O7, H2S, CrO, Cr2O3, CrO3, SO2, HCl, Cl2O5, Cl2O7, SO3, N2O, NO, NO2, NH3, CO, CO2, Hg2O, HgO.
- Заповнити таблицю:
|
|
O |
I Cl |
II S |
|
К |
|
|
|
|
Ва |
|
II I BaCl2 |
|
|
III Fe |
|
|
|


про публікацію авторської розробки
Додати розробку
