Урок "Оцтова кислота, її властивості та застосування"
Оцтова кислота, її властивості та застосування
Мета: ознайомити учнів із молекулярною та структурною формулами оцтової кислоти, функціональною карбоксильною групою карбонових кислот, а також з фізичними та хімічними властивостями оцтової кислоти та сферою її застосування; розвивати вміння учнів складати рівняння реакцій, що характеризують хімічні властивості оцтової кислоти; учити розуміти суть і типи записаних реакцій; формувати вміння працювати в групі; виховувати почуття взаємодопомоги, інтерес до предмета.
Тип уроку: урок вивчення нового матеріалу.
Форма уроку: урок-дослідження.
Методи навчання: пояснювально-ілюстративні (розповідь, бесіда), наочні (лабораторний дослід), репродуктивні.
Обладнання та реактиви: мультимедійна дошка, інструкція до лабораторного досліду, штатив із пробірками, розчини оцтової та хлоридної кислот, лакмус, метилоранж, фенолфталеїн.
Девіз уроку: «Щоб світ цікавий розгадати, слід хімію пізнати».
Хід уроку
І. Організаційний момент
Учитель. Пропоную в незвичній формі провести наш урок. Уявімо, що наша школа – це науково-дослідний інститут, а кабінет хімії – це його хімічна лабораторія. У ній працюють такі відділи: теоретичний, інформаційний, фізичний, експериментальний і практичний. Кожен відділ отримує конкретне завдання, наприкінці уроку ці відділи будуть звітувати про виконану роботу.
ІІ. Актуалізація опорних знань
Запитання для теоретичного відділу лабораторії
Метод «Мозковий штурм»
1. Що спільного між лимоном, томатом, квашеною капустою, щавлем і кефіром? (Кислий смак)
2. Чому кропива подразнює шкіру? (Адже до складу соку входить кислота)
3. Чому чай після додавання лимону світлішає? (Кислота змінює забарвлення барвника)
4. Чому кефір, ряжанка, сметана, просто кваша належать до кисломолочних продуктів? (До їх складу входить молочна кислота)
5. Які органічні сполуки називають кислотами?
6. Яка функціональна група входить до складу карбонових кислот? (Карбоксильна)
7. За якими ознаками можна класифікувати карбонові кислоти? (За характером хімічних зв’язків між атомами Карбону, за кількістю функціональних груп, за кількістю атомів Карбону, за силою)
ІІІ. Мотивація навчальної діяльності
1. Прийом «Відстрочена відгадка»
Учитель. Ця речовина відома ще з давніх часів. Але в чистому вигляді її виділили лише в 1700 р., хоча до цього користувалися її водним розчином. Утворюється вона дуже просто – унаслідок прокисання вина. Цією речовиною заправляли один із відомих французьких салатів – вінегрет («кисле вино» французькою звучить «він егр»). Назвіть цю речовину. (Оцтова кислота)
2. Оголошення теми, мети та очікуваних результатів уроку
(Учні записують тему уроку)
Учитель. Нашій лабораторії надійшло державне замовлення – дослідити склад, властивості й застосування оцтової кислоти. На виконання завдання нам відводиться 45 робочих днів (45 хв). Завдання уроку – формувати компетенції дослідника. Об’єктом дослідження є оцтова кислота, а предметом дослідження – її властивості. Пропоную дослідження здійснити за таким планом:
1) будова молекули;
2) фізичні властивості;
3) хімічні властивості;
4) застосування.
IV. Вивчення нового матеріалу
(Інформаційний відділ звітує про виконану роботу. Випереджувальне завдання).
Банк цікавих даних
Учений-історик. Оцтова кислота – це найперша кислота, що стала відомою людству у вигляді оцту, який утворюється під час бродіння вина. Більше 4000 років тому в Стародавньому Єгипті та інших країнах уміли готувати вино з виноградного соку, під час скисання якого утворюється оцет. Ним як харчовою приправою почали користуватися 3000 років тому. Тоді оцет був єдиною харчовою кислотою. Його назва ототожнювалася з уявленням про кисле та кислоти. Слово «кислий», «кислота» походять від лат. аcetum – «оцет», acidum – «кислий».
Арабський хімік Добір ібн Гайан (VIII-IX ст.) отримав концентровану оцтову кислоту з оцту під час його перегонки.
Синтетична оцтова кислота вперше отримана Шталем у 1700 р., а її склад установив Берцеліус у 1814 р. Вважається, що синтез оцтової кислоти, здійснений Г. Кольбе у 1845 р., був першим повним синтезом органічної сполуки з елементів.
Учений-біолог. Усім відомо, що є хлібне дерево, шоколадне, динне … Але чи знаєте ви, що існує оцтове дерево – сумах пухнастий? Це дерево або кущ заввишки до 4 м. Листки перисті, великі, зелено-сірі, восени набувають яскраво-червоного забарвлення. Сумах використовують як декоративне дерево в парках та садах. Плоди оцтового дерева містять оцтову кислоту, їх застосовують як гостру приправу до м’ясних страв.
Учений-філософ. Існує вираз «напоїти оцтом і жовчю», що означає «приносити страждання, муки, отруювати існування комусь». А ще розповідають, ніби колись у китайських крамничках продавали картину «Куштувальники оцту». На ній за цим заняттям були зображені троє мудреців: Конфуцій, Будда та Лаоцзи. У кожного на обличчі художник намалював вираз, який відповідав його ставленню до життя. Конфуцію оцет видався кислим, Будді – гірким, а Лаоцзи – солодким. Конфуцій був прихильником порядку та ієрархії, тому сприймав оцет так, як його сприймають усі. Будда уособлює ставлення до життя як безкінечне коло страждань, із якого вирвуться лише ті, хто відкине цей нікчемний суєтний світ. А Лаоцзи, засновник даосизму, усміхається, приймаючи реальність такою, якою вона є, людина зберігає в собі вічну сутність і вчиться на власних помилках.
Працівник харчової промисловості. Столовий оцет (6-9 % розчин оцтової кислоти) використовують як смакову приправу та консервант, наприклад для виготовлення маринадів.
Оцтова кислота утворює кисле середовище для знищення шкідливих бактерій. Чутливість мікроорганізмів до кислого середовища використовують під час консервування овочів, квашення чи маринування.
Учитель. У харчовій промисловості СН3СООН використовується як консервант і регулятор кислотності під кодом Е-260. Напишіть хімічну, структурну та електронну формули цієї речовини.
Хімічна формула:
СН3СООН – оцтова (етанова) кислота
Структурна формула оцтової кислоти:
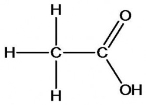
Електронна формула оцтової кислоти:
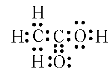
Будова молекули етанової (оцтової) кислоти
Учитель. Структурна формула:

Розгляньте модель молекули в підручнику.
Зв'язок С – Н – ковалентний слабко полярний, зв’язки С=О і О – Н – ковалентні сильно полярні. У результаті зміщення електронної густини подвійного зв’язку до атома Оксигену атом Карбону одержує надлишковий позитивний заряд. Тому електронна густина в гідроксильній групі значно зміщена до атома Оксигену. Атом Гідрогену у зв’язку з цим легко відщеплюється у вигляді протона, зумовлюючи кислотні властивості.
Фізичні властивості оцтової кислоти
(Учні самостійно їх виписують із підручника. Відділ фізичної хімії звітує про свою роботу).
Оцтова кислота – це безбарвна рідина, летка, має різкий специфічний запах, змішується з водою у будь-яких пропорціях, розчин є кислим на смак.
За t<16,70С кристалізується («льодяна кислота»).
3-9 % водний розчин – столовий оцет.
80% водний розчин – оцтова есенція.
Температура кипіння сполуки становить +118,10С.
Дослідження хімічних властивостей оцтової кислоти
Учитель. Пропоную дослідним шляхом довести, що оцтова кислота виявляє загальні властивості кислот. Хочу нагадати вам, що ми працюємо в хімічній лабораторії, тому завжди повинні пам’ятати про техніку безпеки.
(Діти повторюють правила техніки безпеки і виконують експериментальні завдання).
Завдання для експериментального відділу
Завдання 1. Доведіть, що оцтова кислота виявляє кислотні властивості.
Лабораторний дослід № 1 «Дія оцтової кислоти на індикатори»
У дві пробірки налийте 1-2 мл розчину оцтової кислоти та додайте кілька крапель розчинів лакмусу й метилового оранжевого.
Завдання для класу. Складіть рівняння електролітичної дисоціації оцтової кислоти.
Очікувана відповідь: СН3СООН ↔ СН3СОО- + Н+.
Завдання 2. Дослідіть взаємодію оцтової кислоти з металами.
Лабораторний дослід № 2 «Взаємодія оцтової кислоти з металами»
У дві пробірки налийте розчини оцтової та хлоридної кислот. В обидві пробірки додайте трохи порошку магнію. Порівняйте активність взаємодії цих кислот із магнієм.
Завдання для класу. Опишіть дослід, запишіть рівняння відповідних реакцій у молекулярному та йонному виглядах.
Завдання 3. Дослідіть взаємодію оцтової кислоти з лугами.
Лабораторний дослід № 3. «Взаємодія оцтової кислоти з лугами»
У пробірку налийте трохи розчину лугу й додайте кілька крапель фенолфталеїну. Потім краплями додавайте розчин оцтової кислоти до знебарвлення розчину.
Завдання для класу. Опишіть дослід, запишіть рівняння відповідної реакції у молекулярному та йонному вигляді.
Завдання 4. Дослідіть взаємодію оцтової кислоти з солями.
Лабораторний дослід № 4. «Взаємодія оцтової кислоти з солями»
У пробірку налийте трохи розчину оцтової кислоти і шпателем додайте питну соду. Спостерігайте за змінами, які відбуваються в пробірці.
Завдання для класу. Опишіть дослід, напишіть рівняння відповідної реакції у молекулярному та йонному виглядах.
Учитель. У посібнику «Хімія в нашому домі» можна прочитати таку пораду: «Щоб відновити блиск потемнілих із часом золотих і позолочених виробів, варто залишити на їх поверхні на кілька хвилин ватний тампон, змочений в оцті, а потім промити виріб водою». Поясніть це явище, знаючи, що в ювелірному сплаві супутником золота часто є мідь, яка може окислюватися з утворенням сполуки чорного кольору, що і надає золотим речам тьмяності.
Демонстрація «Чищення старого мідного ґудзика ватним тампоном, змоченим в оцті»
Очікувана відповідь: мідь окиснюється та утворюється купрум (ІІ) оксид чорного кольору: 2Cu + O2 = 2CuO.
Карбонові кислоти взаємодіють з оксидами металічних елементів.
Завдання для класу. Запишіть рівняння взаємодії оцтової кислоти з купрум (ІІ) оксидом у молекулярному та йонному виглядах.
Специфічні властивості карбонових кислот
Учитель. Реакція естерифікації. Карбонові кислоти здатні взаємодіяти зі спиртами з утворенням естерів:
СН3СООН + C2H5OH → СН3СОО C2H5 + H2O.
Реакція етерифікації відбувається в присутності сульфатної кислоти, яка в цьому випадку відіграє роль каталізатора й гігроскопічної речовини.
Горіння. Як і більшість органічних сполук, карбонові кислоти дуже добре горять. Що більший вуглеводневий радикал, то більша ймовірність протікання реакції горіння з виділенням сажі:
СН3СООН + О2 = 2СО2 + 2Н2О.
Демонстрація «Полум’я над пробіркою»
Налийте в пробірку не більше 1 мл концентрованої оцтової кислоти. Закріпіть пробірку в лапці штатива в похилому положенні, прогрійте спочатку її всю, а потім обережно нагрівайте лише денце. Коли оцтова кислота закипить і її пара досягне виходу з пробірки, обережно підпаліть її за допомогою довгої скалки. Пара оцтової кислоти зажевріє, утворюючи довгі язики полум’я (нагрівання пробірки не припиняйте). Дослід є ефектним: створюється враження, ніби з пробірки вилітають язики полум’я. З припиненням утворення пари оцтової кислоти горіння завершується.
V. Узагальнення та систематизація знань
1. Запитання для практичного відділу лабораторії
Інтерактивна вправа «Слідство ведуть хіміки»
Під час введення за допомогою комп’ютера результатів лабораторних досліджень загубилися деякі формули речовин. Допоможіть визначити можливі варіанти, якщо частина інформації збереглася.
СН3СООН + … → (СН3СОО)2Са + …
… + Ba(OH)2 → (СН3СОО)2Ba + ///
СН3СООН + CaCO3 →
CH3OH + СН3СООН →
2. Розв’язування задач
Задача 1. Бабуся висипала соду (натрій карбонат) і кухонну сіль в однакові банки та забула, куди що висипала. Як, застосовуючи властивості етанової кислоти, можна визначити, де яка речовина? Запишіть рівняння реакції.
Задача 2. Як довести наявність етанової кислоти експериментально? Яким індикатором не можна довести наявність катіону Гідрогену в розчині кислоти? Запишіть рівняння дисоціації етанової кислоти.
Учень-практик. Застосування оцтової кислоти:
- лікарські препарати;
- запашні есенції;
- фотоплівки;
- ацетатна пластмаса;
- пестициди;
- клей ПВА;
- ацетатне волокно, шовк;
- приправа до їжі;
- барвники;
- протрава під час фарбування тканин;
- консервування овочів.
VI. Підбиття підсумків уроку
1. Метод «Незакінчене речення»
- Сьогодні на уроці …
- Дізнався про …
- Зрозумів, що …
- Навчився …
- Вивчив
- Найбільші труднощі виникли …
- Раніше я не вмів, а тепер умію …
2. Оцінювання роботи учнів
Учитель. Нехай ваше життя не буде кислим, як оцтова кислота, і вас ніхто не «напоїть оцтом».
VII. Домашнє завдання
1. Опрацювати матеріал параграфа 33.
2. Виконати вправи 404, 406, с. 188.
3. Творче завдання. Складіть сенкан про оцтову кислоту.


про публікацію авторської розробки
Додати розробку
