Урок "Поняття про гальванічний елемент як хімічне джерело електричного струму"
Тема. Поняття про гальванічний елемент як хімічне джерело електричного струму
Мета уроку: формувати в учнів поняття про гальванічний елемент як хімічне джерело електричного струму; ознайомити з хімічними джерелами електричного струму; розвивати вміння стисло та грамотно висловлювати свої міркування та обґрунтовувати їхню правильність; формування таких якостей особистості, як відповідність, організованість, дисциплінованість, обов'язок.
Очікувані результати: учні мають уміти визначати хімічне джерело електричного струму; пояснювати принцип дії гальванічного елемента, оцінює негативний вплив на екологію відпрацьованих гальванічних елементів і дотримуватися правил їхньої утилізації.
Базові поняття й терміни: гальванічний елемент, джерела електричного струму.
Обладнання: інтерактивна дошка, мультимедійний проектор, ноутбук, мобільні телефони учнів, гальванічний елемент, фольга, вата.
Методи навчання: метод перевернутого класу, проблемне навчання, дослідницький метод, ілюстративно - наочний, пояснювально-евристичний, аналітичний, контролюючо - корегуючий.
Форми навчання: індивідуальні, групові, фронтальне опитування, робота біля дошки, евристична бесіда.
Тип уроку: комбінований.
Ключові компетентності: спілкування державною мовою, математична компетентність, основні компетентності у природничих науках і технологіях, інформаційно-цифрова компетентність, екологічна грамотність і здорове життя. Хід уроку
І. Організаційний етап. Позитивна установка на урок
Запрошую вас у «Чудовий світ хімії». Знання хімії необхідне кожному з нас, щоб не тільки задовольнити природну цікавість у розумінні наукової картини світу, але ще i тому, що як писав Ломоносов М.В.: «Вивчення хімії має двояку мету: одна - удосконалення природничих наук, інша - примноження життєвих благ.» Цей вислів, особливо в часи високих технологій, не потребує своєрідних обґрунтувань чи тлумачень, адже як сказав ще один вчений - хімік Зелінський М.Д.: «Я впевнений, що жоден із тих, хто цікавиться хімією, не пошкодує про те, що обере цю науку як свою спеціальність.» Дещо з хімічних понять вам відомо, але багато i невідомого. Тому пропоную вам провести урок у напрямку від відомого до невідомого.
ІІ. Актуалізація опорних знань
1.Бліц – опитування «ланцюжком». (Учні ставлять один одному запитання, заготовлені вдома)
2. Прийом «Міні-практикум»
а) Записати дисоціацію середніх солей:
Na2SO4↔
KNO3 ↔
Al2S3 ↔
Ca(NO3)2↔
б) Записати дисоціацію кислих і основних солей:
КНCO3↔
Na2HPO4↔
Mg(OH)Cl ↔
Ba(OH)NO3↔
в) Використовуючи, онлайновий сервіс LearningApps.org, виконати інтерактивну вправу «Пазл»: «Хімічний крос «Електроліти і неелектроліти»» - https://learningapps.org/display?v=p9kb7r7bk19.
г) Фронтальне опитування:
Що таке електролітична дисоціація?
Що таке електроліти?
Що таке неелектроліти?
Хто і коли заснував теорію електролітичної дисоціації?
ІІІ. Мотивація навчальної діяльності
Проблемне питання
Здатність добути вогонь вкрай важлива в умовах дикої природи, особливо, коли необхідно зігрітися або приготувати їжу взимку. Але трапляється таке, що сірники відсиріли, скінчилися, забуті, втрачені, як і запальничка, а газового пальника з собою немає. Як добути вогонь без сірників та запальнички в лісі?
Безперечно, в першу чергу згадується лупа, або просто зігнуте скло, або, навіть, при наявності сонця добути вогонь можна, використовуючи майже будь-яку поверхню, що відбиває. А якщо справа відбувається вночі? А якщо похмуро? Якщо сонце взагалі не може пробитися крізь лісові хащі? Отже, варто пошукати в кишенях!
Можливо, в одній кишені ви знайшли гальванічний елемент (пальчикову батарейку). Пів справи вже зроблено, тепер потрібно знайти в іншій кишені пластинку жувальної гумки, або шоколадку - тобто, будь-який предмет, в упаковці якого є фольга. В ідеалі потрібен двошаровий матеріал, де фольга служить верхнім шаром, а нижній шар паперовий. Але чиста фольга теж підійде, просто з нею доведеться трохи повозитися. Ще пригодиться ніж, але при необхідності фольгу можна охайно надірвати і без використання гострого леза. Отже, спершу з фольги виріжте досить широку смужку (приблизно 1,5 см шириною). Довжина повинна бути такою, щоб одним кінцем смужки можна було торкнутися плюсового кінця батарейки, а другим - мінусового. Тепер потрібно зробити центральну частину смужки тонкою, тобто створити там вузьку перемичку (шириною близько 2 мм). Ось майже і все.
Демонстрація. Як добути полум'я за допомогою фольги і гальванічного елемента.
ІV. Вивчення нового матеріалу
Сьогодні на уроці ми будемо вивчати гальванічний елемент як хімічне джерело електричного струму. Але вивчення матеріалу буде відбуватися за методом перевернутого класу. Ви вже отримали домашнє завдання розібрати відповідний параграф підручника, довідниках з фізики та хімії, знайти інформацію в мережі Інтернет. Тому на уроці ми більш активно засвоїмо тему.
Прийом «Виступ солістів» («Солісти» - учні, які отримали завдання наперед і підготували повідомлення):
«Хімічні джерела електричного струму»,
«Поняття про гальванічний елемент»,
«Історія гальванічного елемента»,
«Особливості утилізації гальванічних елементів»
V. Закріплення знань учнів
1. Евристична бесіда
1.Для чого потрібне джерело струму?
2. Які пристрої називають джерелами електричного струму?
3. Які процеси відбуваються в джерелах електричного струму?
4. З якими джерелами електричного струму ви ознайомились?
5. Хто перший створив гальванічний елемент?
6. Яке походження цієї назви?
2. Використовуючи, онлайновий сервіс LearningApps.org, виконати інтерактивну вправу «Вгадай слово»: «Хімічна розминка «Поняття про гальванічний елемент як хімічне джерело електричного струму»» - https://learningapps.org/display?v=pi5w0nvzt19.
VІ. Домашнє завдання, інструктаж щодо його виконання
Опрацювати відповідний параграф підручника, виконати завдання
(диференційовані)
VII. Підбиття підсумків уроку. Рефлексія. Оцінювання роботи учнів
Учні висловлюються одним реченням, обираючи початок фрази із екрана:
•Сьогодні я дізнався…
•Було цікаво…
•Було складно…
•Я зрозумів, що…
•Тепер я зможу…
•Я навчився…
•У мене вийшло …
•Я зміг…
Додаткова інформація до уроку
Джерела електричного струму
• Хімічні джерела електричного струму – пристрої, в яких розподіл зарядів відбувається за рахунок енергії, що виділяється внаслідок хімічних реакцій.
• До хімічних джерел струму належать гальванічні елементи й акумулятори.
Історія гальванічного елемента
•  Дружина Луіджі Гальвано захворіла. Лікарі порадили їй вживати суп з жаб′ячих лапок. Щоб зробити приємне дружині Гальвано власноруч готував страву і помітив, що торкаючись скалпелем жаб′ячих лапок, їх м′язи скорочувались. Гальвано помітив, що коли замінити скальпель дротами з міді та цинку, явище спостерігається чіткіше. Він назвав це «тваринною електрикою».
Дружина Луіджі Гальвано захворіла. Лікарі порадили їй вживати суп з жаб′ячих лапок. Щоб зробити приємне дружині Гальвано власноруч готував страву і помітив, що торкаючись скалпелем жаб′ячих лапок, їх м′язи скорочувались. Гальвано помітив, що коли замінити скальпель дротами з міді та цинку, явище спостерігається чіткіше. Він назвав це «тваринною електрикою».
• Алессандро Вольта зацікавився відкриттям Гальвано і продовжив досліди. Експерименти він проводив на собі: одну монету клав під язика, а іншу зверху та з′єднував їх дротом. Вольта відчував кислий смак , він знав що це смак електрики. Завершилися досліди у 1799 році створенням першого джерела неперервного електричного струму. Джерело складалося з мідних та цинкових кружків, які були розділені шматочками тканини, змочених водою або кислотою. Прилад був вперше презентований на засіданні Лондонського королівського товариства у 1800 році, та був названий «Вольтів стовп». Сам Вольта називав його гальванічним елементом на честь
Гальвані.
Гальванічний елемент
Якщо до гальванічного елемента за допомогою провідників приєднати електричну лампочку, то під дією електричного поля заряджені частинки у провіднику починають рухатися, виникає електричний струм, лампочка світиться.

• 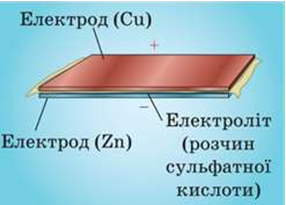 Будь-який гальванічний елемент складається з двох електродів та електроліту (речовина, що проводить струм).
Будь-який гальванічний елемент складається з двох електродів та електроліту (речовина, що проводить струм).
• Між електродами й електролітом відбуваються хімічні реакції, в результаті яких один із електродів набуває позитивного заряду, а другий — негативного заряду.
• Не треба з’єднувати полюси коротким провідником, тому що батарейка псується, навіть може вибухнути.
• Коли запас речовин, що беруть участь у реакціях, виснажується, гальванічний елемент припиняє роботу і його не можна використати вдруге.
Утилізація джерел струму
Викидаючи відпрацьовані гальванічні елементи у смітник, ми маємо знати такі факти: щодня в Україну імпортується 10-12 тонн батарейок на день. В користуванні українців біля мільярда батарейок, що містять 9 тонн ртуті. Відсутність системи збору батарейок призводить до значного забруднення навколишнього середовища та негативно впливає на стан здоров’я людей. Екологи підрахували: щорічно на звалища потрапляє 9 млн. 660 тис. 896 батарейок, які забруднюють 1,4 % території будь - якої області. Це територія проживання 9660896 їжаків та 19321792 кротів. А також 3864358,4 м3 забрудненої води.
Гальванічні елементи містять важкі метали: кадмій, свинець, літій та ртуть. Коли батарейка потрапляє на сміттєзвалище, її оболонка з часом руйнується і всі хімічні елементи потрапляють у навколишнє середовище. Цинк розчиняється в землі і забруднює ґрунтові води. Хлор – агресивна речовина, яка буде реагувати з іншими активними речовинами. Влітку батарейки разом із загальним сміттям тліють або горять, при цьому виділяються важкі метали і діоксини в атмосферне повітря. Діоксини вражають все живе навіть у малих концентраціях, при цьому збільшується сприйнятливість організму до інфекцій та онкологічних захворювань.
Одна пальчикова батарейка забруднює 20 м2 ґрунту глибиною 5 м, який на наступні 50 років стає непридатним для сільського господарства через високий вміст важких металів. Ця площа у лісовій зоні становить територію проживання двох дерев, двох кротів і одного їжака. Важкі метали просочуються у ґрунтові води, вода потрапляє у річку, а потім у наші будинки. Викинувши чотири батарейки, ви забрудните дві грядки з полуницею і дві грядки з картоплею. Одна батарейка забруднює 400 л води. Викинувши дві батарейки, ви забрудните дві ванни, вісім відер та два чайника води. З часом токсичні речовини, які виділяє гальванічний елемент, накопичуються в організмі людини. Хром та кадмій накопичуються у нирках, мідь – у шлунково-кишковому тракті, ртуть вражає центральну нервову систему і нирки. Потрапивши у воду, ртуть перетворюється у метил-ртуть, яка є токсичнішою за ртуть. Малі водні мікроорганізми поглинають метил-ртуть, а їх, в свою чергу, поїдають риби. Люди, які споживають таку рибу, можуть захворіти на хворобу Мінамата, головними ознаками якої є порушення зору та слуху, неврологічні розлади, зауважує еколог. Свинець накопичується в кістках у вигляді нерозчинної сполуки, переходить у кров і може викликати отруєння організму, спричинює захворювання мозку і нервові розлади. Кадмій блокує роботу ферментів, вражає печінку та здатний викликати ракові захворювання.
Щоб усього цього уникнути, достатньо викидати використані гальванічні елементи не у смітник, а у спеціальні пункти збору. Це дасть можливість вилучати з батарейок та повертати в обіг тисячі тонн різних металів, що набагато вигідніше, ніж добувати метали з руд. Вміст міді у рудах 0,5- 0,7 %, у батарейці вміст металів (цинку, заліза, мангану) становить 23-27 %.У світі є три заводи з переробки батарейок: у Німеччині, Франції та Україні — у Львові.


про публікацію авторської розробки
Додати розробку
