Урок "РІСТ ТА РОЗВИТОК КЛІТИН ТА ФАКТОРИ, ЯКІ НА НЬОГО ВПЛИВАЮТЬ."
РІСТ ТА РОЗВИТОК КЛІТИН ТА ФАКТОРИ, ЯКІ НА НЬОГО
ВПЛИВАЮТЬ. СТАРІНЯ ТА СМЕРТЬ КЛІТИН. ПРИЧИНИ ПОРУШЕННЯ КЛІТИННОГО ЦИКЛУ ТА ЇХНІ НАСЛІДКИ
Організм людини, за оцінками науковців, складається зі 100000 (1014) млрд клітин. І більшість із цієї кількості клітин тіла замінюються новими кожні 7—10 років. Процес оновлення клітин відбувається по-різному в різних частинах тіла, але повне омолодження «з ніг до голови» триває близько 10 років. Завдяки чому відбувається «омолодження» організму людини? Яке значення репродукції клітин?
Термін «репродукція» є загальнобіологічним поняттям, що характеризує відтворення на різних рівнях. Так, репродукція ДНК відбувається на молекулярному рівні, репродукція вірусів — на субклітинному, репродукція клітин — на клітинному, репродукція організмів — на організмовому.
РЕПРОДУКЦІЯ КЛІТИН — відтворення нових клітин шляхом поділу вихідної клітини. Відтворення клітин — це не просто виникнення двох клітин з однієї, а утворення двох клітин, які містять однакову спадкову інформацію, та ще й подібну до інформації батьківської вихідної клітини.
За здатністю до репродукції клітини тваринного організму поділяють на чотири категорії:
1) високоспеціалізовані клітини, що не діляться (нейрони, клітини скелетних м'язів, кардіоміоцити);
2) поновлювані клітини (наприклад, ентероцити — клітини епітелію слизової оболонки кишечнику, що живуть 5—10 днів і оновлюються за допомогою
камбіальних клітин);
3) стовбурові клітини (зберігають здатність до поділу протягом всього життя організму і замінюють клітини, які гинуть);
4) клітини, які зазвичай не розмножуються, але за певних умов можуть дедиференціюватися і вступати у мітоз (наприклад, гепатоцити, які набувають здатності до поділу за репаративної регенерації).
З репродукцією клітин пов'язані ріст організмів, фізіологічна й репаративна регенерація, нестатеве розмноження. Завдяки клітинному поділу забезпечується безперервність існування наступних поколінь клітин і цілісних організмів, оскільки індивідуальне життя більшості клітин обмежене порівняно коротким терміном. Репродукція клітин у багатоклітинних організмів різко збільшує їх адаптивні можливості й створює необхідні передумови для індивідуального та історичного розвитку. Основним типами репродукції клітин є мітоз та амітоз.
Отже, репродукція клітин забезпечує безперервність існування наступних поколінь клітин і цілих організмів.
Чим мітоз відрізняється від амітозу?
Репродукція клітин в організмі людини може відбуватися шляхом мітозу (непрямий поділ) і амітозу (прямий поділ).
МІТОЗ (від грец. mitos — нитка) — це поділ еукаріотичних клітин, внаслідок якого утворюються 2 дочірні клітини з таким самим набором хромосом, що й у материнської клітини. Мітоз у клітинному циклі відбувається після інтерфази, під час якої клітина росте, синтезує органічні сполуки, подвоює спадкову інформацію, запасає енергію та готується до мітозу. Мітоз умовно поділяють на 4 фази: профазу, метафазу, анафазу і телофазу.

Клітинний цикл
Профаза — фаза конденсації хромосом. Основними процесами профази є:
1) конденсація (ущільнення) двохроматидних хромосом;
2) розходження центріолей до полюсів;
3) зникнення ядерця; 4) розпад ядерної оболонки;
5) формування веретена поділу.
Метафаза — фаза розташування хромосом на екваторі клітини. Спостерігається прикріплення коротких ниток веретена поділу до центромер і розташування двохроматидних хромосом на екваторі клітини в один ряд.
Анафаза — фаза розходження хромосом. В анафазі відбуваються скорочення ниток веретена поділу та розходження однохроматидних хромосом до полюсів.
Телофаза — фаза деконденсації хромосом. Це свого роду «профаза навпаки», в якій відбуваються:
1) деконденсація однохроматидних хромосом;
2) розташування центріолей біля ядра;
3) формування ядерець; 4)утворення ядерної оболонки; 5)руйнування веретена поділу.
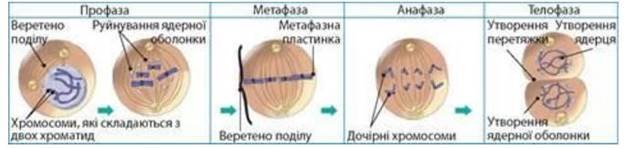
Фази мітозу: 1 — профаза; 2 — метафаза; 3 — анафаза; 4 — телофаза Біологічна роль мітозу полягає в точному відтворенні клітин, забезпеченні рівномірного розподілу хромосом материнської клітини між двома дочірніми клітинами і підтриманні сталості каріотипу. Мітоз є основою росту, регенерації й нестатевого розмноження організмів.
Амітоз — це прямий поділ клітин, що відбувається шляхом поділу ядра, без реплікації ДНК й конденсації хромосом та без утворення веретена поділу. Він властивий високоспеціалізованим клітинам (нейронам, хондроцитам, лейкоцитам крові, клітинам ендотелію кровоносних судин), клітинам пухлин, старіючим клітинам або клітинам, приреченим на загибель (наприклад, клітинам зародкових оболонок ссавців). Амітоз може супроводжуватись поділом клітини з утворенням двох клітин з приблизно однаковою спадковою інформацією, а може обмежуватись поділом ядра без поділу цитоплазми, що приводить до утворення дво- та багатоядерних клітин. Амітоз порівняно з мітозом трапляється рідше і відіграє другорядну роль у клітинному поділі організмів, оскільки клітини після амітозу зберігають функціональну активність, поділятися уже не можуть. Біологічна роль амітозу— це швидке поповнення клітинних популяцій у процесі репаративної регенерації.
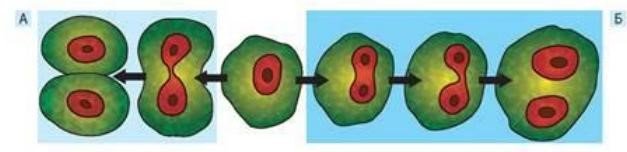
Схема амітозу з утворенням двох клітин (А) і двоядерної клітини (Б)
Отже, мітоз є основним способом репродукції еукаріотичних клітин тіла, що визначає ріст, фізіологічну регенерацію та нестатеве розмноження еукаріотів; амітоз — трапляється рідше й забезпечує репаративну регенерацію. Які чинники впливають на мітоз?
На мітоз впливають зовнішні й внутрішні, внутрішньоклітинні й позаклітинні чинники. Пусковим чинником для мітотичного поділу клітин є співвідношення об'ємів ядра і цитоплазми. Велику роль відіграє також синтез ДНК і міжклітинні взаємодії.
До важливих зовнішніх чинників регуляції мітозу відносять добові ритми. Так, у тварин, яким притаманний нічний спосіб життя, максимум мітозу припадає на день, а у денних тварин й людини — на ніч. Гамма-промені впливають на мітоз, спричиняючи в клітинах глибокі порушення. Мітотичні хромосоми змінюють форму, розриваються, окремі ділянки хромосом можуть зникати. Рентгенівські промені призводять до тимчасового припинення мітозу, але якщо клітини не загинули від опромінення, то мітотичний поділ поступово відновлюється. Мітоз гальмується високою температурою, високими дозами йонізуючої радіації, дією рослинних отрут (наприклад, алкалоїд колхіцин, що виділений з бульбоцибулин пізньоцвіту осіннього, має здатність пригнічувати утворення мітотичного веретена).
Внутрішніми чинниками регуляції мітозу є впливи системи нейрогуморальної регуляції, зумовлені дією гормонів надниркових залоз, гіпофіза, щитоподібної і статевих залоз. Так, для активації клітинного циклу потрібний прогестерон, що є чинником росту. Мітоз жорстко регулюється як самою клітиною (наприклад, зміною синтезу циклінів й циклін-залежних ферментів), так і її оточенням (наприклад, відсутністю контактів з подібними клітинами або впливом гормонів). Ще одним чинником регуляції є послідовність здійснення стадій мітозу. Крім того, встановлено, що після певної кількості поділів вмикається генетична програма, що не допускає розмноження нащадків цієї клітини.
Отже, на початок, перебіг і завершення мітозу впливають різні зовнішні та внутрішні чинники.
У світлі сучасних гіпотез старіння організмів, яких налічують понад 200, науковці виокремлюють найчастіше 9 ключових ознак: геномну нестабільність, теломерні скорочення, мітохондріальну дисфункцію, епігенетичні зміни, втрату білкового гомеостазу, нестачу й порушення надходження поживних речовин — нутрієнтів, виснаження стовбурових клітин, зміни міжклітинної комунікації та клітинне старіння. А що таке старіння клітин (англійською мовою — cellular senescence)? Які ознаки старіння клітин?
Уперше клітинне старіння описав в 1965 р. Л. Гейфлік (нар. 1928). Було встановлено, що нормальні клітини втрачають здатність до репродукції після певної кількості поділів. Подальші дослідження у цьому напрямі виявили, що в процесі старіння клітин змінюється не лише їхня здатність до поділу, а й структура та функціонування усіх її складників.
Поверхневий апарат. У клітинній мембрані спостерігаються ущільнення і потовщення, зменшення інтенсивності транспортування речовин, кількості міжклітинних контактів
Цитоплазма. Змінюється щільність гіалоплазми, що позначається на інтенсивності біохімічних реакцій й біофізичних процесів. Однією зі сталих ознак старіння клітин є морфологічні й функціональні зміни мітохондрій. Коли старіюча клітина виявляє значне ушкодження своєї ДНК, вона продукує сигнали, що спонукають мітохондрії до утворення вільних радикалів, які «змушують» клітину гинути або припинити процес поділу. Ще однією з вікових змін клітини є збільшення кількості лізосом, їх руйнування й вивільнення ферментів, що спричиняє пошкодження органел і мембрани. Ознаками клітинного старіння є й накопичення в залишкових тільцях пігменту старіння (ліпофусцину), зміна відповіді на дію чинників росту.
Генетичний апарат. З віком клітин змінюється структура хроматину, зменшується транскрипційна активність еухроматину та швидкість реплікації ДНК, втрачає ефективність система репарації ДНК. Потужними активаторами старіння є двониткові розриви ДНК, що виникають внаслідок дії йонізуючої радіації (альфа-, бета-, гамма- й рентген-промені).
У клітинах з віком проявляються не лише процеси старіння, а й розвиваються процеси антистаріння. Їх перебіг забезпечують природні генотипні (наприклад, системи репарації ДНК, система антиоксидантів, система мікросомального окиснення чужорідних речовин) та фенотипні (наприклад, підвищення інтенсивності гліколізу, поява багатоядерності й поліплоїдії у клітинах, збільшення об'єму мітохондрій за умов зниження їхнього числа, гіпертрофія апарату Гольджі) механізми.
Таким чином, навіть цей далеко не повний перелік вікових змін указує на те, що старіння клітин є дуже складним процесом, що охоплює усі її складові. Попри багаторічні ґрунтовні дослідження ще не з'ясовано причини старіння. Існує ряд гіпотез клітинного старіння, серед яких: молекулярно-генетичні гіпотези (вікові зміни є спадково запрограмованими), теломерна гіпотеза (скорочення теломер після кожного подвоєння хромосом і втрата здатності до поділу), гіпотеза вільних радикалів (причиною клітинного старіння є шкідливі впливи вільних радикалів), гіпотеза виснаження стовбурових клітин (уповільнюють свій поділ і не так часто перетворюються на соматичні клітини), гіпотеза порушення білкового гомеостазу (накопичення пошкоджених й змінених білків) та ін.
Отже, СТАРІННЯ КЛІТИН — це природний закономірний і незворотний процес вікових змін будови й функцій клітин, що спричиняє зниження їхніх адаптивних можливостей. Чому клітини гинуть?
Смерть клітин може наставати як у нормі, так і в разі патології. Гинуть клітини в ембріональному розвитку (під час формування тканин і органів) й у дорослому організмі внаслідок старіння, в разі втрати функцій і під дією шкідливих чинників. Розрізняють два види загибелі клітин: апоптоз і некроз
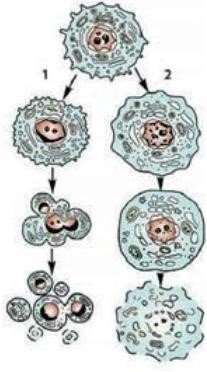 Загибель клітин: 1 — апоптоз; 2 — некроз Апоптоз — генетично запрограмована загибель клітини, в якій провідну роль виконують внутрішньоклітинні механізми. Цей вид загибелі клітин є енергетично залежним й регульованим процесом. У разі апоптозу ядро й цитоплазма діляться на кілька частин, не відбувається руйнування клітинної мембрани, вміст клітин не потрапляє в позаклітинне середовище й не спричиняє запалення. Особливе значення апоптоз має в ембріональному розвитку, коли відбувається зміна ембріональних зачатків. У зрілому організмі апоптоз забезпечує клітинний гомеостаз — відносну сталість складу тканин і органів, а в разі старіння чи патології регулює кількість клітин в органах відповідно до зниження функціональних можливостей організму. Апоптоз також відіграє важливу роль в разі зараження інфекційними агентами, зокрема вірусними, у ліквідації пухлинних клітин.
Загибель клітин: 1 — апоптоз; 2 — некроз Апоптоз — генетично запрограмована загибель клітини, в якій провідну роль виконують внутрішньоклітинні механізми. Цей вид загибелі клітин є енергетично залежним й регульованим процесом. У разі апоптозу ядро й цитоплазма діляться на кілька частин, не відбувається руйнування клітинної мембрани, вміст клітин не потрапляє в позаклітинне середовище й не спричиняє запалення. Особливе значення апоптоз має в ембріональному розвитку, коли відбувається зміна ембріональних зачатків. У зрілому організмі апоптоз забезпечує клітинний гомеостаз — відносну сталість складу тканин і органів, а в разі старіння чи патології регулює кількість клітин в органах відповідно до зниження функціональних можливостей організму. Апоптоз також відіграє важливу роль в разі зараження інфекційними агентами, зокрема вірусними, у ліквідації пухлинних клітин.
Некроз — це загибель клітин у результаті незворотного пошкодження під дією шкідливих чинників. До них належать перегрівання, переохолодження, нестача кисню, порушення кровопостачання, дія отрут, хімічних препаратів, механічні травми. Цей процес генетично не запрограмований, є пасивним і не потребує затрат енергії. У разі некрозу відбуваються хаотичне руйнування клітинних мембран й органел, вивільнення ферментів й розщеплення вмісту. Некроз клітин супроводжується запаленням, що спричинене продуктами розпаду клітин. Реакція запалення — це основна фізіологічна відмінність некрозу від апоптозу.
Отже, загибель клітин може бути природним або патологічним процесом, що відбувається під дією генів або шкідливих чинників середовища. Які причини і наслідки порушень клітинного циклу?
Клітинний цикл — це період існування клітини від одного поділу до іншого). Регуляція клітинного циклу здійснюється гормонами, чинниками росту, білкамициклінами і циклін-залежними ферментами, без яких неможливий перехід до поділу.
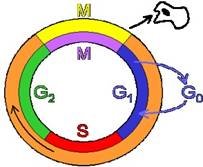
Етапи й фази клітинного циклу: М — мітоз; І — інтерфази (G1 — пресинтетична фаза; S — синтетична фаза; G2 — постсинтетична фаза; G0 — фаза спокою)
Наслідками порушення клітинного циклу є втрата здатності певних клітин до поділу, старіння клітин, загибель клітин, виникнення пухлин.
Причинами порушень клітинного циклу можуть бути нестача поживних речовин, зміни впливів чинників росту, пошкодження ДНК, порушення подвоєння молекул ДНК і розходження хроматид, вірусні гени, зовнішні шкідливі впливи тощо.
Основними етапами клітинного циклу є інтерфаза та мітоз. Однак не всі клітини проходять ці етапи. Так, нестача поживних речовин або чинників росту змушує клітину переходити у фазу спокою (G0-фаза), упродовж якої поділу не відбувається.
Функцію регуляції поділу клітини або її виходу з поділу здійснюють гени, що відповідають за синтез білків, які індукують поділ і стримують його. На рівні точки R (при переході з G1 до S-періоду) вступає в дію стримуючий фактор, який обмежує можливість нерегульованого розмноження клітин. Якщо клітина не досягає точки R, вона тимчасово припинили ділитися, входять у фазу репродуктивного спокою, так звану (G0) фазу. Різні клітини можуть перебувати в репродуктивному спокої і дальше доля їх буває різною. У той самий час клітини, що назавжди припинили поділ через вік або через накопичення пошкоджень у ДНК, називаються старими. Стовбурові клітини різних тканин (наприклад, кровотворні), на довгий час виходять з циклу, хоч зберігають здатність до поділу. Деякі клітини у дорослому організмі, такі як паренхімальні клітини печінки чи нирок, входять у G0-фазу майже назавжди. Вони можуть почати поділ знову тільки за дуже специфічних обставин (наприклад, після видалення частини печінки); інші типи клітин, такі як клітини епітелію, продовжують ділитися протягом усього життя організму. Високодиференційовані клітини, які незворотно втрачають здатність до поділу (наприклад, нервові клітини), хоч останнім часом з’являються дані про можливість поділу нейронів. Залежно від причин зупинки поділу клітини G0-періоду можуть здійснювати репарацію пошкодженої ДНК, чи вижити в умовах недостатності поживних речовин або факторів росту. Частина клітин, яка продовжує ділитися, переходить у синтетичний період (S).
Молекулярні процеси, що відбуваються протягом клітинного циклу, є послідовними. Існує два ключові класи регуляторних молекул, що спрямовують клітинний цикл: це цикліни і циклін-залежні кінази. Завдяки цьому направляється прехід клітини до наступної фази клітинного циклу. Циклін-залежна кіназа також забезпечує деградацію білків — інгібіторів переходу до S-фази. Активований комплекс циклін — циклін-залежна кіназа фосфорилює білки, з яких складається комплекс G1-фази і починається процес реплікації. Ті гени, що кодують цикліни і циклін-залежні кінази, є консервативними у всіх еукаріотів.
Клітини багатоклітинних еукаріот, коли не діляться, звичайно знаходяться у спокої G0, у яку потрапили з фази G1, і можуть залишатися у спокої досить довгий час, навіть невизначено довгий (як здебільшого це відбувається з нейронами). Це досить звична картина для клітин, що остаточно дифференційовані.
Структура інтерфазного ядра
Кожний тип клітин має постійне ядерно-цитоплазматичне співвідношення. У разі його порушення клітина або поділяється, або може загинути. Ядро в клітині буває в двох станах — мітотичному (під час поділу) та інтерфазному (між поділами). Ядро, яке не поділяється (інтерфазне ядро), складається з ядерної оболонки, ядерця, каріоплазми і хроматину. Хроматин — інтерфазна форма існування хромосом. Хімічний склад хроматину і хромосом однаковий — комплекс ДНК і білків. Ядерця на початку поділу клітини вони зникають, а в кінці його утворюються знову на ядерцевих організаторах хромосом.
Утворення клітин
Усі нові клітини виникають у результаті поділу вже існуючих. Багатоклітинний організм починає свій розвиток найчастіше з однієї-єдиної клітини. Потім шляхом неодноразового поділу утворюється багато клітин, які й становлять організм.
Обов’язковою умовою існування біологічних систем є їх репродукція – відтворення. Відтворення на клітинному рівні здійснюється шляхом поділу клітин. Завдяки клітинному поділу забезпечується безперервність існування наступних поколінь клітин і цілісних організмів, оскільки індивідуальне життя більшості клітин обмежене порівняно коротким терміном. Репродукція клітин у багатоклітинних організмів різко збільшує їх адаптивні можливості і створює необхідні передумови для прогресивної диференціації і спеціалізації тканинних систем в онто- і філогенезі.
Поділ клітин завжди починається з поділу ядра, за яким відбувається (але може не бути) поділ клітинного тіла – цитотомія. Більшість клітин потенційно здатні до поділу, деякі клітини можуть ділитися лише за певних умов. Біологічна роль клітинного поділу полягає у збереженні чи відтворенні клітинної популяції. Популяція клітин (від лат. рopulus – населення) – це сукупність клітин певного виду тканин, яка підтримується на визначеному, приблизно постійному кількісному рівні, необхідному для виконування тканиною функцій. У багатьох тканинах, в яких життя клітин обмежується відносно малими часовими межами, клітинні популяції підтримуються шляхом поділу клітин. Існує зворотна залежність між ступенями спеціалізації клітин і здатністю до мітозу. За здатністю до мітозу клітини тваринного організму поділяють на чотири категорії.
До першої категорії відносять високоспеціалізовані клітини. У багатоклітинних організмах є клітини, які не можуть ділитися через їх високу спеціалізацію. Наприклад, нервові і м'язові клітини після завершення ембріонального періоду розвитку організму припиняють поділ і функціонують протягом усього подальшого життя організму.
Другу категорію клітин складають поновлювані клітини, наприклад, клітини епітелію слизової оболонки кишечнику (ентероцити) та епідермісу. Вони в диференційованому, функціональному стані, після виконання своєї специфічної функції, довго не живуть (5-10 днів) і обновлюються. Таку популяцію клітин називають поновлювальною, їх замінюють інші, утворені шляхом поділу.
Стовбурові клітини відносять до третьої категорії. Стовбурові клітини — недиференційовані клітини, саме з них на початковій стадії складається ембріон, згодом здатні перетворюватися на клітини багатьох тканин. Вони зберігають здатність до поділу протягом всього життя організму і замінюють клітини, які гинуть. Серед стовбурових клітин розрізняють плюрипотентні (від лат. pluralis – множинний), здатні спеціалізуватися в різних, до певної міри, напрямках. Наприклад, стовбурові клітини кісткового мозку можуть давати як еритроцити, так і певні види лейкоцитів. Уніпотентні (від лат. unos – один) стовбурові клітини спеціалізуються у визначеному напрямку. Клітини, які служать резервом поповнення популяцій, здійснюють клітинний цикл, проте можуть виходити з нього в постмітотичному періоді (G1 – періоді) і спеціалізуватися. Це відкриває великі можливості в медицині.
Четвертий тип – це клітини, які звичайно не розмножуються, але за певних умов можуть дедиференціюватися і вступати у мітоз. Прикладом таких клітин є гепатоцити (печінкові клітини) та клітини ендокринних залоз. Вони набувають здатності до поділу при репаративній регенерації, після пошкодження частини органа.
У рослин постійний поділ клітин верхівкової і бічної меристем забезпечує тривалий ріст пагонів і коренів у довжину і товщину. Новоутворені клітини набувають здатності ділитися після певного періоду росту. Крім того, поділу передує подвоєння клітинних структур: хлоропластів, мітохондрій, центріолей та інших органел.
Отже клітинний цикл — це серія подій в еукаріотичній клітині між одним поділом клітини і наступним. Таким чином, це процес, завдяки якому одна клітина (така як запліднена яйцеклітина) розвивається у сформований організм, і процес, завдяки якому відновлюються волосся, шкіра, клітини крові, а також деякі внутрішні органи. Спеціалізовані форми клітинного поділу відповідні за клітинну диференціацію протягом ембріогенезу і морфогенезу, а також за підтримку стовбурових клітин протягом життя дорослого організму.
Механізми загибелі клітин
У процесі життєдіяльності, після досягнення певного віку клітини старіють. Механізми клітинного старіння з’ясовувалися багатьма вченими, але і досих пір залишаються остаточно нез’ясованими. Згідно з однією гіпотезою, старіння є результатом катастрофічного нагромадження помилок біосинтетичних механізмів клітини, згідно з іншою — воно є наслідком обмеження можливостей росту клітин. Вважають, що старіння клітин є механізмом стабілізації кількості клітин у дорослому організмі.
Ще у 1881 році класик цитології Август Вейсман постулював: старіння організму відбувається тому, що в соматичних клітин «здатність до росту шляхом поділу не вічна, а обмежена».
Іншими словами, врешті-решт клітини зношуються та більше не можуть самопоновлюватися, що призводить до смерті. Виняток Вейсман робив лише для статевих клітин, або так званих клітин зародкової плазми, яка, за його уявленнями, не старіє.
Алексис Каррель у 1912 році розпочав експерименти вирощування тканини в культурі, і свої (за які отримав Нобелівську премію): він брав шматочок тканини курячого серця, поміщав його на скляну чашку в поживне середовище з ембріонального екстракту та плазми, а потім інкубував у термостаті. Виявилося, що такі пересіви можна робити скільки завгодно, і при цьому фібробласти не втрачають здатності ділитися навіть через багато років після того, як закінчиться термін життя цілого організму. Але це скоріше свідчило, що в поживному середовищі з ембріонального екстракту містяться стовбурові клітини, а ніж те, що клітини мають необмежений ріст.
У 1961 р. Леонард Хейфлік проводив експерименти з фібробластами з людських ембріонів. Нормальні соматичні клітини, внесені в поживне середовище суміші низькомолекулярних речовин і бичачої сироватки та інкубовані в термостаті, через кілька годин утворювали моношар, а через день починали ділитися. Поділ припинявся, коли на дні посудини вичерпувався вільний простір, і клітини починали контактувати одна з одною. Та у цих експериментах зовсім несподівано виявилося, що нормальні фібробласти не можуть ділитися скільки завгодно довго. Численні перепровірки показали, що загибель фібробластів не випадковість, а повторювана закономірність: поділ припинявся приблизно після 50 пересівів, тобто клітинних поділів.
За цих умов життєвий цикл клітинної популяції розподілявся на три фази. Третя фаза знаменувалася тим, що у клітин сповільнювалася швидкість поділу, і вони врешті-решт гинули.
Звідси випливав висновок, лінія соматичних клітин, що діляться, зовсім не безсмертна; старіння – це властивість самих клітин, причому воно навіть запрограмоване в геномі клітин, оскільки настає після певної кількості поділів. Ця критична кількість поділів отримала назву ліміту Хейфліка.
Додатковим аргументом на користь постулатів Хейфліка вважають встановлену багатьма дослідниками залежність кількості клітинних поділів від віку донора: якщо отримували фібробласти від ембріона людини, то кількість поділів становила 50±10 разів, фібробласти, отримані від людини віком до 20 років, діляться в культурі 30±10 разів, а фібробласти, отримані від людини-донора, старшого, ніж 20 років, діляться 20±10 разів. Отже, чим старший донор, тим менша кількість клітинних поділів.Імовірно, in vivo у клітинах теж функціонує «лічильник», що фіксує кількість поділів. При перенесенні клітин у систему in vitro він продовжує відлік, а не починає заново.
З’ясовано, що зі збільшенням віку людини-донора на один рік кількість можливих поділів фібробластів у культурі зменшується в середньому на 0,2. Звідси випливає цікавий висновок: за 100 років життя людини реплікативний потенціал фібробластів знижується всього лише на 20 поділів. А весь цей потенціал вичерпається (при збереженні таких темпів) лише за 250 років. Це могло б вказувати на максимально можливу тривалість життя людини. Однак дуже сумнівно, що за 50-75 років звичного життя відповідні клітини діляться всього лише 10-15 разів. Як би там не було, викладені факти свідчать про те, що клітини «запам’ятовують» кількість минулих поділів.
Виявилося, що «пам’ять» про це зберігається навіть у випадку глибокого заморожування клітин на тривалий термін. Після розморожування клітини відновлюють свій поділ і діляться рівно стільки, скільки їм залишалось ділитися до заморожування.
Ще одним важливим аргументом на користь постулатів Хейфліка вважається корелятивна залежність між видовою тривалістю життя тварини чи людини та кількістю поділів її клітин у культурі.
П’ятдесят поділів – це видова характеристика ліміту Хейфліка лише для людини; для інших організмів він може бути досить різноманітним залежно від видової тривалості життя.
Відкриття обмеженої здатності диплоїдних клітин до проліферації дозволило Л. Хейфліку в 1975 році, а потім й іншим авторам запропонувати гіпотезу, згідно з якою, старіння в культурі має у своїй основі той же механізм, що й природне старіння та складає його цитологічну основу.
Клітинам, які діляться в організмі людини та тварин, справді притаманний певний генетично детермінований ліміт поділів, при наближенні до якого у клітинах настають глибокі зміни, що викликають зрештою припинення поділів і загибель клітин. Тому питання про механізм старіння переводиться з організмового рівня на клітинний.
Тривалість життя клітин у різних тканинах дорослого організму людини неоднакова. Клітини деяких тканин живуть дуже коротко — від декількох хвилин (лейкоцити) до декількох діб (клітини кишкового епітелію), чи багатьох років (кардіоміоцити і нейрони). У фізіологічних умовах старіння клітин закінчується програмованою смертю — апоптозом.
Клітини, як і все живе, гинуть. Смерть клітин може наступати як у нормі, так і при патології. Гинуть клітини вже під час ембріонального розвитку при формуванні тканин і органів. У ранньому онтогенезі наступає масова загибель певних груп клітин, які не досягли стану остаточної (термінальної) диференціації, наприклад, нейробласти. У дорослому організмі смерть клітин наступає: 1) внаслідок старіння, 2) при втраті функцій і 3) під впливом шкідливих факторів (некроз). Гинуть клітини, які виконали свою функцію.
До механізмів загибелі клітин належать апоптоз, некроз, автофагія, мітотична катастрофа, клітинне старіння, а також фагоцитоз, унаслідок появи на мембрані клітини «сигналів загибелі».
Апоптоз (від грец. ароріозіз — опадання листя) — це явище запрограмованої (фізіологічної) клітинної смерті, це активний, генетично контрольований процес загибелі клітин, який регулюється внутрішньо клітин-ною програмою, а запускається зовнішніми факторами. Апоптоз називається “смертю клітини в результаті самознищення”. Особливістю апоптозу є те, що він наступає в окремих клітинах або в їх групах, розділених значними угрупуваннями життєздатних клітин. Апоптоз спостерігається в різних клітинах людини і тварин в нормі, при патології, як у дорослих особин, так і під час ембріонального розвитку, супроводжується набором характерних цитологічних ознак, так званих маркерів апоптозу, і молекулярних процесів, які мають відмінності в одноклітинних і багатоклітинних організмів.
Апоптоз — форма загибелі клітини, яка проявляється зменшенням її розміру, конденсації і фрагментації хроматину, ущільненням зовнішньої і цитоплазматичної мембран без виходу вмісту клітини у навколишнє середовище.
Роком визнання апоптозу, як фізіологічного явища, вважається 1972 р., коли англійські дослідники Кер, Вілліс і К’юрі надали переконливі морфологічні докази існування цього процесу.
У численних експериментах учені довели, що запрограмована загибель є обов'язковою і невід'ємною властивістю будь-якої клітини багатоклітинних організмів. Щодня приблизно 50% клітин організму піддаються апоптозу, а їхнє місце займають нові.
Сьогодні стало очевидним, що в нормальних клітинах організму закладена чітка інформація про природну тривалість життя. Існують клітини-довгожителі, які, виникнувши на перших етапах поділу зародка, живуть практично до кінця життя організму та виконують певну, специфічну функцію (клітини серцевого м’яза, кришталика ока, нейрони). Однак під час ембріонального періоду багато клітин виникає для того, щоб виконати певне завдання та зникнути. Наочним прикладом у цьому випадку можуть стати клітини тимчасових, органів тварин, що розвиваються із метаморфозом. Зокрема, пуголовок під час переходу до дорослого стану жаби втрачає зовнішні зябра та хвіст; у метелика на стадії лялечки відбувається апоптоз (практично в 90% клітин гусені), замість них виникають нові тканини та органи. Вважають, що в організмі функціонують особливі гени, які в нормі контролюють зниження функцій і загибель клітин, що відбувається масово у процесі розвитку зародка. Доля цих клітин, на думку Хейфліка, визначається «годинником смерті», який діє досить точно.
Зміни клітин при апоптозі. На початковій стадії в клітині відбувається синтез ферментів, необхідних для забезпечення її загибелі. Найбільш раннім проявом апоптозу є втрата міжклітинних з’єднань. Після цього під впливом активованої ендонуклеази наступає мікрофрагментація хроматину та ядра. Під час апоптозу в першу чергу страждає клітинне ядро. В ядрі закладена спеціальна програма, запустивши яку, ядро знищує себе та клітину в цілому. Хроматин конденсується по периферії, під ядерною оболонкою, утворюючи чітко окреслені щільні маси різної форми та розмірів. Ядро може розриватися на два або кілька фрагментів.
Механізм конденсації хроматину вивчений досить добре. Він зумовлений розщепленням ядерної ДНК у ділянках зв’язування окремих нуклеосом, що призводить до утворення великої кількості фрагментів ДНК. Фрагментація ДНК у нуклеосомах відбувається за дії кальцій-магнійзалежної ендонуклеази.
Деструкція ДНК відбувається в кілька етапів. Спочатку з’являються фрагменти довжиною 700, 200-250, 50-70 тис. пар основ, пізніше – меншого розміру 30-50 тис. На цій стадії відбувається конденсація хроматину та інвагінація ядерної мембрани. Далі спостерігається міжнуклеосомна деградація ДНК. Під час цього утворюються фрагменти величиною 180-190 пар основ, що відповідає довжині нитки ДНК у межах однієї нуклеосоми. Цей тип деградації завершується, як правило, впродовж доби.
Трапляються виняткові випадки, коли процес апоптозу обмежується утворенням великорозмірних фрагментів ДНК.
Деградація хроматину під час апоптозу – активний процес, який залежить від температури, джерел енергії, синтезу РНК і білка. Різні етапи деградації каталізуються різними типами ендонуклеаз, відмінними за субстратною специфічністю та умовами прояву активності.
Далі цитоплазма конденсується, ущільнюється плазмалема без виходу внутрішньоклітинного вмісту в позаклітинне середовище, мембранні органели спочатку розширяються, а відтак розпадаються з утворенням кластерів. На поверхні клітин утворюються здуття, зменшується об’єм клітини, клітина фрагментується на мембранні везикули з внутрішнім вмістом. Під кінець апоптозу за участю актинових мікрофіламентів відшнуровуються ділянки цитоплазми і фрагменти ядра, і таким чином утворюються апоптозні тільця різних розмірів, які руйнуються остаточно: одні можуть поглинатися сусідніми клітинами, інші — захоплюються фагоцитами і швидко лізуються ферментами лізосом.
Апоптозний процес триває досить коротко — від декількох хвилин до декількох годин (у середньому від 1 до 3 годин). G0-латентний період, який передує самому процесові апоптозу, продовжується значно довше — до 12 годин. Але не всі клітини, в яких почався латентний період, вступають в апоптоз.
Механізми запуску і розгортання процесів апоптозу. Запрограмована смерть клітин можливо індукується нагромадженням генетичних помилок або зниженням чутливості клітин до ростових сигналів. На початковому етапі (G0латентному періоді) синтезуються ферменти, необхідні для здійснення загибелі клітин. Але не всі клітини з активованими ферментами гинуть, частина з них виживає завдяки активації генів-рятувальників Дальше процес апоптозу розгортається під впливом сигналів, які передаються до ядра - активацією летальних, або “кілерних” генів і шляхом синтезу апоптоз-специфічних білків відбувається апоптоз.
У процесі розвитку апоптозу виділяють три стадії:
а) індукторну – це прийом сигналу-провісника загибелі у вигляді інформації,
що надходить у клітину зовні або виникає всередині клітини;
б) ефекторну, коли сигнал сприймається рецептором і аналізується, а потім поступово передається молекулам-посередникам (месенджерам) і зрештою
досягає ядра;
в) деградації – запуск програми клітинного самогубства шляхом активації
летальних генів.
Якщо дві останні стадії універсальні для всіх різновидів апоптозу, то перша проявляється по-різному залежно від типу клітин та індукторних факторів. Цю різноманітність можна згрупувати так: а) коли програма загибелі запускається зовнішніми факторами; б) коли програма вже існує у клітині та реалізується за відсутності захисних факторів.
Залежно від природи фактору дії, який ініціює розвиток апоптозу, основні механізми його запуску можна умовно поділити на три групи: 1) мембранні (рецепторні), 2) мітохондріальні, 3) ядерні.
Мембранні, або рецепторні,механізми здійснюють передачу цитотоксинного сигналу через спеціальні рецептори – трансмембранні білки. Запуск цього варіанту апоптозу може бути пов’язаний не лише з плазмалемою, але і з внутрішньоклітинними мембранами, зокрема мембранами ЕПС.
Мембранні механізми апоптозу мають найбільше значення при видаленні клітин під час імунної відповіді імуноцитів, які виконали свою функцію, а також при знищенні трансформованих клітин.
Останніми роками особлива увага приділяється мітохондріальним механізмам апоптозу. В мітохондріях виявлено цілу низку білків, у тому числі цитохром с, які, потрапляючи в цитоплазму, запускають апоптоз. Їхня кількість дає підстави порівнювати мітохондрії з «чашою, переповненою отрутою».
Для регуляції мітохондріального апоптозу існує система білків, які здійснюють контроль за виходом із мітохондрій проапоптичних факторів. Серед них виділяють білки з протилежними функціями – антиапоптичні й апоптичні, рівновага між якими і визначає долю клітини.
Апоптичні ефекти, індуковані окислювальним стресом, збільшенням концентрації кальцію, радіацією, гормонами, хіміотерапевтичними препаратами та іншими агентами, викликають порушення трансмембранного потенціалу, набухання мітохондрій, зміну проникливості мембран за рахунок утворення гігантських пор (мегаканалів). Поровий комплекс містить багато мішеней для зовнішніх впливів і регулюється різноманітними ендогенними фізіологічними факторами, серед яких: оксид азоту, активні форми кисню, концентрація іонів кальцію і магнію, концентрація АТФ і АДФ, ліпідів, певних білків. Гігантська пора інтегрує різні реакції-відповіді клітини на стрес, і майже всі процеси клітинної загибелі, пов’язані зі змінами мітохондріальної проникливості.
Доведено, що всі вище описані зміни в мітохондріях передують фрагментації хроматину та ядерній деградації. Під час порушення цілісності зовнішньої мітохондріальної мембрани з мітохондрій вивільняється білковий протеолітичний фактор, який, проникаючи в ядро, викликає апоптоз.
Такий складний і незвичний механізм реалізації апоптозу за участю мітохондрій, за уявленнями Скулачова, можна пояснити тим, що первинною функцією апоптозу було вибраковування з клітини, мітохондрії яких почали масово виробляти токсичні продукти одноелектронного відновлення кисню.
Ядерні механізми апоптозузапускаються при пошкодженні генетичного матеріалу. Величезне значення в реалізації апоптогенного сигналу в даному випадку відіграє білок р53, здатний активуватися у відповідь на пошкодження ДНК. Будучи фактором транскрипції, цей протеїн запускає зчитування генів проапоптичних факторів та інгібіторів циклінозалежних протеїнкіназ, що одночасно активує апоптоз і блокує входження клітини в наступну фазу клітинного циклу. Окрім того, р53 надходить із ядра до мітохондрій, де запускає розвиток апоптозу по мітохондріальному шляху. При мутаціях гена р53 такі клітини виживають і часто стають джерелом злоякісного росту. Білок р53 бере участь також в індукції радіаційного апоптозу.
Особливе значення апоптозу в ембріональному розвитку, який полягає в забезпеченні регресії частин ембріональних зачатків, особливо під час гісто- і органогенезу. Ембріональний розвиток завжди супроводжується надмірним утворенням клітин, особливо попередників нейронів (нейробластів), а під впливом апоптозу гине від 25 до 85% цих клітин. Проявами апоптозу в ембріогенезі є розрив плодових оболонок.
У дорослому організмі в фізіологічних умовах старіння клітин завершується запрограмованою смертю – так у процесі імунної відповіді гинуть клітини-кілери, клітини підгрудинної залози, які виконали гормональну функцію в дитячому віці гинуть при настанні статевої зрілості. Апоптоз клітин наступає після припинення гормональної стимуляції (постлактаційна інволюція молочної залози). У клітинах імунної системи апоптоз забезпечує розвиток імунних реакцій (інволюція підгрудинної залози при настанні статевої зрілості). При дії на організм шкідливих факторів, при інфаркті, інсульті та при інфекційних захворюваннях наступає також апоптоз.
Із апоптозом пов’язані не лише процеси онтогенезу, а й численні механізми захисту організму від патогенів і токсичних речовин. Коли специфічні антитіла, що виробляються організмом людини до (вірусів, деяких бактерій, грибів та найпростіших – внутрішньоклітинні паразитів) невзмозі знешкодити чужорідний агент. Тоді Т-лімфоцити (Т-кілери), вбивають клітини, що стали жертвами інфекційного збудника, і цим припиняють його подальше розмноження. Володіючи апаратом розпізнавання зараженої клітини (клітини-мішені) серед маси здорових клітин, Т-кілери викликають її загибель, запускаючи програму самогубства клітини-мішені – генетичне запрограмовану клітинну смерть, або апоптоз.
Слід відзначити, що апоптоз у зрілому організмі забезпечує клітинний гомеостаз — відносну постійність складу тканин і органів, а при старінні чи патології здійснює регуляцію кількості клітин в органах відповідно до знижених функціональних можливостей організму. Вважають, що пригнічення апоптозу можливо служить одним із механізмів канцерогенезу — злоякісного росту. При зниженні активності апоптозу відбувається накопичення клітин, наприклад, пухлинний ріст. При підвищеній активності апоптозу спостерігається прогресивне зменшення кількості клітин у тканині, наприклад, атрофія. Таке передбачення базується на тому, що в пухлинних клітинах інактивуються фактори, які запускають і підтримують програму апоптозу.
Запрограмована клітинна загибель характерна також і для рослин. Із фізіологічною клітинною смертю в рослин пов’язані процеси формотворення в онтогенезі, зокрема ксилогенез і флоемогенез, формотворення листків, загибель клітин кореневого чохлика, проростання пилкової трубки, а також імунні реакції на вторгнення патогену, осінній листопад.
Механізм опадання листків і зрілих плодів досить цікавий. Ці процеси супроводжуються вибірковою загибеллю ділянки клітин між основою черешка листка або плоду та стеблом. Клітини цієї ділянки секретують ферменти, що розчиняють клітинні стінки (пектинази та целюлази), а самі клітини цієї ділянки підлягають аутолізу.
Масова загибель клітин багатоклітинного організму за механізмом апоптозу розглядається, як умова нормального існування організму.
Призначення апоптозу виражається у підтриманні сталості клітин, визначенні форми організму та його частин, забезпеченні правильного співвідношення чисельності клітин різних типів, видаленні генетично дефектних клітин.
Ці функції апоптозу реалізуються на рівні клітинних популяцій – у процесі диференціації клітин і підтримання сталості їх чисельності. Роль апоптозу в популяції клітин, що не діляться, мінімальна та зводиться, як правило, до реакції на зовнішні впливи, наприклад, іонізуючої радіації.
Навпаки, у клітинних популяціях, що формуються, поновлюються, апоптозу належить провідна роль, оскільки він є тим фактором, що коригує диференціацію. Інтенсивність апоптозу вища на початкових етапах онтогенезу, зокрема, під час ембріогенезу, а в дорослому організмі апоптоз відіграє важливу роль лише у тканинах, що здатні до регенерації.
Отже, запрограмована клітинна загибель – це широко розповсюджений механізм у різних царствах живого. Еволюційно запрограмована клітинна смерть виникла у прокаріот як механізм противірусного захисту популяції і була закріплена в одноклітинних еукаріот. Надалі, з появою багатоклітинності, механізм удосконалювався та пристосовувався поряд із захистом від патогенів для реалізації важливих життєвих функцій – диференціації клітин і тканин під час ембріогенезу та постембріональному розвитку, елімінування клітин імунною системою, вибраковування старих клітин та клітин-мутантів.
Прикладом порушення регуляції клітинного циклу є неконтрольований поділ клітин й виникнення пухлин. У нормі клітина, в якої пошкоджена ДНК, не вступає в S-фазу. У разі мутацій або епігенетичних змін генів, що відповідають за поділ клітин і цілісність геному (протоонкогени, антионкогени, гени-мутатори), анормальні клітини починають швидко розмножуватись. Як наслідок розвиваються новоутворення. Одним із механізмів захисту від них є апоптоз. Водночас є гени (антионкогени), що пригнічують утворення ракових пухлин.
Отже, порушення клітинного циклу зумовлюють генетичну нестабільність та порушення диференціації клітин.


про публікацію авторської розробки
Додати розробку
