Урок "Розрахунки за хімічними формулами"
Тема уроку: Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів та продуктів реакції
Мета уроку:
навчальна: розвивати вміння й навички розрахунків за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції; повторити хімічні властивості класів неорганічних сполук, продовжувати формувати вміння складати рівняння хімічних реакцій, називати речовини різних класів, здійснювати їх перетворення;
розвивальна: розвивати вміння учнів порівнювати, класифікувати, співставляти, будувати алгоритми дій, розв'язувати творчі завдання
виховна: виховувати самостійність, наполегливість, творчість учнів
Тема уроку: Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів реакції
Мета уроку:
навчальна: розвивати вміння й навички розрахунків за хімічними рівняннями маси, об’єму, кількості речовини реагентів і продуктів реакції; повторити хімічні властивості класів неорганічних сполук, продовжувати формувати вміння складати рівняння хімічних реакцій, називати речовини різних класів, здійснювати їх перетворення;
розвивальна: розвивати вміння учнів порівнювати, класифікувати, співставляти, будувати алгоритми дій, розв’язувати творчі завдання
виховна: виховувати самостійність, наполегливість, творчість учнів
Тип уроку: урок формування знань, навичок, умінь
Форми роботи: самостійна робота, фронтальна робота, робота в парах
Обладнання та матеріали: картки із завданнями, Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів
Хід уроку
І. Організація класу (2 хв)
Перевірка присутності учнів
ІІ. Перевірка домашнього завдання, актуалізація опорних знань
Бесіда (мозковий штурм):
- Хто пригадає, що таке оксиди?
- Що таке номенклатура?
- Як називають оксиди?
- Як класифікуються оксиди?
- Які оксиди називаються кислотними? Наведіть приклади.
- Які оксиди називаються основними? Наведіть приклади.
- Хто пригадає, що таке кислоти?
- Як класифікуються кислоти?
- Які кислоти називаються оксигеновмісні, безоксигенові? Наведіть приклади.
- Які кислоти називаються одноосновними, багатоосновними? Наведіть приклади.
- Хто пригадає, що таке гідроксиди?
- Як називають гідроксиди?
- Як класифікуються гідроксиди?
- Наведіть приклади лугів.
- Наведіть приклади нерозчинних основ.
- Хто пригадає, що таке солі?
- Як називають солі?
Завдання 1
Дано такі речовини:
|
№ |
Речовини |
|
1 |
Cu(OH)2, Na2О, Р2О5, HNО3, Al2(SО4)2, КОН |
|
2 |
Fe(OH)2, CaO, SО3, H3PО4, MgCl2, NaOH |
|
3 |
Fe(OH)3, K2О, CО2, HCl, Zn3(PO4)2, Ba(OH)2 |
|
4 |
Al(OH)3, MgO, Cl2O7, H2SO4, Ba(NO3)2, KOH |
1. Виберіть зі списку формули оксидів. Назвіть речовини.
2. Виберіть із списку кислоти, назвіть їх.
ІІІ. Мотивація навчально-пізнавальної діяльності учнів
На попередніх уроках ми вже вивчали хімічні властивості, способи добування всіх класів неорганічних сполук. Ці знання нам знадобляться для правильного розв’язування задач. Тож тема нашого уроку : «Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів реакції».
ІV. Вправи для формування вмінь, умінь та навичок
Пояснення вчителя
Розглянемо конкретні приклади.
Приклад 1. Яку масу гашеного вапна Са(ОН)2 можна добути внаслідок взаємодії з водою кальцій оксиду масою 280 г?
Передусім запишемо скорочену умову задачі та складемо рівняння хімічної реакції.
Дано:
m(СаО) = 280 г
m(Са(ОН)2) — ?
Розв'язування:
СаО + Н2О = Са(ОН)2
Прочитайте ще раз умову задачі та підкресли відоме (що дано) і невідоме (що треба взнати). Над підкресленими формулами проставте вихідні дані з умови задачі:
280 г х
СаО + Н2О = Са(ОН)2
Під формулами речовин запиши дані, які можна дістати з рівняння реакції:
280 г х
СаО + Н2О = Са(ОН)2
_______________ __________________
М= 40 + 16 = 56 г/моль М= 40 + 32 + 2 = 74 г/моль
v = 1 моль v = 1 моль
m = 1 моль•56 г/моль = 56 г m = 1 моль•74 г/моль = 74 г
Розв'язання задачі будується на використанні прямо пропорційної залежності між кількісними характеристиками величин
З рівняння реакції виходить, що внаслідок взаємодії з водою 56 г СаО можна добути 74 г гашеного вапна Са(ОН)2, а якщо взяти не 56 г, а 280 г СаО, то можна добути гашеного вапна у стільки разів більше, у скільки 280 г більше за 56 г. Тобто ти бачиш, що між величинами існує пряма пропорційна залежність. Отже, ти можеш скласти пропорцію і розв'язати її:
56 г : 280 г = 74 г : х;
x = (280 г • 74 г)/(56 г) = 370 г.
Відповідь. Унаслідок взаємодії з водою кальцій оксиду масою 280 г, можна добути гашене вапно Са(ОН)2 масою 370 г (m(Са(ОН)2) = 370 г).
Задача №2. (219)
Який об’єм сірчистого газу було добуто після спалювання 16 г сірки?
Задача № 3
Який об’єм нітроген(V) оксиду прореагувала з водою, якщо утворилася нітратна кислота HNО3 кількістю речовини 10 моль?
V. Узагальнення та систематизація знань, умінь та навичок
На дошці зображений малюнок:

2) Обчисліть об’єм води, що виділилась (н. у.).
3) Обчисліть масу солі, що утворилася.
4) Обчисліть кількість речовини кислоти, що вступила в реакцію.
Завдання на катках
Завдання 1. Хімічний диктант.
Виписати окремо формули оксидів, кислот, основ, солей та дайте їм назви.
![]()
Завдання 2. Тестові завдання.
Установіть відповідність між реагентами та продуктами реакції.
-
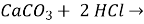 1)
1) 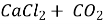
-
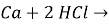
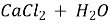
-
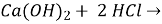 3)
3) 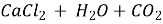
-
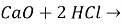
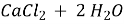
5) ![]()
Завдання3. Гра виключення зайвого.
Завдання А. Виключить кислоти, які не можна отримати з відповідного оксиду.
Завдання Б. Виключить двоосновну кислоту серед одноосновних.
Завдання В. Виключить слабку кислоту серед сильних.
|
Виключення «Зайвого» А) Н2SO4, H2SO3, H2SiO3, H3PO4. Б) HI, HBr, H2S, HF.
В) HNO3, H2SO4, H2CO3, HCl. |
Завдання 4. Здійсніть перетворення.
![]()
Завдання 5. Розв’язування розрахункових задач.
- Яка кількість магній оксиду утворюється під час спалювання 0,1 моль магнію?
- Яка кількість хлоридної кислоти прореагує з 20 г магній оксиду?
- Яка маса сульфатної кислоти вступає в реакцію з 0,5 моль натрій гідроксиду?
VІ. Підбиття підсумків уроку
Учитель підбиває підсумки роботи груп за трьома завданнями, повідомляє оцінки, акцентує увагу на типових помилках, які були припущені в процесі виконання завдань.
VІІ. Домашнє завдання
Повторити параграф, виконати завдання №217, 218, 228, підготуватися до контрольної роботи
Прізвище та ім’я _________________________________________
Клас _________________________________
Дата уроку __________________________________________
Завдання 1. Хімічний диктант.
Виписати окремо формули оксидів, кислот, основ, солей та дайте їм назви.
![]()
Завдання 2. Тестові завдання.
Установіть відповідність між реагентами та продуктами реакції.
А)![]() 1)
1) ![]()
Б)![]()
![]()
В)![]() 3)
3) ![]()
Г)![]()
![]()
5) ![]()
Завдання3. Гра виключення зайвого.
Завдання А. Виключіть кислоти, які не можна отримати з відповідного оксиду.
Завдання Б. Виключить двоосновну кислоту серед одноосновних.
Завдання В. Виключить слабку кислоту серед сильних.
|
Виключення «Зайвого» А) Н2SO4, H2SO3, H2SiO3, H3PO4. Б) HI, HBr, H2S, HF.
В) HNO3, H2SO4, H2CO3, HCl. |
Завдання 4. Здійсніть перетворення.
![]()
Завдання 5. Розв’язування розрахункових задач.
1.Яка кількість магній оксиду утворюється під час спалювання 0,1 моль магнію?
2.Яка кількість хлоридної кислоти прореагує з 20 г магній оксиду?
3.Яка маса сульфатної кислоти вступає в реакцію з 0,5 моль натрій гідроксиду?
Прізвище та ім’я _________________________________________
Клас _________________________________
Дата уроку __________________________________________
Завдання 1. Хімічний диктант.
Виписати окремо формули оксидів, кислот, основ, солей та дайте їм назви.
![]()
Завдання 2. Тестові завдання.
Установіть відповідність між реагентами та продуктами реакції.
А)![]() 1)
1) ![]()
Б)![]()
![]()
В)![]() 3)
3) ![]()
Г)![]()
![]()
5) ![]()
Завдання3. Гра виключення зайвого.
Завдання А. Виключіть кислоти, які не можна отримати з відповідного оксиду.
Завдання Б. Виключить двоосновну кислоту серед одноосновних.
Завдання В. Виключить слабку кислоту серед сильних.
|
Виключення «Зайвого» А) Н2SO4, H2SO3, H2SiO3, H3PO4. Б) HI, HBr, H2S, HF.
В) HNO3, H2SO4, H2CO3, HCl. |
Завдання 4. Здійсніть перетворення.
![]()
Завдання 5. Розв’язування розрахункових задач.
1.Яка кількість магній оксиду утворюється під час спалювання 0,1 моль магнію?
2.Яка кількість хлоридної кислоти прореагує з 20 г магній оксиду?
3.Яка маса сульфатної кислоти вступає в реакцію з 0,5 моль натрій гідроксиду?


про публікацію авторської розробки
Додати розробку
