Урок "«Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини, реагентів і продуктів реакції.»
ПЛАН-КОНСПЕКТ
уроку з хімії,
8 клас
на тему:
«Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини, реагентів і продуктів реакції.»
Тема уроку.Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини, реагентів і продуктів реакції.
Навчальна мета. Ознайомити учнів з алгоритмами розв’язування розрахункових задач за хімічним рівнянням; повторити хімічні властивості класів неорганічних сполук, генетичний зв’язок між ними;продовжувати формувати вміння складати рівняння хімічних реакцій, називати речовини різних класів, здійснювати їх перетворення.
Розвивальна мета. Розвивати хімічну мову; вміння робити короткий раціональний запис; логічне мислення та уяву учнів; вміння користуватися основними фізико-хімічними величинами та розрахунковими формулами.
Виховна мета. Виховуватисамостійність,наполегливість, творчістьта цікавістьучнів практичного використаннянабутихтеоретичнихзнань.
Тип уроку: урок формування нових знань, навичок, умінь
Форми роботи:самостійна робота, робота в групах, фронтальна робота.
Методи навчання: словесний (бесіда, розповідь учителя), наочний (робота на дошці), практичний (розв’язування задач).
Обладнання та реактиви: періодична система хімічних елементів, таблиця розчинності, ряд активності металів,картки з завданнями, роздатковий матеріал.
Список літератури:
Савчин М. М. Хімія 8 клас : підручн. для загальноосвіт. навч. закл. / М. М. Савчин. – К. ; Харків : Грамота, 2016. – 224с. :іл.
Структура уроку:
І. Організаційна частина (2 хв).
ІІ. Перевірка домашнього завдання (5 хв).
ІІІ. Актуалізація опорних знань (7 хв).
ІV. Вивчення нового матеріалу (17хв).
V. Закріплення й узагальнення знань (11хв).
VІ. Підбиття підсумків уроку (2 хв).
VІІ. Повідомлення домашнього завдання ( 1 хв).
Хід уроку
І. Організаційна частина
Учитель. Доброго дня, діти. Рада вас бачити. Ми починаємо вивчення нової теми «Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини, реагентів і продуктів реакції». Сьогодні попрацюємо наступним чином. Я хочу попросити вас поділитися на 3 групи. Кожна група буде мати окреме завдання. Впевнена, ви багато почерпнете з сьогоднішнього уроку.
ІІ. Перевірка домашнього завдання
Учитель. На попередньому уроці ми з вами вивчали фізичні та хімічні властивості оксидів. Тож зараз ми подивимось як ви засвоїли попередню тему (до дошки виходять 2 учні і розв’язують завдання з картки на дошці, а клас слідкує за їхньою роботою)
Картка №1
- Які основи і кислоти відповідають таким оксидам:
- Na2O – (NaOH)
- SO2 – (H2SO3)
- MgO – (Mg(OH)2 )
- P2O5 – ( H3PO4)
- SiO2 – ( H2SiO3 )
- Дописати рівняння реакції:
- СuO + 2 HCl = ( CuCl2 + H2O )
- SO3 + H2O = (H2SO4)
- CO2 + 2NaOH = ( Na2CO3 +H2O )
- MgO + CO2 = ( MgCO3 )
Картка №2
- Які основи і кислоти відповідають таким оксидам:
- CO2 – ( H2CO3)
- K2O – ( KOH )
- Al2O3 – ( Al(OH)3 )
- ZnO – ( Zn(OH)2 )
- SO3 – (H2SO4)
- Дописати рівняння реакції:
- K2O + H2O = ( 2KOH )
- BaO + H2SO4= ( BaSO4 + H2O )
- Na2O + SiO2 = ( Na2SiO3)
- SO3 + 2KOH = ( K2SO4 + H2O )
ІІІ. Актуалізація опорних знань
- Які класи неорганічних речовин ви знаєте? ( оксиди, кислоти, основи, солі)
- Що таке оксиди? (це складні речовини, до складу яких входять два елементи, один з яких – Оксиген у ступені окиснення -2)
- Як утворюються назви оксидів? (назва елемента + слово «оксид»)
- На які групи класифікують оксиди? (солетворні і несолетвірні)
- Солетвірні оксиди поділяються на: (основні, кислотні, амфотерні)
- Що таке кислоти? (це складні речовини, до складу яких входять один або кілька атомів Гідрогену, здатних заміщуватися на йони металічних елементів, і кислотні залишки)
- Як класифікують кислоти за кількістю атомів Гідрогену? ( одноосновні, двоосновні, триосновні)
- Як класифікують кислоти за вмістом Оксигену? ( безоксигенові, оксигеновмісні)
- Що таке солі? ( складні речовини, утворені катіонами металічних елементів і аніонами кислотних залишків)
- Як утворюємо назви солей? (назва катіона металічного елемента + назва кислотного залишку)
- Що таке основи? (складні речовини, до складу яких входять катіони металічних елементів й один або кілька аніонів гідроксильних груп)
- Як називаємо основи? (назва катіона металічного елемента + слово «гідроксид» )
- Як класифікують основи за розчинністю у воді? (розчинні (луги) і нерозчинні)
ІV. Вивчення нового матеріалу
Учитель.Ви вже вмієте розв’язувати задачі на основі понять « кількості речовини», «стала Авогадро», «молярна маса» , «молярний об’єм» та «відносна густина газів» . Тож давайте коротко пригадаємо основні поняття.
Прийом «Правда чи брехня?»
Учитель.Працювати будемо таким чином.Я буду говорити твердження, а ви маєте розпізнати правда це чи брехня. Ви виходите з-за парт. Якщо твердження буде правдивим, то ви повертаєтесь у правий бік, якщо ж брехня – у лівий. Все зрозуміло? Ну що ж, починаємо.
- Молярний об’єм – це відношення кількості речовини до об’єму ? (брехня; це відношення об’єму до відповідної кількості речовини)
- Число Авогадро становить 6,02* 1023 ? (правда)
-
Молярна маса визначається за формулою M =
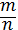 ? (правда)
? (правда)
- Молярний об’єм – це фізична стала, яка за нормальних умов однакова для всіх газів і чисельно дорівнює 24,5 л/моль ? (брехня; Vm = 22,4 л/моль)
- Кількість речовини позначається буквою «n» і її одиницею є моль? (правда)
- Відносною густиною газів називають відношення, що показує, у скільки разів маса певного об’єму одного газу більша або менша від маси того ж об’єму іншого газу за однакових умов ? (правда)
- Одиницею молярної маси є моль/г або моль/кг ? (брехня; одиницею молярної маси є г/моль або кг/моль)
-
Молярний об’єм виражається за формулою n =
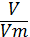 ? (брехня; Vm =
? (брехня; Vm = 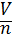 )
)
- Відносна густина газів позначається літерою латинського алфавіту D? (правда)
Учитель. Молодці. Матеріал попередніх уроків ви пригадали. Сьогодні на уроці ми з вами будемо вчитися розв’язувати задачі за хімічним рівнянням.Тож записуйте першу умову задачі.
- Обчислення масу реагенту за масою іншого реагенту.
![]() Задача 1. Обчисліть масу кальцій оксиду, що вступив у реакцію з водою масою 55г.
Задача 1. Обчисліть масу кальцій оксиду, що вступив у реакцію з водою масою 55г.
Дано:
m( Н2О) = 55гРозв’язання
-
 Записуємо рівняння реакції купрум оксиду з
Записуємо рівняння реакції купрум оксиду з
m(CаO) – ? водою
CаO+ H2O = Cа(OH)2↓
- Обчислюємо значення молярних мас речовин, що вступили в реакцію:
M(CаO) = 40 + 16 = 56г/моль;
M(H2O ) = 1*2 +16 = 18 г/моль.
- Запишемо маси й відповідні дані, використовуючи рівняння реакції:
Х г 55 г
CuO + H2O =Cu(OH)2↓
М=56 г/моль М=18 г/моль
m=56 г m= 18 г
- Підписавши значення мас під формулами речовин, за якими будемо виконувати обчислення, а невідомі – над формулами, складаємо пропорцію:
- Обчислюємо невідоме, позначене х:
х=385 г
Відповідь: у реакцію вступить 385 г CаO
- Обчислення об’єму реагенту за масою іншого реагенту.
![]() Задача 2. У реакцію з сульфур(VI)оксидом вступила вода масою 12,4г Обчисліть, який об’єм сульфур(VI) оксиду (н.у) прореагував.
Задача 2. У реакцію з сульфур(VI)оксидом вступила вода масою 12,4г Обчисліть, який об’єм сульфур(VI) оксиду (н.у) прореагував.
Дано: Розв’язання
m(H2O) = 12,6г 1) Записуємо рівняння реакції:
![]() H2O + SO3 = H2SO4
H2O + SO3 = H2SO4
V(SO3) – ? 2) Обчислюємо молярнумасу води:
M(H2O) = 18г/моль.
3) Обчислюємо кількість речовини води в порції
масою 12, 6 г:
n = ![]()
4) На основі рівняння складаємо пропорцію:
0,7 моль х
H2O + SO3= H2SO4
1 моль 1 моль
![]()
Отже, х= ![]()
5) Обчислюємо об’єм 0,7 моль сульфур(VI) оксиду,
знаючи, що молярний об’єм становить 22,4 л/моль:
n= ![]() ; V= n * Vm
; V= n * Vm
V(SO3) = 22,4 л/моль * 0,7 моль = 15,68 л.
Відповідь: у реакції прореагувало 15, 68 л сульфур(VI)
оксиду
- Обчислення кількості речовини реагенту та продукту реакціїза відомою кількістю речовини іншого реагенту.
Задача 3. Обчислити кількість речовини азоту, що вступив у реакцію, та кількість речовини амоніаку, що утворився внаслідок реакції, якщо прореагував водень кількістю речовини 12 моль.
![]() Дано: Розв’язання
Дано: Розв’язання
n(H2 ) = 12 моль 1) Записуємо рівняння реакції та підписуємо й
![]() надписуємо дані:
надписуємо дані:
n ( N2) – ? 12 моль х у
3 H2 + N2 = 2NH3
3 моль 1 моль 2 моль
2) Обчислюємо кількість речовини азоту й амоніаку:
![]() ; х=
; х=![]() ;
;
![]() ; у=
; у= ![]() .
.
Відповідь: в реакцію вступило 4 моль азоту,
А внаслідок реакції утворилося 8 моль амоніаку.
V. Закріплення й узагальнення знань
Учитель. Ось такі типи задач ми з вами будемо сьогодні вчитися розв’язувати. Зараз 1 учень піде до дошки і спробує розв’язати схожу задачу з вашою допомогою.
Задача. Внаслідок взаємодії ферум (ІІ) оксиду з хлоридною кислотою утворився ферум (ІІ) хлорид масою 12,7 г. Обчисліть масу ферум (ІІ) оксиду, що вступив в реакцію.
![]() Дано: Розв’язання
Дано: Розв’язання
m ( FeCl2 ) = 12,7 г х г 12,7 г
![]() FeO + 2 HCl =FeCl2 + H2O
FeO + 2 HCl =FeCl2 + H2O
m ( FeO ) – ? 1 моль1 моль
М= 72 г/моль М= 127 г/моль
m= 72 г m= 127 г
; х= 7,2 г
Відповідь: m ( FeO ) = 7,2 г
Учитель. Діти, а зараз попрацюємо в групах. Усі 3 групи отримають однакову задачу. Подивимось хто швидше її розв’яже правильно.
Задача. Через розчин, що містив натрій гідроксид масою 4 г, пропустили карбон(IV) оксид до утворення натрій карбонату. Обчисліть об’єм карбон(IV) оксиду та масу утвореного продукту.
![]() Дано: Розв’язання
Дано: Розв’язання
![]() m ( NaOH) = 4 г4 г у л х г
m ( NaOH) = 4 г4 г у л х г
V(CO2 ) – ?2 NaOH + CO2 = Na2CO3 + H2O
m(Na2CO3 ) – ? 2 моль 1 моль 1 моль
М=40г/моль Vm=22,4л/моль М=106г/моль
m= 80 г V= 22,4 л m= 106 г
 ; х=
; х= ![]() 5,3 (г) - m(Na2CO3 )
5,3 (г) - m(Na2CO3 )
; у= ![]() (л) - V( CO2 )
(л) - V( CO2 )
Відповідь: V( CO2 ) = 1,12 л, m(Na2CO3 ) = 5,3 г
VІ. Підбиття підсумків уроку
(Учитель підбиває підсумки роботи груп, акцентує увагу на типових помилках, які були допущені під час розв’язування задачі).
Учитель. Ви сьогодні молодці, гарно попрацювали. Учні, які сьогодні працювали біля дошки отримають відповідні оцінки.
VІІ. Повідомлення домашнього завдання
Учитель. На домашнє завдання вам буде вивчити алгоритм розв’язування тих задач, які ми розглядали на сьогоднішньому уроці, опрацювати параграф 27 та виконати вправи 3 і 5 після нього.
Дякую за співпрацю !
До побачення.
Картка №1
- Які основи і кислоти відповідають таким оксидам:
- Na2O –
- SO2 –
- MgO –
- P2O5 –
- SiO2 –
- Дописати рівняння реакції:
- СuO + HCl =
- SO3 + H2O =
- CO2 + NaOH =
- MgO + CO2=
____________________________________________________________________
Картка №2
- Які основи і кислоти відповідають таким оксидам:
- CO2 –
- K2O –
- Al2O3 –
- ZnO –
- SO3 –
- Дописати рівняння реакції:
- K2O + H2O =
- BaO + H2SO4=
- Na2O + SiO2 =
- SO3 + KOH =
Задача. Через розчин, що містив натрій гідроксид масою 4 г, пропустили карбон(IV) оксид до утворення натрій карбонату. Обчисліть об’єм карбон(IV) оксиду та масу утвореного продукту.
Задача. Через розчин, що містив натрій гідроксид масою 4 г, пропустили карбон(IV) оксид до утворення натрій карбонату. Обчисліть об’єм карбон(IV) оксиду та масу утвореного продукту.
Задача. Через розчин, що містив натрій гідроксид масою 4 г, пропустили карбон(IV) оксид до утворення натрій карбонату. Обчисліть об’єм карбон(IV) оксиду та масу утвореного продукту.
_____________________________________________________________________


про публікацію авторської розробки
Додати розробку

-

Крамар Світлана
18.03.2024 в 23:27
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Колесник Наталія Іванівна
17.03.2024 в 20:08
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Юсин Надія Улянівна
19.02.2024 в 21:10
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тихончук Олександр
13.03.2023 в 21:01
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шевченко Наталія
27.01.2023 в 11:27
Загальна:
4.0
Структурованість
4.0
Оригінальність викладу
3.0
Відповідність темі
5.0
-

Велика Наталія Миколаївна
16.05.2021 в 17:24
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сакада Марина
14.03.2021 в 17:55
Є помилки. Наприклад, в умові 1 задачі спочатку йде мова про кальцій, а потім чомусь купрум пишете. І в розрахунках. Як в 1 задачі вийшла така відповідь?
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Лук'янова Марина Василівна
24.02.2021 в 21:21
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 5 відгуків