Урок "Хімічні властивості кислот, їх взаємодія з основами та солями".
Урок хімії , 8 клас, Дистанційне навчання
Тема уроку: Хімічні властивості кислот, їх взаємодія з основами та солями.
Мета: *вивчити хімічні властивості кислот;
*характеризувати взаємодію кислот з основами та солями;
*наводити приклади рівнянь реакцій, що підтверджують взаємодію кислот з солями та основами;
*прогнозувати перебіг реакцій між розчинами кислот і солей;
*планувати експеримент, проводити його, описувати спостереження, робити висновки;
* повторити як змінюється забарвлення індикаторів у кислому середовищі;
* характеризувати хімічні властивості кислот;
* повторити особливості взаємодії кислот з металами, визначати активность металу від його положення у витискувальному ряді металів;
* продовжити формувати та розвивати вміння складати хімічні рівняння, розставляти коефіцієнти та визначати тип реакції;
*розвивати практичні навички учнів при виконанні хімічних дослідів; дотримуючись правил техніки безпеки.
Обладнання: Періодична система хімічних елементів Д.І.Менделєєва, витискувальний ряд металів, таблиця розчинності, реактиви, необхідні для дослідів.
Тип уроку: комбінований урок.
Хід уроку
І. Організація роботи класу.
Перевірка готовності учнів до уроку.
Вправа «Сьогодні на уроці я бажаю тобі …».
ІІ. Етап особистої орієнтації та прогнозування. Сьгодні ми повторимо властивості кислот, які вивчали на тому уроці та продовжимо знайомство з хімічними властивостями цих речовин.
Виконайте наступну вправу:

Назви яких речовин тут записано? (Кислоти)
Що їх об’єднує? (Вони всі є одноосновними, безоксигеновими).
ІІІ. Етап забезпечення виконання завдань уроку.
Повторимо, що ми знаємо про кислоти.
1.Яка формула сполуки зайва: H2CO3; KOH; H2SO3; H2SO4; HCl.
2.Складіть формули кислот, з яких утворені солі та назвітьїх:
K2CO3 … (H2CO3 - карбонатна),
Na3PO4 … (H3PO4 - ортофосфатна),
Fe(NO3)3 … (HNO3 - нітратна),
K2SiO3 … . (H2SiO3 - силікатна).
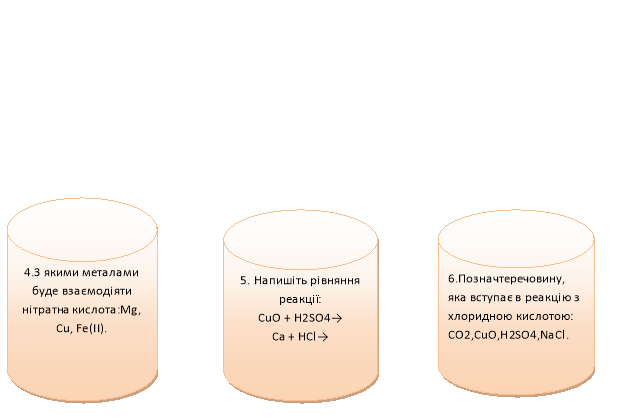
3.Напишіть рівняння можливих реакцій взаємодії Ca, Hg,Mg з нітратною кислотою.
Ca + 2HNO3 = Ca(NO3)2 + H2↑;
Mg + 2HNO3 = Mg(NO3)2 + H2↑;
Чому Hg не реагує з нітратною кислотою?
У Витискувальному ряді активностей металів Hg знаходиться після Гідрогену, отже він на витискує Гідроген з кислот, тобто, не реагує з кислотами.
4. Розв'язати кросворд , скориставшись посиланням:
https://learningapps.org/10167400
5. В нас бліц – опитування. Ваші відповіді відправите мені (фото завдань).


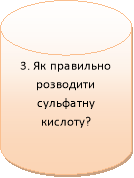
IV. Етап забезпечення виконань завдань уроку.
![]() Продовжимо розглядати хімічні властивості кислот. Запишіть тему уроку. Крім взаємодії з металами й оксидами, кислоти вступають у взаємодію з основами та солями. Дослідимо ці властивості кислот за допомогою експериментів. Згадаймо правила техніки безпеки при роботі з кислотами.
Продовжимо розглядати хімічні властивості кислот. Запишіть тему уроку. Крім взаємодії з металами й оксидами, кислоти вступають у взаємодію з основами та солями. Дослідимо ці властивості кислот за допомогою експериментів. Згадаймо правила техніки безпеки при роботі з кислотами.
1.Взаємодія з основами (реакція нейтралізації): Перегляньте відео досліду за посиланням:
https://www.youtube.com/watch?v=kfrQ1p5ieCo
Прочитайте в підручнику (§29, стор.162) як проводити таку реакцію. Напишіть рівняння реакції, визначте тип реакції. Запишіть, які реакції називають реакціями нейтралізації .
NaOH + HCl = NaCl + H2O; це реакція обміну.
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
2.Взаємодія з солями:
А) Це реакція з виділенням газу.
![]() H2O
H2O
![]() Na2CO3 + 2HCl = 2NaCl + H2CO3
Na2CO3 + 2HCl = 2NaCl + H2CO3
Б)Випадання осаду: CO2↑
AgNO3 +HCl = AgCl↓ + HNO3
В)Утворення води:
2NaOH + H2SO4 = Na2SO4 + 2H2O
Перегляньте відео цих дослідів за посиланням: https://www.youtube.com/watch?v=y5ioRjYhlMc
Висновок: Реакції кислот з солями відбуваються в трьох випадках:
- В результаті реакції утворюється газ;
- В результаті реакції випадає осад;
- Одним з продуктів реакції є вода.
3. Якісні реакції на:
А) хлоридну кислоту: перегляньте відеофрагмент досліду за посиланням:
https://www.youtube.com/watch?v=2YjtUi3-jTE
Напишіть рівняння реакції, вкажіть її тип, перевірте, чи потрібні коефіцієнти.
AgNO3 + HCl = AgCl↓ + HNO3; випадає білий осад, як творог; це реакція обміну.
Б) на сульфатну кислоту: перегляньте відеофрагмент досліду за посиланням:
https://www.youtube.com/watch?v=LwTY2CVZRHA
BaCl2 + H2SO4 = BaSO4↓ + 2HCl; випадає білий осад, це реакція обміну.
Напишіть рівняння реакції, вкажіть її тип, перевірте, чи потрібні коефіцієнти.
Це якісні реакції, за допомогою яких можна визначати хлоридну та сульфатну кислоти, їх треба запам’ятати.
V. Етап контролю й оцінювання.
Завдання 1. Напишіть рівняння реакцій і вкажіть пару речовин серед продуктів взаємодії яких є осад:
А) натрій хлорид і нітратна кислота;
Б) магній і хлорид на кислота;
В) барій гідроксид і сульфатна кислота;
Г) калій гідроксид і ортофосфатна кислота
Перевірте рівняння реакцій:
А)NaCl + HNO3 = NaNO3 + HCl;
Б) Mg + 2HCl = MgCl2 + H2↑;
В) Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O
Г) 3KOH + H3PO4 = K3PO4 +3 H2O;
Читаєм ще раз питання. Ваша відповідь.
Правильна відповідь буде: В.
Завдання 2. У якому випадку не виділятиметься водень під час змішування:
А) Zn + HCl → … ;
Б) Cu + HCl → … ;
В) Ca + H3PO4→ … ;
Г) Mg + HNO3→ … .
Перевірте рівняння реакцій:
А) Zn + 2HCl → ZnCl2 + H2↑;
![]() Б) Cu + HCl → … ;
Б) Cu + HCl → … ;
В) 3Ca + 2H3PO4→ Ca3(PO4)2 + 3H2↑;
Г) Mg + 2HNO3→Mg (NO3)2 + H2↑.
Правильна відповідь … Б.
Завдання 3. Розшифруйте ребус


 Сульфіт
Сульфіт
О=У
Завдання 4. Створіть сенкан на тему «Кислоти»:
Кислота,
Рідка, Тверда, Летка,
Реагує, розчиняє, знезаражує.
Змінюює забарвлення лакмусу на червоний.
Кислі.
Завдання 5. В яких випадках сульфатна кислота прореагує з cолями? З якими з цих солей взаємодіє сульфатна кислота: NaCl, Na2CO3, Ba(NO3)2. Запишіть відповідні рівняння реакцій.
2NaCl + H2SO4→Na2SO4 + 2HCl, реакція до кінця не йде, так як в результаті реакції утворюються дві розчинні сполуки.
Na2CO3 + H2SO4→Na2SO4 + H2O + CO2↑, в результаті реакції утворився газ CO2↑, реакція відбулась.
Ba(NO3)2 + H2SO4→ BaSO4↓ + 2HNO3, реакція пройшла, так як в результаті реакції випав осад.
VІ. Рефлексія.
Діти, подивіться уважно та скажіть, яке враження справив на вас урок.
* Сьогодні я дізнався…
* Було цікаво…
* Було складно…
* Я виконував завдання...
* Я зрозумів, що…
* Тепер я можу…
* Я відчув, що…
* Я набув…
* Я навчився…
* У мене не вийшло…
* Я зміг…
* Мене здивувало...
* Урок дав мені для життя…
* Мені захотілося…
* Я спробував…
Дякую вам за активність на уроці, за вашу небайдужість, за ваше вміння працювати наполегливо та швидко.
Запишіть домашнє завдання: опрацювати §29, вправи 3, 5 на стор.165-166 підручника. Спробуйте скласти свої сенкани з теми «Кислоти».

про публікацію авторської розробки
Додати розробку
