Урок "Солі (середні), їх склад¸ назви. Класифікація солей."
|
Клас 8 |
Дата проведення уроку |
УРОК № 4
Тема: солі (середні), їх склад¸ назви. Класифікація солей.
Мета уроку:
навчальна: сформувати поняття про солі, визначити особливості їх складу та назв;
розвиваюча: розвивати вміння й навички складати формули за валентністю на прикладі солей, виконувати обчислення;
виховна: формувати уявлення про негативний вплив деяких речовин на довкілля
Обладнання і матеріали: підручник Хімія 8 кл. (Буринська Н.М.), робочий зошит 8 кл. (Савчин М.М.), Періодична система хімічних елементів Д.І.Менделєєва, картки для письмової перевірки знань, слайди презентації
Базові поняття і терміни уроку: солі, середні і кислі солі.
Тип уроку: комбінований
СХЕМА УРОКУ
|
Етап уроку |
Методи навчання |
Форми |
Конкретні прийоми |
|
І. Організаційний етап
|
Інформаційно-рецептивний: - словесний
|
Методи стимулювання навчально-пізнавальної діяльності: - Віршик |
Активізація уваги |
|
ІІ. Контроль та оцінювання навчальних досягнень учнів |
Інформаційно-рецептивний: - наочний |
Хімічний диктант Слайд №1 |
Контроль, самоконтроль |
|
ІІІ. Мотивація навчально-пізнавальної діяльності учнів
|
Інформаційно-рецептивний: - словесний - наочний |
- повідомлення учнів, бесіда - віршик Слайд №2 |
Виклад інформації Активізація уваги Спостереження |
|
ІV. Повідомлення теми, мети і завдань уроку
|
Інформаційно-рецептивний: - наочний |
Слайди №3-5 |
Спостереження Запис у зошит теми уроку |
|
V. Перевірка знань учнів фактичного матеріалу
|
Інформаційно-рецептивний: - практичний |
Робота з картками |
Фронтальна перевірка |
|
VІ. Сприйняття та засвоєння учнями нового навчального матеріалу |
1. Дослідницький
2. Наочний |
Самостійна дослідницька робота учнів Бесіда Слайд №6,7 |
Спостереження за об’єктом
Спостереження |
|
VІІ. Осмислення об’єктивних зв’язків і взаємозалежності у вивченому матеріалі |
Інформаційно-рецептивний: |
Робота у зошиті |
Письмові завдання |
|
VІІІ. Узагальнення і систематизація знань
|
Інформаційно-рецептивний:
|
Словесні, наочні методи |
Контроль, самоконтроль, конкретизація |
|
ІХ. Домашнє завдання
|
Інформаційно-рецептивний: - словесний |
Бесіда Слайд №8 |
Логічне структурування
|
|
Х. Підсумок уроку
|
Інформаційно-рецептивний: - словесний |
Слайд №9 Бесіда
|
Фронтальне опитування «Мікрофон» |
ХІД УРОКУ
- Організаційний етап
Вчитель:
Привітайтесь: «Добрий день!»
Всі сідайте тихо, діти!
Домовляйтесь, не шуміти.
Руку гарно піднімати,
На уроці – не дрімати,
Щоб не було вам мороки,
Всі готові до уроку?
ІІ. Контроль та оцінювання навчальних досягнень учнів

ІІІ. Мотивація навчально-пізнавальної діяльності учнів
Випереджальне завдання: виступ до 5 хв.
Повідомлення учня «Поширення солей у природі. Застосування солей»
Ситуація успіху: оплески виступаючим
Слайд №2

ІV. Повідомлення теми, мети і завдань уроку
Вчитель:
Слайд №3

Слайд №4

Слайд №5

V. Перевірка знань учнів фактичного матеріалу
Робота з картками «Основи, їх склад, назви» (письмові завдання)
Клас поділяється на 2 варіанти
Час на виконання завдання – 5-7 хв.
Картка 1 «Основи, їх склад, назви»
Варіант І
- Вкажіть правильне твердження: «Основи — це складні речовини, утворені ...»:
А атомами двох елементів, один із яких Оксиген;
Б металічним елементом і кислотним залишком;
В атомами Гідрогену і кислотними залишками;
Г металічним елементом і гідроксильними групами.
- Вкажіть формулу основи:
А Mg(OH)Cl;
Б Ca(OH)2;
В NaНСО3;
Г Fe3O4.
3. Вкажіть формулу гідроксильної групи:
А – OH;
Б – NH2;
В – NO2;
Г – HSO4.
- Вкажіть назву речовини СuОН)2:
А купрум{ІІ) оксид;
Б купрум(ІІ) гідрид;
В купрум(П) гідроксид;
Г купрум(І) гідроксид.
- Вкажіть формулу стронцій гідроксиду:
А Se(OH)2;
Б Sr(OH)2;
В Ca(OH)2;
Г Zn(OH)2.
6 Вкажіть правильне твердження: «Розчинні у воді основи називаються ...»:
А типовими;
Б амфотерними;
В лугами;
Г милами.
7. Вкажіть формулу нерозчинної основи :
А Sr(OH)2;
Б Ba(OH)2;
В Ca(OH)2;
Г СuОН)2.
8. Вкажіть історичну шосту натрій гідроксиду:
А питна сода;
Б їдкий натр;
В бертолетова сіль;
Г вапняна вода.
9. Вкажіть формулу оксиду, який відповідає гідроксиду Сг(ОН)3:
А CrO;
Б Cr2O3 ;
В CrO3;
Г Zn2O3.
10. Вкажіть молярну масу натрій гідроксиду:
В 40 г/моль ;
В 5г/моль ;
Г 74 г/моль .
11. Вкажіть сумарну кількість речовини йонів у формульній одиниці літій гідроксиду:
А 4 моль;
Б 3 моль;
В 2 моль;
Г 1 моль.
Картка 2 «Основи, їх склад, назви»
Варіант ІІ
- Вкажіть загальну формулу основ:
А Me2Oх;
Б Meх(КЗ)у;
В HnКЗ;
Г Me(ОН)n.
- Вкажіть назву речовини Fe(OH)3:
А ферум гідроксид;
Б ферум (ІІ) гідроксид;
В ферум (ІІІ) гідроксид;
Г ферум гідроксид тричі.
3. Вкажіть валентність гідроксильної групи:
А І;
Б ІІ;
В ІІІ;
Г ІV.
4. Вкажіть гідроксид, який за звичайних умов є речовиною блакитного кольору:
А Fe(OH)2;
Б Cu(OH)2;
В Mn(OH)2;
Г Fe(OH)3.
5. Вкажіть формулу алюміній гідроксиду:
А AlOH;
Б Al(OH)2;
В Al(OH)3;
Г Al(OH)4.
6. Вкажіть правильне твердження: «Луги – це…»:
А амфотерні гідроксиди;
Б нерозчинні основи;
В розчинні основи;
Г типові основи.
7. Вкажіть сумарну кількість речовини йонів у формульній одиниці барій гідроксиду:
А 1 моль;
Б 2 моль;
В 3 моль;
Г 4 моль.
8. Вкажіть історичну назву калій гідроксиду:
А їдкий калій;
В купорос;
Б поташ;
Г кухонна сіль.
9. Вкажіть формулу лугу:
А АІ(ОН)3;
В NаОН;
В Zn(0Н)2;
Г Мn(ОН)2.
- Вкажіть спільну фізичну властивість основ:
А розчинність у воді;
Б наявність запаху;
В низька температура плавлення;
Г твердий стан.
11. Вкажіть молярну масу кальцій гідроксиду:
А 104 г/моль ;
Б 74 г/моль;
В 56 г/моль ;
Г 46 г/моль .
VІ. Сприйняття та засвоєння учнями нового навчального матеріалу
Слайд №6
Демонстрація №4. Зразки солей

(На склянках наведені тривіальні назви.)
Слайд №7

Робота з підручником
Вчитель: Скористаймося таблицею 7 підручника с.79 «Склад і назви солей» і назвемо солі, які є на вашому столі.
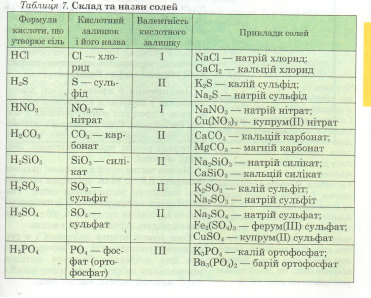
2) CuSO4 — купрум (ІІ) сульфат
3) Na2SO4 — натрій сульфат
4) KMnO4 — калій перманганат
5) KNO3 — калій нітрат
Ферум (II) хлорид — FeCl2
Натрій фосфат — Na3PO4
Алюміній сульфат — Al2(SO4)3
VІІ. Осмислення об’єктивних зв’язків і взаємозалежності у вивченому матеріалі
Клас поділяється на 2 варіанти.
Вчитель: виконайте, будь ласка, письмово завдання 1 с.34
2 учні виходять до дошки і виконують завдання свого варіанта. Всі інші виконують завдання самостійно. Після завершення завдання перевіряєтья правильність виконання, усуваються помилки.
Час на виконання завдання завдання 2-3 хв.

Вчитель: виконайте, будь ласка, письмово завдання 2 с.35
2 учні виходять до дошки і виконують завдання свого варіанта. Всі інші виконують завдання самостійно. Після завершення завдання перевіряєтья правильність виконання, усуваються помилки.
Час на виконання завдання завдання 2-3 хв.
Робочий зошит с. 35 письмово завдання №3, №4

VІІІ. Узагальнення і систематизація знань
Робота біля дошки
Вчитель записує формули оксидів, кислот, солей в хаотичному порядку. Завдання учнів виписати формули оксидів, кислот, солей окремо в стовпчики. Біля дошки працює 1 учень, всі інші самостійно виконують завдання у своєму зошиті.
Вкінці перевіряється правильність виконаного завдання.
Вчитель: Порівняйте три класи сполук за складом. Знайдіть відмінності. Сформулюйте визначення. Що спільного між цими сполуками? Які за складом ці сполуки?
Час на виконання завдання 2-3 хв.
ІХ. Домашнє завдання
Слайд №8




Х. Підсумок уроку
Слайд №9



про публікацію авторської розробки
Додати розробку