Урок "Сучасне формулювання періодичного закону. Ізотопи"
Урок висвітлює питання про ізотопи та сучасне формулювання закону. В розробці використано прийом "Ланцюжок", кросворд, гру "Незакінчене речення", розв'язуються задачі.
1
Тема. Сучасне формулювання періодичного закону. Ізотопи
Всё страшную космическую силу,
Закованную в атомы хранит.
Щипачев.
Мета: продовжувати формувати поняття про хімічні елементи та будову атома; уточнити та поглибити знання учнів про хімічні елементи; ознайомити учнів із поняттям ізотопи та їх видами; ознайомити учнів із згубним та корисним впливом радіації на організм людини; продовжувати формувати науковий світогляд на основі знань про ізотопи; розвивати пізнавальну діяльність, хімічну мову, мислення, увагу, уміння аналізувати.
Методи: опитування, розповідь, кросворд, гра.
Обладнання: комп’ютер, проектор.
Тип уроку: комбінований
ХІД УРОКУ
І. Організаційний момент
ІІ. Перевірка вивченого матеріалу.
* Прийом “Ланцюжок”.
Продовжіть речення:
1. Атом складається із … (позитивно зарядженого ядра, а також електронів, що рухаються навколо ядра по електронним орбіталям і мають від’ємний заряд).
2. Будову атома відкрив … (Резерфорд у 1909 – 1911) таким чином … (досліджував поведінку радіоактивного випромінювання у магнітному полі та помітив, що воно розділяється на 3 пучки. Ці промені він назвав α-, β-, γ-промінням).
3. Формулювання періодичного закону Д.І.Менделєєвим звучить так …
( “Властивості простих речовин, а також форми і властивості сполук хімічних елементів перебувають у періодичній залежності від величини атомних ваг елементів”).
4. Хімічний елемент – це … (сукупність атомів одного виду)
5. Нуклонне число – це … (загальна кількість протонів і нейтронів у атомі).
6. Протонне число – це … (число протонів у ядрі, яке збігається з порядковим номером елемента у періодичній системі).
ІІІ. Мотивація навчальної діяльності учнів.
* Кросворд.
А зараз давайте розгадаємо кросворд
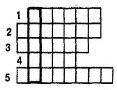 Впишіть у клітинки горизонтально назви елементів або їх частинок. Вертикально прочитаєте прізвище вченого, який відкрив закон сталості складу речовини.
Впишіть у клітинки горизонтально назви елементів або їх частинок. Вертикально прочитаєте прізвище вченого, який відкрив закон сталості складу речовини.
1. Найлегший ізотоп атома гідрогену.
2. Радіоактивний лужний метал.
3. Загальне число протонів і нейтронів у ядрі
4. Напрям руху електрона навколо власної осі.
5. Лужноземельний метал.
Відповіді:
1. –
2. Францій
3. Нуклон
4. Спін
5. Стронцій (-руст)
Бачу, що не на всі питання ви можете дати відповідь. Сьогодні ми спробуємо розглянути таку тему, що допоможе розгадати цей кросворд. Запишіть число, класна робота і тему сьогоднішнього уроку…
IV. Вивчення нового матеріалу.
1. * Слово вчителя.
Отже, як ви вже знаєте, Менделєєв передбачив існування деяких елементів, які ще були невідомі на той час (Скандій (Екабор) – його відкрив у 1879 році шведський хімік Нільсон, назва походить від назви “Скандинавія”, Галій (Екаалюміній) – був відкритий у 1875 році французом Лекоком де Буабодраном у піренейській цинковій обманці, його назва походить від назви країни Франції, Германій (Екасиліцій) – відкрив Клеменс Вінклер у 1886 році в складі мінералу аргіродиту, його назва походить від назви батьківщини Вінклера – Німеччини), також виправив місце положення деяких елементів та їх атомні маси і зробив перестановки в трьох парах хімічних елементів (що це за пари?) (Калій і Аргон, Кобальт і Нікол, Телур і Йод). Тобто відкриття Менделєєва зробило справжній фурор в тогочасній хімічній науці. Але ще не все було зрозуміло, зокрема перестановка трьох пар елементів.
2. * Проблемне запитання.
Чому Менделєєв їх розмістив саме в такому порядку? Адже це суперечило закону, який він сформулював.
3. * Розповідь вчителя.
Саме будова атома, відкрита Резерфордом, допомогла Мозлі на основі експериментів довести правильність розміщення елементів в періодичній системі та дещо уточнити формулювання періодичного закону, яким користуються і сьогодні. Давайте пригадаємо як звучить сучасне формулювання періодичного закону (“Властивості елементів та їх сполук перебувають у періодичній залежності від заряду ядра атома”).
Крім цього було відкрито існування ізотопів хімічних елементів, що дало змогу пояснити чому значення атомних мас хімічних елементів є дробовими числами.
Ізотопи – це вид атомів одного і того ж елемента, які мають однаковий заряд, але різну атомну масу, тобто різні нуклонні числа (див. слайд 1).
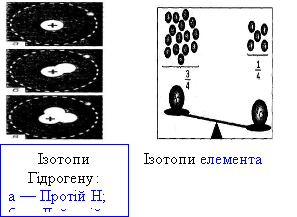 (слайд 1)
(слайд 1)
Ізотопи є стабільні та радіоактивні.
Стабільні ізотопи – це ізотопи, які не здатні до випромінювання. Вони є у більшості елементів.
Радіоактивні ізотопи – це нестійкі ізотопи, що самовільно перетворються на ізотопи інших елементів. Це перетворення супроводжуються радіоактивним випромінюванням, яке є дуже небезпечним для здоров'я живих організмів, особливо в руках безвідповідальних людей (див. слайд 2).
 (слайд 2)
(слайд 2)
Але у мізерних кількостях радіоактивні ізотопи використовуються у біології, хімії, медицині, археології, сучасній техніці, у фізичних експериментах. Атомні станції виробляють майже половину всієї енергії.
4. * Розв’язування задач
Запишіть умову задачі:
Задача 1: Елемент, вищий оксид якого відповідає формулі ЕО3, дає з Гідрогеном сполуку, що містить 2,47% Гідроген. Назвіть цей елемент.
Задача 2: При взаємодії 0,1г деякого металу з водою, утворюється 0,005г водню. Назвіть цей метал, якщо відомо, що він володіє постійною валентністю.
Задача 1:
![]() Дано: М(Н2Е) = 1 ∙ 2 + х = 2 + х
Дано: М(Н2Е) = 1 ∙ 2 + х = 2 + х
ЕО3 2г – 2,47%
Н2Е х – 97,53%
![]() ω(Н) = 2,47% х = 97,53 ∙ 2 / 2,47 = 78,97 (Sе)
ω(Н) = 2,47% х = 97,53 ∙ 2 / 2,47 = 78,97 (Sе)
Е – ?
![]() Задача 2: Ме + хН2О = Ме(ОН)х + Н2
Задача 2: Ме + хН2О = Ме(ОН)х + Н2
Дано: υ(Н2) = 0,005 / 2 = 0,0025 моль
m(Ме) = 0,1г υ(Ме) = υ(Н2) = 0,0025 моль
![]() m(Н2) = 0,005г М(Ме) = 0,1 / 0,0025 = 40г/моль (Са)
m(Н2) = 0,005г М(Ме) = 0,1 / 0,0025 = 40г/моль (Са)
Ме – ?
V. Узагальнення та систематизація знань.
* Гра “Незакінчене речення”.
Давайте пограємось в гру “Незакінчене речення”. Я починаю речення, а ви його продовжуєте:
1. Радіоактивність – це здатність елемента … (Радіоактивністю називають самодовільний розпад нестійких атомних ядер, який супроводжується радіоактивним випромінюванням і утворенням частинок атома, а також інших елементів).
2. Радіоактивний елемент – це елемент, який … (випромінює невидимі промені).
3. Ізотопи – це вид … (атомів одного і того ж елемента, які мають однаковий заряд, але різну атомну масу, тобто різні нуклонні числа). Ізотопи є … (стабільні та радіоактивні).
4. Стабільними називають ізотопи, які … (не здатні до випромінювання).
5. Радіоактивними називають ізотопи, які … (самовільно перетворюються на ізотопи інших елементів).
А зараз давайте повернемось до кросворда (учні розгадують слово, яке вони не змогли розгадати (1. Протій)).
(Пруст)
VI. Домашнє завдання.
Д/з § 32, повторити § 31, вправа 3 ст.151, написати реферат «Шкідливий вплив радіоактивних елементів на здоров'я людей», «”Мирний” атом».


про публікацію авторської розробки
Додати розробку
