Урок "Типи кристалічних граток"


Тема Кристалічні гратки. Залежність фізичних властивостей речовин
від типу кристалічної гратки.
Цілі
Формування ключових компетентностей:
Саморозвитку й самоосвіти – створення проблемних ситуацій, уміння розв’язувати поставлені завдання;
Інформаційної – вміння робити висновки та узагальнення;
Соціально-трудової – спираючись на отримані знання, вміння самостійно працювати, розвивати гнучкість отриманих знань.
Формування предметних компетентностей:
Вивчити основні типи кристалічних граток, з’ясувати залежність фізичних властивостей речовин від типу кристалічної гратки; вміти прогнозувати властивості речовин залежно від типу хімічного зв’язку та типу кристалічної гратки;
Виховувати розуміння того, що результативність роботи залежить від зусиль, вкладених у неї, набутих знань та вмінь.
Тип уроку: вивчення нового матеріалу
Обладнання: періодична система хімічних елементів Д. І. Менделєєва, компютер, словнички-довіднички з хімії
Хід уроку
1.Організаційний момент
Доброго ранку, доброго дня!
Доброго вчора, сьогодні, щодня!
Хай не псується ваш настрій ніколи,
З радістю завжди ступайте до школи.
Хай вам всміхаються діти щодня!
Доброго ранку, доброго дня!
Дзвоник всім нам дав наказ
До роботи взятись враз!
Розпочнемо свій урок,
Тож назад не зробиш крок
Будем ми трудитись гарно,
Не мине й хвилини марно.
2.Актуалізація опорних знань
Наш час – це час змін, творчості, імпульсивності. Тому, як ніколи, потрібні
люди, що вміють творчо мислити, приймати нестандартні рішення, здатні
активно діяти, щоб знайти своє місце в соціумі.
Отже, розпочнемо наш урок на якому будемо учитись вмінню мислити і
діяти.
Вправа «Художня галерея»
- Пропоную здійснити міні-подорож художньою галереєю (на екрані
зявляються пейзажі, на яких зображені різні пори року).
-Визначте, будь ласка, який вид живопису представлений на малюнках
пейзаж)
-У вас на столах також є малюнки з пейзажами осінної пори, а на
зворотньому боці є схема. То ж давайте її озвучимо (діти по черзі озвучують
схему).
Хімічна естафета - учні утворюють три команди, один учень від кожної команди біля дошки виконує завдання, виконавши, передає естафету іншому члену команди. Перемагає та команда яка швидше і якісніше виконає всі завдання.)
Завдання 1.Знайди мене.( знайди сполуку, яка утворена з хімічних елементів з порядковими номерами -15 і 1, 9, 1 і16, 6 і1, 20 і17.( PH3, F2, H2S, CH4, CaCl2)
Завдання 2.Впізнай мене. Визначте тип хімічного зв’язку
Завдання 3. Склади мене. Складіть схему утворення хімічного зв’язку.
Завдання 4. Напиши мене. Написати електронну формулу сполуки
Написати структурну формулу сполуки.
3.Повідомлення теми уроку та мотивація навчальної діяльності
Взаємодію між атомами, молекулами, йонами, завдяки якій частинки
утримуються разом називають хімічним зв'язком. А щоб дізнатися тему нашого уроку скористаємося мобільним звязком, а точніше мобільним телефоном.
На сьогоднішній день ми часто зустрічаємо ось такі QR-коди, які містять певну інформацію. Тому і я вам пропоную прочитати тему нашого уроку, яка зашифрована в цьому коді(на столах лежать коди).
Перед вами тема уроку, яка зашифрована. Щоб її розшифрувати, потрібно замість номера поставити першу літеру елемента з даним порядковим номером.
К 37 и 14 43 18 3 77 ч 10 77 г 37 18 43 19 и 39
Тема нашого уроку Кристалічні гратки. Залежність фізичних властивостей речовин від типу кристалічної гратки(запис в зошити)
-У світі існують мільйони різноманітних речовин і всі ці речовини мають свої властивості. Від чого ж залежать властивості речовин? Про це ми будемо говорити сьогодні на уроці. А все починалося…. З маленького атома, маленького чарівника. Атомоходи, зорельоти, підкорення космосу та морських глибин- усе в ньому. Люди здавна здогадувалися про те, що речовини складаються з найменших частинок. Ці частинки-атоми не існують поодинці, а об’єднуються в групи й утворюють молекули. Атоми й молекули дуже малі, їх можна побачити тільки в електронний мікроскоп. Отже, сьогодні ми поринемо у віртуальний світ атомів і молекул, з’ясуємо як вони об’єднуються, утворюючи різні типи зв’язку, та як це впливає на властивості речовин.
Тому в кінці уроку ми повинні
знати яку будову мають речовини;
що таке кристалічна гратка
які є типи кристалічних граток
уміти визначати типи кристалічних краток,
прогнозувати властивості речовин залежно від типу кристалічних
ґраток.
4. Вивчення нового матеріалу
Я мала змогу також подорожувати і ось, послухайте що я дізналась, а подорожувала я в країну «Твердих речовин» (розповідь вчителя)
Будова твердих речовин
Вам вже відомі такі частинки, як атоми, молекули, йони. За допомогою різних типів хімічних зв'язків вони об'єднуються й утворюють вищу форму організації речовини — хімічні сполуки.
Як поділяються хімічні сполуки? (прості і складні речовини). Залежно від фізичних умов речовини можуть існувати в різних агрегатних станах.
Які ви знаєти агрегатні стани хімічних сполук? ( твердий, рідкий та газуватий стан)
 Агрегатний стан
Агрегатний стан
Усі речовини у твердому стані можуть мати таку будову
|
|
Будова твердих речовин |
|
||
|
|
||||
|
Аморфна |
|
Кристалічна |
||
|
Структурні частинки речовини розміщуються безладно |
|
Структурні частинки речовини розміщуються впорядковано |
||
|
Приклад: глина |
|
Приклад: кухонна сіль |
||
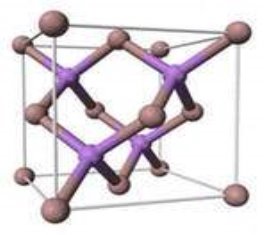
У кристалічних речовинах атоми, молекули та йони розташовані упорядковано, на певних відстанях. Таке закономірне розташування частинок у кристалах називають кристалічною ґраткою. Місця, в яких лінії перетинаються, називають вузлами кристалічних ґраток( демонстрація моделей кристалічних ґраток)
Кристалічні ґратки – модель, за допомогою якої описують внутрішню будову кристалів .
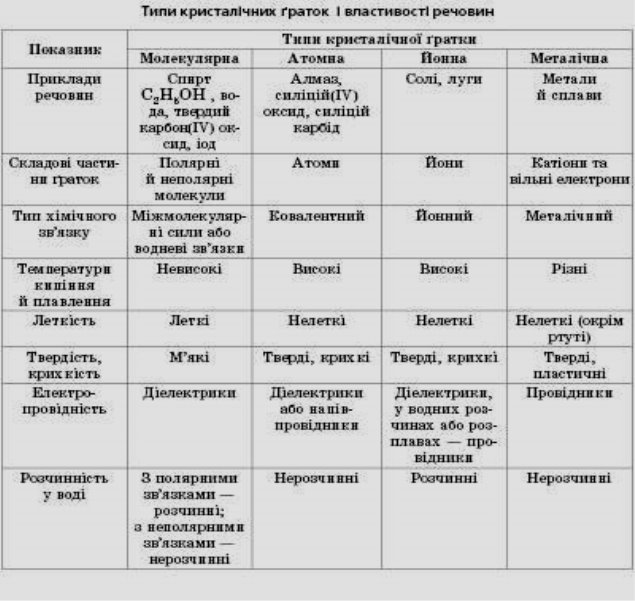
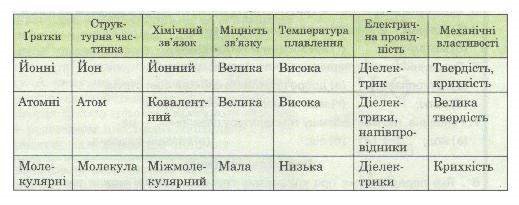
В залежності від частинок, що містяться у вузлах кристалічної гратки, та зв’язків, що їх утримують, розрізняють такі типи кристалічних граток: атомні, молекулярні, йонні
Я пропоную вам здіснити подорож в «Країну кристалів», і якомога більше вивідати про життя атомів в різних кристалічних гратках. І розповісти про це у своїй країні (класі).
Подорожувати ми будемо на великому кораблі. Перш ніж вирушити у дорогу, кожному з вас треба придбати квитки.
В касах квитки купують за гроші, на шоу «Танцюють всі» - танцем, а в школі – знаннями. Тож правильно виконане завдання і квиток ваш.
Вправа «Розсипані атоми» (на картках атоми хімічних елементів; скласти формули ,щоб не залишилося вільних; учень отримує квиток, де вказана країна, до якої подорожує, і його призвіще; так формуються пари)
Класифікація кристалічних ґраток
«Країна атомних кристалів»
«Країна йонних кристалів»
«Країна молекулярних кристалів»
Вирушаймо у подорож. А щоб вона не видалась вам надто довгою, ознайомтесь з планом подорожі.
План подорожі
1. Які частинки лежать у вузлах кристалічної гратки.
Які сили між ними діють.
3. Які властивості виявляють речовини.
4. Навести приклади речовин.
-Ось і ми приїхали на „водне” роздоріжжя, де вас знімуть з корабля і на паромах повезуть кожну пару до різних країн кристалів.
Тож знайдіть свій паром.
Діти по парах опрацьовують матеріал.
І пара – йонні кристалічні гратки;
ІІ пара – атомні кристалічні гратки;
ІІІ пара – молекулярні кристалічні гратки.
-Діти, нам уже час повертатись додому. Маршрут набагато простіший. Закрийте очі і подумки відтворіть опрацьований матеріал. За 2-3 хв. ви вже будете у своїй країні – 8-му класі.
-От і чудово, ви вже дома. Тож давайте прозвітуйте про почуте і побачене у країнах кристалів, де живуть атоми, йони, молекули.
(пари звітують, заповнюючи таблицю на дошці)
Надаємо слово першій парі
Йонна кристалічна гратка
Ми розкажемо про йонну кристалічну гратку.
У вузлах йонних кристалічних граток лежать йони, тому гратки і отримали таку назву – йонні.
Йони бувають позитивні і негативні. У вузлах граток вони розташовані так, що навколо позитивного йона розташовані негативні, а навколо негативного – позитивні.
Наприклад, у кристалічній гратці натрій хлориду, тобто кухонної солі, кожен йон натрію оточений шістьма йонами хлору, а кожен йон хлору оточений шістьма йонами натрію.
Йонні кристалічні гратки характерні для речовин з йонним зв’язком.
Оскільки йони заряджені протилежно, між ними виникають значні сили притягання. Зруйнувати таку гратку нелегко. Для того, щоб зруйнувати кристал, необхідно затратити велику кількість енергії, саме тому всі речовини з йонною граткою є твердими. Температура плавлення їх досить висока. Наприклад, кухонну сіль можна розплавити при температурі 801˚С. Рекордсмен по тугоплавкості серед йонних сполук – магній оксид. Його можна розплавити при температурі 2800˚С.
Це нелеткі речовини, тому не мають запаху. Вони крихкі. Більшість добре розчиняється у воді, розчини таких речовин проводять струм.
Речовини з йонною кристалічною граткою можна зустріти в природі, в побуті. До речовин з йонною граткою відноситься всім відома кухонна сіль – натрій хлорид. Інші солі також мають таку решітку. Луги, наприклад, натрій гідроксид, кальцій гідроксид. Оксиди металів, наприклад, алюміній оксид – Аl2O3.
Атомна кристалічна гратка
Ми подоружували в країну «Атомних кристалів». Я думаю, що ви вже здогадалися, що раз гратка називається атомною, то у вузлах гратки лежать атоми. Перед вами схема будови кристала алмаза. Кожна кулька – це атом Карбону. Всі атоми розташовані один від одного на однаковій відстані. А це схема будови кристала графіту. Тут у вузлах лежать ті ж самі атоми Карбону, але розташування атомів інше – шарувате. Тут немає окремих йонів або молекул. Весь кристал являє собою неначе одну велетенську молекулу.
Між атомами діють ще більші сили притягання, утворюються дуже міцні ковалентні зв'язки. Зруйнувати їх ще важче, ніж зв'язки між йонами. Тому всі речовини з атомними кристалічними гратками дуже тверді, дуже тугоплавкі, нелеткі. Наприклад, температура плавлення алмаза становить 3500˚С. Крім того, алмаз є самою твердою речовиною в природі.
Ці речовини не розчиняються у воді. Вони не проводять струм, або бувають напівпровідниками.
Атомні гратки має невелика кількість речовин. Це алмаз, з якого роблять діаманти, алмазом ріжуть скло, бурять гірські породи. Зараз у кожного з вас теж є речовина з атомною кристалічною граткою. Це графіт, який знаходиться в олівцях. Нам добре знайомий пісок – SO2. Це також речовина з атомною граткою. Цей предмет, я думаю, вам також знайомий. Ним точимо ножі, сапи завдяки його великій твердості. Називається речовина – силіцій карбід. У його кристалічній гратці чергуються атоми Карбону і Силіцію. Саме ці атоми утворюють атомну кристалічну гратку.
Молекулярна кристалічна гратка
Ще один тип граток, що існує в природі, – молекулярні кристалічні гратки. Речовини з такими гратками дуже відрізняються від речовин з йонними та атомними гратками. Причина полягає в тому, що у вузлах лежать молекули. На цьому малюнку зображена кристалічна гратка йоду. У вузлах гратки розташовані молекули йоду – І2. А на цьому малюнку зображена гратка вуглекислого газу. За певних умов він може ставати твердим, тоді його називають сухим льодом. У вузлах лежать молекули СО2. А ось це модель кристалу звичайного льоду. У його вузлах лежать молекули води – Н2О. Молекулярні кристалічні гратки можуть утворювати речовини, що мають ковалентні зв’язки.
Між молекулами діють дуже слабкі сили міжмолекулярного тяжіння. Якщо сили притягання слабкі, то й зруйнувати їх дуже легко. Тому всі речовини із молекулярною кристалічною граткою мають невелику твердість, вони легкоплавкі. Наприклад, кристали йоду можна розплавити про 30˚С, а лід плавиться вже при 0˚С. Це леткі речовини, тому майже всі мають запах. Пригадайте нафталін, яким відлякують міль від одягу, що зберігається в шафах. Речовини з молекулярною граткою не проводять струм. Вони мають різну розчинність у воді.
Речовини з молекулярною граткою дуже поширені. Я вам покажу деякі з них. Ось кристали йоду. Спиртовий розчин йоду використовують в медицині, він є у кожного із нас вдома. А це цукор. Звичайний цукор, з яким ми п’ємо чай. Молекулярну гратку має лід. Досить його дістати із холодильника, як він починає танути, що доводить наявність молекулярної гратки.
Залежність фізичних властивостей речовин від типу кристалічної гратки
Лабораторний дослід ст.74 у підручнику; таблиця
Вправа «Встановити послідовність»
Пропоную вам встановити причиново-наслідкові зв’язки між будовою та властивостями речовин. Перед вами картки із певними термінами. Розташуйте їх в такій послідовності, щоб простежувався причиново-наслідковий зв’язок.
Будова тип хімічного тип кристалічної фізичні
атома звязку гратки властивості
Визначення типу кристалічних граток
-Як же можна визначити тип кристалічних граток? У кожного на парті є словнички-довіднички, де міститься інструкція визначення типу кристалічних ґраток.
Інструкція з визначення типу кристалічної гратки
Визначити до якої групи відноситься дана речовина:
-
Проста речовина – визначити метал чи неметал:
- Ме – мають металічну кристалічну гратку;
- неМе – мають молекулярну кристалічну гратку;
- винятки – деякі неМе мають атомну кристалічну гратку.
-
Складна речовина – визначити клас речовини:
- МехОу – йонну кристалічну гратку;
- неМехОу – молекулярну кристалічну гратку;
- Ме(ОН)х – йонну кристалічну гратку;
- НхAn – йонну кристалічну гратку;
MeхAnу – йонну кристалічну гратку.
Використаємо її на практиці.
5.Закріплення матеріалу
Визначити тип кристалічних граток хімічних сполук: Са, О2, SO3, HCl,
«Хімічний конструктор»
З карток складіть формули речовин з атомними, молекулярною та йонною
кристалічною гратками.
Виправити помилки:
Атомна кристалічна гратка: Cl2, Fe, N2, H2O, C
Молекулярна кристалічна гратка: H2O, KCl, O2, CO2, Au
Йонна кристалічна гратка: NaCl ,CaCl2, Br2, NaBr, SO2
Вправа «Я знаю…»
-Азот переходить у твердий стан за низької температури (-210˚С). Який тип гратки має азот? (молекулярна)
-Яка з речовин характеризується більшою твердістю – лід чи пісок? Як ви це можете пояснити? (лід має молекулярну, а пісок атомну гратку)
-Елементи С і Sі утворюють схожі за складом оксиди СО2 і SіО2, але СО2 плавиться при -78.5˚С, а SіО2 при +1700˚С. Як ви це можете пояснити? (різні кристалічні гратки)
-Білий фосфор плавиться при +44,2˚С. Яку кристалічну гратку має білий фосфор? (молекулярну)
-Червоний фосфор плавиться при +600˚С. Яку кристалічну гратку має червоний фосфор? (атомну
Вправа «Обговоримо»
Знати яку будову мають речовини
що таке кристалічна гратка
які є типи кристалічних граток
уміти визначати типи кристалічних краток,
прогнозувати властивості речовин залежно від типу кристалічних
ґраток.
Хвилинка-цікавинка
-Послухайте легенду.
Арабська легенда
Bдавні-предавні часи засперечались Золото з Алмазом, хто з них на землі поважніший та сильніший. Довго тривала суперечка. І тоді звернулись вони з своїм питанням до вічного світила. Я не чую вас -відповіло Сонце - Підійдіть ближче і тоді розповісте, про що ви сперечаєтесь. Золото і Алмаз пішли по Чумацькому Шляху і наблизились до Сонця. Але тут золото почервоніло, зблідло і розплавилось, пролилось на Землю золотим дощем, а Алмаз повернувся на землю таким же блискучим і твердим, яким був раніше. З того часу Золото ніколи, більше не сперечалось з Алмазом, раз і назавжди поступившись йому.
-Твердість мінералів можна визначити за шкалою Маоса. За цією шкалою найтвердішим мінералом є алмаз.
Екологічна хвилинка
6.Підсумки уроку
Саморефлексія.
Твердість більшості мінералів оцінюють за шкалою твердості (шкалою Мооса), порівнюючи їх з алмазом.
|
Еталонний мінерал |
Твердість |
Оброблюваність |
|
Тальк |
1 |
Дряпається нігтем |
|
Гіпс |
2 |
|
|
Кальцит |
3 |
Дряпається мідною монетою |
|
Флюорит |
4 |
Дряпається ножем, склом |
|
Апатит |
5 |
|
|
Ортоклаз |
6 |
Дряпається напильником |
|
Кварц |
7 |
Обробляється алмазом, дряпає скло |
|
Топаз |
8 |
|
|
Корунд |
9 |
|
|
Алмаз |
10 |
Ріже скло |
Як підсумок оцініть міцність своїх знань, порівнявши їх з відповідним мінералом.
- Хто сьогодні був «алмазом»?
- Хто відчуває себе невпевненим «кальцитом»?
Сподіваюся, що на наступному уроці ви всі будете сяяти як справжні діаманти.
Домашнє завдання
д/з написати враження у вигляді QR коду
Завдання до уроку.
З перелічених речовин випишіть речовини у порядку зростання міцності кристалічної гратки, вказати тип кристалічної гратки речовин:карбон, цинк оксид, хлоридна кислота, сульфур(ІV) оксид, барій гідроксид, натрій.
Завдання для самоконтролю
1. У чому полягає відмінність йонних, атомних і молекулярних кристалічних ґраток?
2. Як, знаючи фізичні властивості речовини, можна дійти висновку про тип її кристалічних ґраток? Покажи на прикладі.
3. Поясни причину відмінності температури плавлення речовин із різним типом кристалічних ґраток.
4. За якими ознаками можна віднести до речовин з молекулярними кристалічними ґратками: а) лід; б) нафтален?
5. Молекулярні кристалічні ґратки можуть мати речовини з хімічним зв'язком
(а) йонним; (в) ковалентним полярним;
(б) металічним; (г) ковалентним неполярним.
6. Речовини з молекулярними кристалічними ґратками
(а) легкоплавкі; (в) добре проводять електричний струм;
(б) леткі; (г) мають низьку теплопровідність.
7. Речовина, що має найвищу температуру плавлення, — це
(а) йод; (б) лід; (в) кальцій флуорид.
Додаткові завдання
8*. Яке передбачення про кристалічні ґратки речовини можна висловити, якщо відомо, що за стандартних умов вона перебуває у газуватому стані, а за температури - 40 °С ця речовина являє собою безбарвні кристали, які не проводять електричний струм?
9*. Речовина, хімічні зв'язки в якій сформовані між атомами елементів із зарядами ядер +1 і +16, у твердому стані має кристалічні ґратки
(а) йонні; (б) молекулярні; (в) атомні.
10*. Речовина, утворена елементами із скороченими електронними конфігураціями атомів...3s13p0 і...3s23p5, має кристалічні ґратки
(а) атомні; (б) йонні; (в) молекулярні.
1


про публікацію авторської розробки
Додати розробку
