Урок узагальнення і систематизації знань в 9 класі з теми «Розчини»
Урок узагальнення і систематизації знань в 9 класі
з теми «Розчини»
Мета. Навчальна: узагальнити, закріпити і скоригувати знання учнів з теми «Розчини», закріпити вміння складати рівняння реакцій в іонному вигляді, систематизувати теоретичні знання, необхідні для розв’язування розрахункових задач на обчислення масової частки розчиненої речовини.
Розвиваюча: розвивати вміння учнів розв'язувати розрахункові задачі, розвивати пам’ять, увагу, спостережливість; уміння логічно мислити та робити відповідні висновки.
Виховна: виховувати культуру спілкування, почуття колективізму, вміння застосовувати знання в нестандартних ситуаціях.
Тип уроку: урок узагальнення і систематизація знань, умінь, навичок.
Форма проведення: урок – турнір.
Методи: словесний, наочний,практичний.
Форми роботи: колективна робота, робота в групах.
Міжпредметні зв`язки: біологія, історія, фізика
Обладнання:
Періодична система хімічних елементів Д.І. Менделєєва; таблиця
розчинності кислот, основ, солей у воді; штатив із пробірками, підручник «Хімія», 9 кл.
Реактиви:
розчини купрум (ІІ) сульфату, натрій гідроксиду, барій хлориду, сульфатної кислоти, хлоридної кислоти, натрій карбонату, розчин фенолфталеїну.
Базові поняття і терміни: розчин, розчинник, розчинена речовина, електроліти, неелектроліти, електролітична дисоціація, йони, катіони, аніони.
Хід уроку:
І. Організаційний етап. Привітання. Налаштування учнів на робочий настрій. Інструктаж з БЖД
ІІ. Оголошення теми і мети уроку. Ознайомлення учнів з планом проведення уроку.
При підготовці до уроку клас об`єднано в три команди:
«Електроліти», «Катіони», «Аніони»
Обрано капітанів команд. Учні заздалегідь ознайомлені з переліком конкурсів.
ІІ Основна частина уроку
2.1. Мотивація пізнавальної діяльності вступне слово вчителя.
На сьогоднішньому уроці ми маємо узагальнити, систематизувати та поглибити знання про розчини, закріпити вміння складати, молекулярні, повні та скорочені йонні рівняння, розв’язувати задачі, а також перевірити, як ви умієте застосовувати знання в нестандартних ситуаціях, бо як сказав великий Гете:
«Просто знати – це ще не все, знання потрібно вміти використовувати».
Отже, бажаю вам успіху!
2.2. Інтерактивне бліц – опитування (5 – 6 хв.)
1 правильна відповідь – 1 бал.
Максимальну кількість балів отримує команда яка має більшу кількість правильних відповідей.
Питання:
1. Як класифікують дисперсні системи?
2. Що таке розчин?
3. Назвіть головні компоненти розчину?
4. Яка характерна ознака розчинів?
5. Наведіть приклади розчинів в побуті.
6. За розчинністю у воді всі речовини поділяють на 3 групи. Назвіть ці групи?
7. Що таке масова частка розчиненої речовини?
8. Що таке електролітична дисоціація?
9. Основна причина дисоціації?
10. Що таке електроліти?
11. Які речовини належать до електролітів?
12. Що таке неелектроліти?
13. Що таке катіони?
14. Що таке аніони?
15. Що таке кислоти з точки зору ТЕД?
16. Що таке солі з точки зору ТЕД?
17. Що таке луги з точки зору ТЕД?
18. Які реакції називають реакціями йонного обміну?
19. Назвіть умови перебігу реакція в розчинах до кінця?
20. Які реакції називають необоротними реакціями?
21. Які реакції називають оборотними?
2.3. Перший конкурс. Історичний (Максимальна кількість - 3 бали).
Капітани команд отримують завдання. За 2 хвилини учні кожної команди повинні назвати прізвище вченого.
1. Назвіть прізвище англійського вченого, дослідження якого більше стосуються фізики, але саме він виявив хімічну дію електричного струму, відкрив закони електролізу і вперше запропонував поділ речовин на електроліти і неелектроліти.
(М. Фарадей )
|
М.Фарадей запропонував декілька найважливіших понять, які використовуються і в наш час. Він ввів поняття «електроліз», «електроліт», «електрод», «анод», «катод». Частинки, що утворюються при електролізі, Фарадей називав йонами, які залежно від напрямку їх руху в електроліті поділяв на аніони і катіони.)
|
(М. Фарадей 1791—1867 ) 
2. Назвіть прізвище російського вченого, автора Періодичного закону та Періодичної системи хімічних елементів. В 1865 році він захистив докторську дисертацію «Про сполучення спирту з водою і розуміння розчинів як асоціатів». (Д.І. Менделєєв )
|
В 1905 году Д. И. Менделеев скажет: «Всего более четыре предмета составили моё имя, периодический закон, исследование упругости газов, понимание растворов как ассоциации и „Основы химии“. Тут моё богатство. Оно не отнято у кого-нибудь, а произведено мною…».)
|
(Д.І. Менделєєв 1834-1907) 
3. Назвіть прізвище шведського фізика і хіміка, члена кореспондента Петербурзької академії наук, (з 1903 року) і почесного члена Академії наук СРСР ( з 1925 року), автора теорії електролітичної дисоціації (1887 рік) лауреата Нобелівської премії (1903 року).
|
С.Арреніус в 1903 — отримав Нобелівську премію з хімії, «як факт визнання особливого значення його теорії електролітичної дисоціації для розвитку хімії». Виступаючи від імені Шведської королівської академії наук, Х. Р. Тернеблад підкреслив, що теорія іонів Арреніуса заклала якісну основу електрохімії, «дозволивши застосовувати до неї математичний підхід».)
|
(Сванте -Август Арреніус
1859—1927) 
Другий конкурс. Конкурс капітанів. (Максимальна кількість - 3 бали).
Капітани заздалегідь підготували один одному по 1 питанню з теми «Розчини».
1. Коли не зсідається кров?
(Кров, позбавлена катіонів кальцію, не зсідається на повітрі. Якби в ній не було йонів Кальцію, то від найменшої подряпини організм загинув би від повної втрати крові).
2. Чому після викачування концентрованої сульфатної кислоти (H2SO4) або олеуму стальні цистерни потрібно щільно закривати?
(Після того як концентровану сульфатну кислоту( H2SO4 ) або олеум буде викачано зі стальних залізничних цистерн, їх необхідно відразу щільно закрити. Якщо ж люк цистерни відкритий, то залишки H2SO4 жадібно вбиратимуть атмосферну вологу, а розведена кислота роз’їдатиме залізо. Концентрована сульфатна кислота пасивує поверхню заліза.)
3. Чому кислоти кислі і які з них найкисліші?
(Кислий смак кислот пояснюється наявністю в них йонів гідроксонію, які утворюються при взаємодії молекул кислот з молекулами води. Сила кислот визначається ступенем їх дисоціації та рухливістю катіонів Гідрогену. Найрухливіші катіони Гідрогену( Н+ ) в розчині хлорної кислоти НСІО4.
Третій конкурс «Мудрі рецепти» (Максимальна кількість - 5 балів).
Команди повинні розв’язати задачі з використанням поняття «Масова частка розчиненої речовини в розчині».
1. Ягоди залийте 200 г сиропу з масовою часткою цукру 0,3 (30%). Скільки цукру і води треба взяти для приготування цього сиропу?
(60 г цукру, 140 г води).
2. Приготуйте 70 г содового розчину з масовою часткою соди 0,2 (20%). Скільки соди і води для цього треба взяти?
(14 г соди 56 г води).
3. Скільки йоду і спирту треба взяти аптекарю для приготування 200 г. розчину з масовою часткою йоду 0,05 (5%)?
(10 г йоду і 140 г спирту)
Висновок:
Масова частка показує кількісний склад розчинів, тобто яку частку від загальної маси розчину складає маса розчиненої речовини.
Четвертий конкурс «Риболовля» (Максимальна кількість - 3 бали)
Учитель. В бліц-опитуванні ми з вами згадали що таке електроліти і неелектроліти.
За 2 хвилини команди повинні виловити формули електролітів.
№ 1. NaOH, СО2, НNO3, ВаСІ2, Fе2О3, Н2, С12Н22О11, Аl2(SO4)3
№ 2. Н3РО4, Ва(ОН)2, SО2, NаСІ, АІ2 О3, Fе, С2Н5ОН, K2SiO3
№ 3. Н2SО4, КОН, SО2, Мg (NО3)2, МgО, Аl, C6Н14, Cr2(SO4)3
Висновок:
Електроліти - це речовини, розчини яких проводять електричний струм завдяки розпаду на йони.
П’ятий конкурс «Ідеальна пара» (Максимальна кількість-4 бали)
Визначте, одночасне перебування яких йонів у розчинах приведе до їх зв`язування і утворення осаду, газу чи води.
![]()
![]()
![]()
№ 1.
![]()
![]()
![]()
№ 2.
![]()
![]()
![]()
№ 3.
Висновок: Умовами перебігу реакції до кінця являються: виділення газу, випадіння осаду, утворення малодисоційованої речовини (води).
Шостий конкурс. Експериментальний (Максимальна кількість-5 балів).
№ 1. Яку пару речовин треба взяти, щоб хімічна реакція була необоротною. Запишіть рівняння в молекулярному, повному та скороченому йонному вигляді. Підтвердіть дослідом.
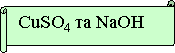

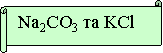
№ 2. Яку пару речовин треба взяти, щоб хімічна реакція була необоротною. Запишіть рівняння в молекулярному, повному та скороченому іонному вигляді. Підтвердіть дослідом.


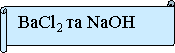
№ 3. Яку пару речовин треба взяти, щоб хімічна реакція була необоротною. Запишіть рівняння в молекулярному, повному та скороченому іонному вигляді. Підтвердіть дослідом.
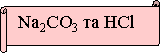
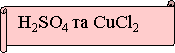
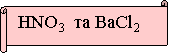
Висновок конкурсу:
Реакції обміну між розчином електролітів є необоротними за трьох умов: випадіння осаду, виділення газу, утворення малодисоційованої речовини (води).
ІІІ. Підбиття підсумків уроку.
Вчитель підводить підсумки уроку, визначає команду – переможця.
ІV. Домашнє завдання:
1.Повторити класифікацію хімічних реакцій.
2. Скласти кросворд з ключовим словом «Електроліт».
3. Задача для учнів з високим рівнем навчальних досягнень.
* Обчисліть масу води, потрібної для розбавлення 200 г 75%-го розчину сульфатної кислоти, щоб отримати розчин із масовою часткою сульфатної кислоти 15%.


про публікацію авторської розробки
Додати розробку
