Урок.Узагальнення знань з теми «Хімічні реакції»
Тема: Узагальнення знань з теми «Хімічні реакції»
Мета уроку: узагальнити та скоригувати знання учнів з теми «Хімічні реакції»; з’ясувати рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці; розвивати логічне мислення та комунікативні здібності учнів, хімічну мову, вміння аналізувати; збагачувати науковий світогляд учнів, формувати позитивне ставлення до навчання, зацікавленість хімією як наукою, вчити учнів будувати аргументовані відповіді, висловлювати і доводити свою точку зору, виховувати вміння працювати в колективі.
Тип уроку: урок узагальнення й систематизації знань
Форма проведення: урок-семінар
Форми роботи: робота з мультимедійними засобами навчання, робота з таблицею, тестами, картками, робота в парі, малих групах, колективна.
Обладнання: Періодична система хімічних елементів Д.І Менделєєва, таблиця розчинності, ряд активності металів, картки-завдання, тести, мультимедійні засоби навчання (проектор,комп’ютер )
Формування компетентностей:
- комунікативної – під час спілкування усною рідною мовою та хімічною мовами;
- інформаційної – завдяки використанню додаткової інформації, одержаної з різних джерел;
- навчальної – у процесі складання формул, написанні рівнянь, виконання вправ;
- соціальної –формулювання висновків, узагальнень;
- загальнокультурної – під час використання міжпредметних зв’язків із математикою (при розв’язуванні задач), української мови;
- саморозвитку і самоосвіти –під час розвитку готовності постійно навчатися.
Девіз уроку: «Чим більше в мене справ,
тим більше я вчуся»
(М.Фарадей)
ХІД УРОКУ
- Актуалізація і мотивація навчальної діяльності
Сьогоднішній урок ми проведемо у формі семінару. Наша мета – узагальнити і систематизувати знання про класифікацію хімічних реакцій за різними ознаками з метою підготовки до контрольної роботи; удосконалити вміння працювати самостійно, допомагати іншим, працюючи в групі.
Клас ділиться на три груп: «Каталізатори», «Окисники», «Відновники»
- Узагальнення та систематизація набутих знань
- Хімічна розминка
- Творча вправа «Синоніми» (кожній групі по три запитання)
(Слово, близьке або тотожне значенням до іншого, але відмінне від нього звуковою формою)
- Реакція під час перебігу якої з декількох речовин утворюється одна- … (Сполучення)
- Реакція, між двома складними речовинами, в результаті якої утворюються дві нові складні речовини (Обміну)
- Зміна концентрації речовини за одиницю часу (Швидкість хімічної реакції)
- Кількість теплоти, що виділяється або поглинається під час хімічної реакції (Тепловий ефект реакції).
- Рівняння, у якому вказано тепловий ефект (Термохімічне)
- Стан, коли швидкість прямої реакції дорівнює швидкості зворотної реакції (Хімічна рівновага)
- Біологічний каталізатор (Фермент)
- Атом, молекула або йон, які приєднують електрони (Окисник)
- Атом, молекула або йон, які віддають електрони (Відновник)
- Творча вправа «Антоніми» (кожній групі по два запитання)
(Антоніми (гр. anti - проти та опута - ім’я) – це слова, які мають протилежне значення)
- Інгібітор – (Каталізатор)
- Розклад –(Сполучення)
- Екзотермічна реакція – (Ендотермічна реакція)
- Гомогенний- (Гетерогенний)
- Виділення газу – (Випадання осаду)
- Окисник – (Відновник).
- Проблемна ситуація «Реставратор»
Завдання. Відновити таблицю заповнивши порожні клітинки.
На дошці заздалегідь намальована таблиця. Учні працюють біля дошки по бажанню.
Класифікація хімічних реакцій
|
За зміною кількості вихідних і кінцевих речовин |
……… Реакції розкладу ……… ……… |
|
За тепловим ефектом |
……… ……… |
|
|
……… некаталітичні |
|
За напрямом протікання |
……… ……… |
|
За ознакою зміни ступеня окиснення атомів |
……… ………. |
|
|
Гомогенний …………… |
Завдання 3.«Біла ворона» (Робота в парах)
Кожна пара отримує картку, на якій записано завдання. Після цього один учень від кожної пари записує на дошці виконане завдання.
Завдання «Біла ворона». Вибрати йони , які не можуть разом перебувати в розчині
- K+, Cl-, Na+, SO42-, Li+,Mg2+, H+, Ag+, Fe3+, NO3-
- K+, Ba2+, Al3+, Na+, SO42-, Li+, Br-, Mg2+, H+, Fe3+, NO3-
- K+, Ba2+, Al3+, SO32-, Ag+, Na+, OH-, Li+ , NO3-
- K+, PO43-, Na+, SO42-, Li+, CO32-,Mg2+, H+, Fe3+, NO3-
- Ca2+, K+, PO43-, Na+, SO42-, Li+,Mg2+, H+, NO3-
- K+, Cl-, PO43-, Na+, SiO32-, OH-, Li+, CO32-, H+, NO3-
- K+, Cl-, Zn2+, Na+, SO42-, OH-, Li+, H+, NO3-
- K+, Cl-, Na+, SO42-, Li+, CO32-,Mg2+, H+, NO3-
- K+, Cl-, Na+, SO42-, OH-, Li+, CO32-, H+,Ca2+.
Відповідь:
- Ag+ i Cl-
- Ba2+ i SO42-
- Al3+ i OH-
- Fe3+ i PO43-
- Ca2+ i PO43-
- H+ i SiO32-
- Zn2+ i OH-
- Mg2+ i CO32-
- Ca 2+ i CO32-
Завданна 4. На карточках для кожної групи
І, ІІ групи. Що зашифровано на малюнку
Додаток 1
Додаток 2.
ІІІ група. Художнику доручили ілюструвати підручник хімії для дев'ятикласників. Хімічні реакції розкладу, сполучення, заміщення, обміну він зобразив у такий спосіб. Оцініть, чи правильно художник змоделював хімічні реакції різних типів. Обґрунтуйте свій експертний висновок. 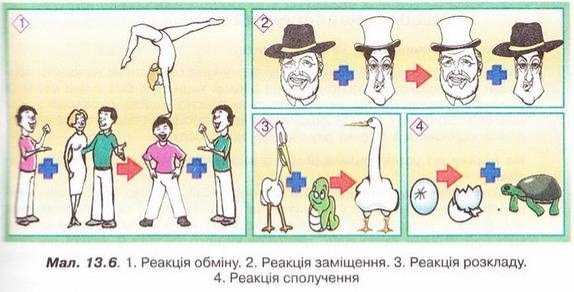
5. Творче завдання: рольова гра «Я – хімік-технолог»
Завдання для учнів: уявіть себе хіміком-технологом на заводі і охарактеризуйте запропоновану хімічну реакцію, обґрунтуйте вибір умов протікання, способів підвищення швидкості реакції та зміщення хімічної рівноваги.
Для виконання завдання групи отримують картки із матеріалами опису виробництва, планом відповіді. Схема виробництва проектується на інтерактивній дошці.
Після виконання відповіді обговорюються ( відповіді даються за принципом диференціації – одні записують рівняння, інші пояснюють), коригуються, оцінюються учнями в класі.
Завдання для груп:
І Група «Каталізатори»
1.Виробництво сульфатної кислоти починається з випалу піриту FeS2 – це перша стадія виробництва.
2.Складіть рівняння випалу піриту, вкажіть тип реакції.
3. Обґрунтуйте вибір вихідних речовин і умов здійснення реакції; фактори, що впливають на швидкість хімічної реакції.
ІІ Група «Окисники»
1.Друга стадія виробництва сульфатної кислоти – окиснення сульфур (IV ) оксиду до сульфур( VI) оксиду.
2.Запишіть рівняння реакції, вкажіть її тип.
3. Обґрунтуйте вибір вихідних речовин і умов здійснення реакції; фактори, що впливають на швидкість хімічної реакції.
ІІІ Група «Відновники»
1.Третя стадія – одержання сульфатної кислоти.
2.Запишіть рівняння реакції, вкажіть її тип.
3. Обґрунтуйте вибір вихідних речовин і умов здійснення реакції; фактори, що впливають на швидкість хімічної реакції.
Роби з нами, роби, як ми, роби швидше за нас (Індивідуальна робота).
Розв’язування розрахункової задачі. Біля дошки працює сильний учень, інші мають можливість працювати колективно або самостійно на випередження.
Задача: За термохімічним рівнянням С + О2 =СО2 ; ∆ Н =+410 кДж обчисліть кількість речовини вуглекислого газу, якщо виділилося 20,5 кДж теплоти.
Завдання. Проставити ступені окиснення, розставити коефіцієнти.
Окисно - відновні реакції
1) N2 + O2 → NO
2) NO + O2 → NO2
3) H2S + O2 → SO2 +H2O
4) H2S + SO2 →H2 SO4 + S
5) Fe + O2 + H2O → Fe(OH)2
6) Fe(OH)2 + O2 + H2O → Fe(OH)3
7) FeO + C → Fe + CO
8) Cr2O3 + Al → Cr + Al2O3
9) V2O5 + H2 → V + H2O
10) KClO3 + S → KCl + SO2
11) P + CI2 → PCI3
12) Si + CI2 → SiCI4
13) Sn + HCI →SnCI2 + Н2
14) Н2 +О2 →Н2О
15) Zn + HCl →ZnCl2 + H2
16) C +O2 → CO
17) C+ O2 →CO2
18) Mg + HСl = MgСl2 + H2
III. Підведення підсумків. Оцінювання учнів
IV. Домашнє завдання
Повторити параграфи розділу, виконати письмові завдання.
Хвилинка психологічного та фізичного розвантаження
Творче завдання для допитливих . Учні 8 класів, які відвідують факультатив з хімії підготували для вас магічне завдання, яке називається «Невидимі чорнила» Джеймса Бонда я їх продемонструю.
Обприскуємо листок паперу, на якому попередньо було написано жовтою кров’яною сіллю «Ми любимо хімію», розчином ферум (ІІІ) хлориду. На чистому листку появляються слова.
Завдання. Знайти цю реакцію, записати рівняння реакції. Визначити до якого типу воно відноситься.
Відповідь.
4FeCl3+ 3K4[Fe(CN)6] →K4[Fe(CN)6]3+12KCl
жовта кров’яна сіль берлінська лазурь


про публікацію авторської розробки
Додати розробку
