Урок.Узагальнення знань з теми «Кисень».
Тема: Узагальнення знань з теми «Кисень».
Мета:
А) формувати ключові і предметні компетенції:
1 - спілкування державною мовою - використовувати в мовленні хімічні терміни, поняття, символи, сучасну українську наукову термінологію і номенклатуру, аргументовано описувати хід і умови проведення хімічного експерименту, обговорювати результати дослідження і робити висновки;
3 - математична компетентність - застосовувати математичні методи для розв‘язування завдань хімічного характеру, використовувати логічне мислення;
4- основні компетентності у природничих науках і технологіях - проводити досліди з речовинами з урахуванням їхніх фізичних і хімічних властивостей, використовуючи знання з інших природничих предметів;
5 - інформаційно-цифрова компетентність - використовувати сучасні пристрої для добору хімічної інформації;
6-уміння вчитися впродовж життя - спостерігати хімічні об’єкти та проводити хімічний експеримент, виявляти допитливість щодо хімічних знань;
10 - екологічна грамотність і здорове життя - усвідомлювати причинно-наслідкові зв’язки у природі і її цілісність. використовувати хімічні знання для пояснення користі і шкоди здобутків хімії і хімічної технології для людини і довкілля.
Б) реалізувати наскрізні лінії: «Громадянська відповідальність», «Здоров’я і безпека», «Екологічна безпека і сталий розвиток», «Підприємливість і фінансова грамотність».
Очікувані результати навчально-пізнавальної діяльності:
знаннєвий компонент: учень називає склад молекул кисню, оксидів, якісний та кількісний склад повітря, пояснює суть реакцій розкладу і сполучення, процесів окиснення, колообігу Оксигену;
діяльнісний компонент: описує поширеність Оксигену в природі; його фізичні властивості, складає рівняння реакцій: добування кисню з гідроген пероксиду; кисню з воднем, вуглецем, сіркою, магнієм, залізом, міддю, метаном, використовує лабораторний посуд, дотримується інструкції щодо виконання хімічних дослідів;
ціннісний компонент: обгрунтовує застосування кисню, оцінює значення кисню в життєдіяльності організмів, вплив людини на стан довкілля, усвідомлює наслідки небезпечного поводження з вогнем. Відповідальність за збереження повітря від шкідливих викидів.
Тип уроку: урок узагальнення і систематизації знань.
Форми організації освітнього процесу: фронтальна, групова, індивідуальна.
Методи навчання: словесні, частково-пошукові, практичні ( демонстраційний експеримент), інтерактивні.
Реактиви і обладнання: таблиця «Періодична систем хімічних елементів Д.І. Менделєєва», таблиця «Колообіг кисню в природі», cмартфони, QR –код, Інтернет-посилання, пробірки, спиртівка, пробірокотримач, ложечка для спалювання речовини, дерев’яна скіпка, гідроген пероксид, манган (IV) оксид, сірка, мідь.
Хід уроку
А) Організаційний момент.
Ми вивчили ще одну велику тему «Кисень» і сьогодні проводимо урок узагальнення знань. В кінці уроку ви повинні відповісти на запитання чи достатній наш багаж знань, щоб рухатись далі. Урок проведемо у формі подорожі. У вас є «оксигенчики», які ви будете заносити у свою картку самооцінки.
Б) Мотивація навчальної діяльності.
Ми почали вивчення хімічних елементів з Оксигену тому, що Оксиген – найпоширеніший елемент у природі: 20% - у повітрі, 50% - у земній корі, 90% - у воді, Живі організми містять 60% Оксигену. Він утворює сполуки майже з усіма елементами.
Кисень – це речовина, навкруг якої обертається земна хімія. Я.Берцеліус
В)Узагальнення знань з теми «Кисень»
І зупинка Оксиген як хімічний елемент. Кисень як проста речовина. Знаходження в природі.
Гра «так» чи «ні»
1.Оксиген – найпоширеніший елемент на Землі. (+)
2.Відносна атомна маса Оксигену 16. (+)
3.Відносна молекулярна маса кисню 20. (-)
4. Кисень займає 4/5 від складу повітря. (-)
5.Оксиген входить до складу води. (+)
6.Кисень погано розчиняється у воді.(+)
7.Валентність Оксигену дорівнює ІІ. (+)
8. Кисень не підтримує горіння.(-)
9.Зріджений кисень голубого кольору. (+)
ІІ зупинка Фізичні властивості. Добування кисню
А)Тестові завдання
1.У лабораторії кисень добувають:
а) з гідроген пероксиду;
б)з води;
в)з повітря.
2. У промисловості кисень добувають:
а) з калій перманганату;
б)з води;
в)з повітря.
3. Каталізатор –
а) речовина, що сповільнює реакцію;
б) речовина, що прискорює швидкість хімічної реакції, а на кінець залишається незмінною;
в)речовина, що не впливає на швидкість хімічної реакції.
4. Я можна довести наявність кисню в пробірці:
а) по запаху;
б) по кольору;
в) внести тліючу скіпку і вона спалахне.
5. Реакція, в результаті якої з однієї складної речовини утворилось декілька простих або складних речовин називається реакцією
а)сполучення;
б)заміщення;
в)розкладу.
Б) Інтерактивна вправа. «Оксиген. Кисень.»
Виконайте завдання за посиланням https://learningapps.org/6511126
В)Інструктаж з техніки безпеки.
Демонстраційний експеримент
Добування кисню із гідроген пероксиду
Проблемне запитання. Маємо дві речовини гідроген пероксид і гідраргірум(ІІ) оксид. Яку речовину виберемо для добування кисню і чому?
Хід досліду
У пробірку наливаємо 3-4 мл гідроген пероксиду і додаємо манган(IV) оксид. Спостерігаємо бурхливе виділення газу. Щоб довести, що виділяється кисень, треба внести в пробірку тліючу скіпку. Вона яскраво спалахує.
2Н2O2 = 2Н2O + O2↑
ІІІ зупинка «Хімічні властивості кисню»
Проблемне запитання. Кисень – один з найактивніших неметалів. Він займає друге місце по активності після Флуору. Кисень реагує з вуглецем, сіркою, фосфором, міддю, залізом. До складу повітря входить 1/5 кисню. Всі ці речовини зараз знаходяться у класній кімнаті. Чому ми не бачимо ніяких ознак протікання хімічних реакцій?
Відповідь. Реакційна здатність кисню зростає із підвищенням температури.
Друзями моїми стали
І метали, й неметали
Феєрверк влаштую вмить,
Бо в мене усе горить.
1.Демонстраційний експеримент
Горіння сірки у кисні.( реакцію проводимо у витяжній шафі)
Насипаємо порошкоподібної сірки у ложечку для спалювання речовини і нагріваємо у полум’я спиртівки. Речовина спочатку плавиться, а потім горить голубим полум’ям.
S +О2 =SО2 – сульфур(IV) оксид
2S +3О2 =2SО3 – сульфур(VІ) оксид
2.Демонстраційний експеримент
Мідну дротину поміщаємо у полум’я спиртівки, Спостерігамо утворення чорного нальоту. Це утворилась речовина купрум(ІІ) оксид.
2Cu+ O2=2CuO - купрум (II) оксид
3. Взаємодія кисню з простими речовинами (вуглецем, фосфором, залізом).
а) 2С +О2 =2СО – карбон (IІ) оксид
С +О2 =СО2 – карбон (IV) оксид
б) Перегляньте відео «Горіння фосфору в кисні»
за посиланням https://www.youtube.com/watch?v=QB53TwREcF0
4P + 5O2 = 2P2O5 – фосфор(V) оксид
в) Перегляньте відео «Горіння заліза в кисні»
за посиланням https://www.youtube.com/watch?v=8CfN3NQfWK0
2 Fe + O2=2FeO – ферум (IІ) оксид
4Fe +3O2=2Fe2O3 – ферум (IІІ) оксид
Отже, 3Fe +2O2= Fe3O4 – залізна окалина
4. Взаємодія кисню з складними речовинами
СН4 +2О2 = СО2 + 2Н2О
5. Складання формул оксидів. Назва оксидів.
Інтерактивна вправа «Оксиди: формули та назви», посилання
https://learningapps.org/14981631
|
Я живу і не тужу, З ким зустрінуся – дружу. Ми удвох з моїм сусідом Називаємось оксидом. |
MgO – магній оксид Cl2O7 – хлор (VІІ) оксид Al2O3 – алюміній оксид Cr2O3 – хром (ІІІ) оксид |
Висновок Реакції сполучення – це реакція між декількома простими або складними речовинами, в результаті чого утворюється одна складна речовина.
Реакція горіння – це реакція під час якої з’являється полум’я і виділяється тепло.
Повільне окиснення – реакція проходить повільно без полум’я.(ржавіння заліза, скисання молока,
IV зупинка Застосування кисню
Складання асоціативного куща
|
О2 |
при виплавлення сталі |
|
кисневі балони для водолазів, пожежників |
|
|
для різання і зварювання металів |
|
|
кисневі подушки для дихання в медицині |
|
|
зріджений кисень для згорання в космічних ракетах |
|
|
виробництві багатьох хімічних сполук |
V зупинка. Розв’язування задачі на визначення масової частки Оксигену у складній речовині.
Інсценізація
Уявіть, що проходить підписання договору між підприємцем хімічного заводу та поставщиком руди.
Підприємець: Яка несподівана зустріч з однокласниками.
Поставщик: Скільки років ми не бачились після школи?
Підприємець: Багато. Я президент кампанії укрхімпром. Ми налагодили виробництво по добуванню кисню і хочемо закупити сировину високої якості.
Поставщик: У нас сімейний бізнес. А для шкільного друга запропонуємо великий асортимент. Вибирай будь-яку з цього переліку. Усі найвищої якості і принесуть тобі гарний прибуток. Бачу ти засумнівався.
Підприємець: Але все таки, з якої із цих речовин можна добути найбільше кисню?
Поставщик: Однаково з будь-якої. Який резон мені тебе обманювать.
Підприємець: Резону ніякого, але я пораджуся з своїм прес-секретарем.
(входить прес-секретар) Нам тут пропонують три варіанти речовин HgO, H2O2,чи НClO3, а я не знаю яку вибрать. Як ти думаєш де кисню найбільше?
Поставщик:З таким секретарем можна продать будь-що.
Прес-секретар: Я думаю, що треба купувать НClO3, бо в цій формулі атомів Оксигену найбільше, але ми не будемо в такій важливій справі покладатись на інтуїцію.
Підприємець: То що ж нам робить?
Прес-секретар: Заспокойтесь, зараз ми все вирішимо.(набирає номер по телефону) Алло, це консультативне бюро? Нам необхідна допомога експерта найвищої кваліфікації. (до підприємця) Зараз прибудуть.
Підприємець: Проведіть розрахунки і допоможіть нам вибрати найоптимальний варіант.
Задача. У якій з речовин HgO, H2O2 чи КClO3 масова частка Оксигену найбільша?
|
Дано: HgO H2O2 КClO3 |
Розв`язання
1.Обчислюємо відносну молекулярну масу HgО Mr (HgO) = Ar (Hg)+ Ar(O) = 201+16 =217
Обчислимо масову частку Оксигену за формулою:
2.Обчислюємо відносну молекулярну масу H2О2 Mr (H2O2) = 2Ar (H)+ 2Ar(O) = 2+ 32=34 Обчислимо масову частку Оксигену за формулою:
3.Обчислюємо відносну молекулярну масу КClO3 Mr (КClO3) = Ar (К)+Ar(Cl) +3Ar(O) = 39+35,5+48 =217 Обчислимо масову частку Оксигену за формулою:
Відповідь. Масова частка Оксигену найбільша у сполуці H2O2. |
|||||||||||||||
|
Знайти: w1(О) -? w2(О) -? w3(О) -? |
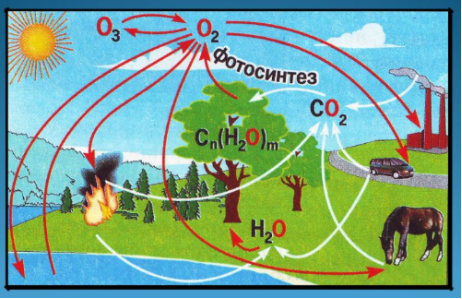
VІ зупинка. Колообіг кисню в природі. Охорона повітря від забруднення.
- Довідка
Рослини – єдині “фабрики” постачання кисню на нашій планеті.
Рослини вбирають з повітря багато шкідливих речовин:
-в місті 30% шуму вбирають рослини;
-1 га зелених насаджень очищає від пилу та шкідливих домішок близько 15 млн. м³ повітря;
-1 доросле вбирає за день 1 кг пилу;
-1 столітній бук вбирає за 1 день близько 2,5 кг вуглекислого газу і виділяє 1,7 кг кисню, цього кисню вистачить для 60 людей протягом доби;
-за 1 день бук випаровує до 400л води і на 10% збільшує вологість ґрунту.
Гра «Мікрофон»
Запропонуйте напрямки охорони повітря від забруднення.
(правильне спалювання палива, будівництво очисних споруд, удосконалення технологічних процесів виробництва, винайдення альтернативних видів палива для транспорту, насадження лісів…)
Г) Підсумки уроку. Чи досягли ми тих цілей, які поставили на початку уроку? Оцініть свої знання. Поставте кількість «оксигенчиків» у свою картку самооцінки.
ВДомашнє завдання.
Повторити параграфи 21,22. Виконати № 170, с.136
Використані джерела:
1) Горіння заліза в кисні. – [Електронний ресурс]. – Режим доступу: https://www.youtube.com/watch?v=8CfN3NQfWK0
2) Горіння фосфору в кисні. – [Електронний ресурс]. – Режим доступу:
https://www.youtube.com/watch?v=QB53TwREcF0
3) Екологічна освіта на уроках хімії. – [Електронний ресурс]. – Режим доступу: https://osvita.ua/vnz/reports/pedagog/14037/
1)МОН України Хімія 7-9 класи Навчальна програма для загальноосвітніх закладів
(затверджена наказом МОН України від 07.06.2017 № 804).
4)Оксиген. Кисень. – [Електронний ресурс]. – Режим доступу:
https://learningapps.org/6511126
5)Оксиди: формули та назви. – [Електронний ресурс]. – Режим доступу: https://learningapps.org/14981631
6)Попель П.П., Крикля Л.С. Хімія 7 клас підручник [для для закладів загальної середньої освіти ] / П.П.Попель, Л.С.Крикля - К.: Академія, 2020, 212 с.
1


про публікацію авторської розробки
Додати розробку
