Урок в 8 класі "Будова атома. Ядро й електронна оболонка. Склад ядер: протони, нейтрони. Протонне число. Нуклонне число".
Мета:
- повторити періодичний закон Д.І.Менделєєва, будову періодичної системи, вивчити будову атома, продемонструвати учням дослід Резерфорда, навчити обчислювати число протонів, нейтронів, електронів в атомі, заряд ядра атома, підвести учнів до сучасного формулювання періодичного закону;
-розвивати вміння застосовувати набуті знання на практиці, критично мислити, аналізувати, порівнювати, робити висновки;
-формувати пізнавальний інтерес до предмету, соціальні компетентності учнів - адекватну самооцінку, доброзичливе ставлення один до одного, вміння слухати, сприяти формуванню наукового світогляду учнів.
Тема. Будова атома. Ядро й електронна оболонка. Склад ядер: протони, нейтрони. Протонне число. Нуклонне число.
Мета: - повторити періодичний закон Д.І.Менделєєва, будову періодичної системи, вивчити будову атома, продемонструвати учням дослід Резерфорда, навчити обчислювати число протонів, нейтронів, електронів в атомі, заряд ядра атома, підвести учнів до сучасного формулювання періодичного закону;
- розвивати вміння застосовувати набуті знання на практиці, критично мислити, аналізувати, порівнювати, робити висновки;
- формувати пізнавальний інтерес до предмету, соціальні компетентності учнів - адекватну самооцінку, доброзичливе ставлення один до одного, вміння слухати, сприяти формуванню наукового світогляду учнів.
Тип уроку: урок засвоєння нових знань
Обладнання до уроку: періодична система хімічних елементів Д.І.Менделєєва, учительська презентація до уроку, ватман, фломастери, опорний конспект, лист самооцінювання, пазли, кольорові картки, картки для відображення психологічного настрою.
Хід уроку
- Організація класу
Привітання з учнями
Слайд 1. Об’єднання в групи. Учні розраховуються на ядро, протон, нейтрон, електрон, після чого об’єднуються у групи з відповідними назвами.
Видача учням опорного конспекту (додаток 1), листи самооцінювання (додаток 2), пазли (додаток 3), кольорові картки, картки для відображення психологічного настрою (додаток 4).
- Мотивація навчання
Учитель. Багато століть триває процес пізнання навколишнього світу. Складаючи періодичну систему, Д.І. Менделєєв розташував всі елементи за зростанням відносної атомної маси, але є суперечності, які він пояснити не міг. Наприклад: Ar і K, Te і I. Чому? Потрібна була нова теорія, яка б пояснила ці протиріччя. На допомогу прийшла фізика. Сьогодні ми об’єднаємо уявлення про будову мікросвіту фізиків і хіміків.
Слайд 2. А яка ж тема сьогоднішнього уроку?
Тему підкажете ви самі. Для цього кожна група складе пазли. Інформацію, яку з них отримаємо, об’єднаємо.
Група, яка склала пазл, записує отриману з них інформацію на ватмані А-4 і представники груп стають перед класом так, щоб утворилось слово. (Групі, яка виконала завдання першою – 2 бали, другою – 1,5 бали, третьою – 1 бал, четвертою – 0,5 бала).
- Повідомлення теми
Слайд 3. На дошку проектуємо тему уроку.
Основна задача уроку: навчитися визначати склад атомів.
- Вивчення нової теми
Учитель. Зараз у людства не існує сумнівів щодо реальності існування атома. Це так же вочевидь, як і обертання Землі навколо Сонця. Який же сенс вкладається в поняття «атом»? Як воно виникло? (учні висловлюють свої припущення).
Слайд 4. Творцем ідеї атома прийнято вважати Демокрита. Легенда розповідає, що одного разу Демокрит сидів на камені біля моря, тримав у руці яблуко і розмірковував: «Якщо я зараз це яблуко розріжу навпіл - у мене залишиться половина яблука, якщо я потім знову розріжу цю половину на дві частини – залишиться чверть яблука; але якщо я і далі буду продовжувати таке ділення, чи завжди у мене в руках буде залишатись 1⁄8,1⁄16 і т.д. частина яблука? Чи в якийсь момент котре ділення приведе до того, що частина, яка залишиться, уже не буде мати властивості яблука?» Згодом вчений прийшов до висновку, що межа такого ділення існує, і назвав цю останню, уже неподільну частинку атом. Замислитесь, це написано більше 2 тисяч років тому: «Початок Всесвіту - атоми й порожнина, все інше існує лише у думці. Світів численна кількість, і вони мають початок і кінець у часі. І ніщо не виникає з небуття. І атоми численні за величиною носяться у Всесвіті, і таким чином народжується все складне: вогонь, вода, повітря, земля. Останні є сполученням деяких атомів. Атоми ж не піддаються ніякому впливу і незмінні».
Після смерті Демокрита Аристотель вчив зворотному. Вчення Демокрита забули на багато століть, а його праці знищувались.
Геніальні здогади Демокрита та інших вчених про будову речовин через відсутність експериментальних даних понад два тисячоліття не вдавалося перевірити. Атоми настільки малі, що було надзвичайно складно довести, що вони існують. І все-таки вчені незаперечно довели – все в природі складається з атомів.
Після відкриття електрона стало зрозуміло, що атом складається з частинок. Перед вченими постало питання: Яку будову має атом? Як розташовані в атомі електрони?
Багато вчених намагалися відповісти на ці питання.
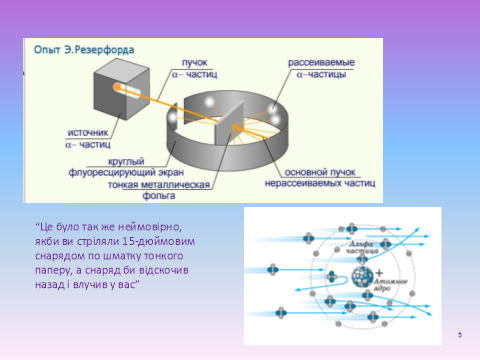
Слайд 5. У 1909 р. Резерфорд вивчав розсіювання альфа-частинок, які проходять через тонкі металеві пластинки. Переважна більшість альфа-частинок проходила крізь фольгу, майже не відхилившись від прямолінійного шляху. Лише дуже рідкі «кулі» (одна з кількох тисяч відстрибували від мішені).
У результаті дослідів Резерфорд прийшов до важливих висновків: ядро має мізерний об’єм – його діаметр приблизно у 100 тисяч разів менший від діаметра атома. Дуже масивне ядро міститься у центрі величезної пустині і в ньому зосереджена майже вся маса атома. Розрахунки показали, що 1 см3с щільно складених одне біля одного атомних ядер мав би масу понад 100 млн. т!
Слайд 6. У 1911 році великий англійський фізик Ернест Резерфорд створив планетарну (ядерну) модель атома.
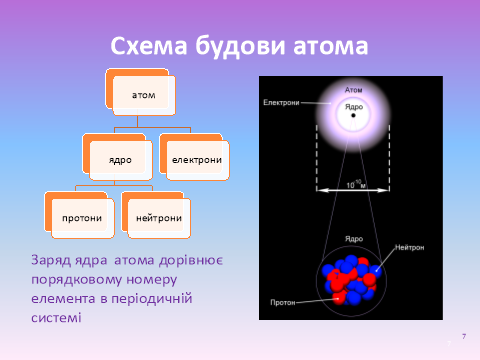
Слайд 7. Розглянемо й запишемо схему будови атома.
Оскільки атом – нейтральна частинка, то сумарний негативний заряд електронів нейтралізується позитивним зарядом ядра.
Заряд ядра атома дорівнює порядковому номеру елемента в періодичній системі.
В цьому фізичний зміст порядкового номера елемента.
Запитання учням.
- Чому дорівнює кількість електронів в атомі? (Порядковому номеру).
Характеристики частинок
|
Частинка |
Система інтернаціональна |
Система атомних одиниць |
||
|
Маса, кг |
Заряд, Кл |
Маса, а.о.м. |
Заряд, а.о.з. |
|
|
Електрон, е |
9,109 ∙ 10-31 |
-1, 602 ∙ 10-19 |
0 |
-1 |
|
Протон, р |
1,673 ∙ 10-27 |
+1, 602 ∙ 10-19 |
1 |
+1 |
|
Нейтрон, n |
1,675 ∙ 10-27 |
0 |
1 |
0 |
Запитання учням:
- Виходячи із схеми будови атома, визначте, чому дорівнює кількість протонів в атомі хімічного елемента? (порядковому номеру елемента).
Оскільки ядро складається з позитивно заряджених протонів і нейтральних нейтронів ,то число протонів також дорівнює порядковому номеру елемента і визначає його місце в періодичній системі. Тому порядковий номер елемента називають протонним числом.
Протонне число дорівнює величині заряду ядра атома елемента.
Проблемне запитання учням.
- Як же можна визначити кількість нейтронів в ядрі атома?
(Ми знаємо відносну атомну масу елемента, а також те, що електрон має масу 0. Тому число нейтронів дорівнює різниці між відносною атомною масою і числом протонів.
N= Аr – р
Сума протонів і нейтронів називається нуклонним числом.
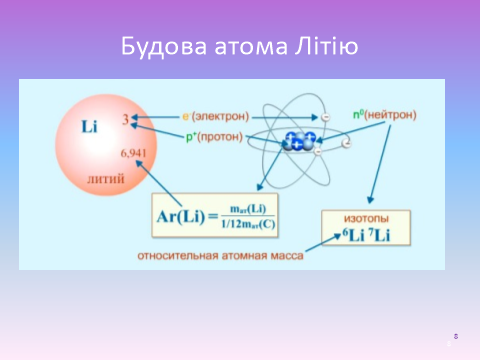
Слайд 8. Розглянемо приклад. Порядковий номер атома Літію – 3. Значить, заряд його ядра +3, протонів в ядрі міститься 3, електронів – 3, нейтронів - 4 (7-3).
Ми з вами переконалися ще раз, що неможливо розділити уявлення фізиків і хіміків в цій галузі, що обидві ці науки в єдності формують об’єктивну картину мікросвіту. (Лунає шум, тріск, вибух …)
Учитель. Що за шум?
Перегляд відео – театралізована сценка «Машина часу», яке дозволяє перейти до закріплення знань в групах.
Гість з майбутнього. Що ти накоїла? Ти яку кнопку натиснула?!
Гість з минулого. Я натиснула? Та це ж ти … «як слон у городі!» Що тепер будемо робити?
Гість з майбутнього. Тихіше ти… Де це ми опинилися?
Гість з минулого. Двадцять перше століття. А що таке?
Гість з майбутнього. «Що таке…», «що таке…» (перекривляє). Та це ж сто років після відкриття будови атома! Ми врятовані!
Гість з минулого. Друзі! Людоньки! Допоможіть!
Гість з майбутнього. У нас стався збій у роботі машини часу на ядерному рівні!
Гість з минулого. Допоможіть її налагодити! Тоді ми зможемо потрапити додому: він – у майбутнє, а я – у минуле!
Гість з майбутнього. Інакше станеться катастрофа: порушиться плин часу!
Гість з минулого. Знайдіть нашу панель налаштувань.
Гість з майбутнього. Нам необхідно пройти чотири сітьових портали у певній послідовності. На кожному – залишити повідомлення – виконане завдання.
Гість з минулого. Завдання на панелі є, а відповіді – зникли!
Разом. Одна надія – на вас!
Гість з майбутнього. Виконайте завдання і надішліть відповіді.
Учитель. Допоможемо їм продовжити подорож?
- Закріплення вивченого матеріалу
Учитель роздає групам завдання.
Слайди 9-12. Завдання групі «ядро».
Вставте у текст пропущені слова.
Протони і нейтрони утворюють ________. Заряд ядра визначається числом ________, які входять до його складу. Порядковий номер хімічного елемента дорівнює _______________. На масу атома не впливають ____________.
Завдання групі «протон».
Заповніть таблицю.
|
Елемент |
Заряд ядра |
Число протонів |
Число електронів |
Число нейтронів |
Протонне число |
Нуклонне число |
|
Оксиген |
|
|
|
|
|
|
|
Гідроген |
|
|
|
|
|
|
Завдання групі «Електрон».
Визначте елементи за вказаною кількістю частинок:
|
Число частинок |
Елемент |
|
|
е = 14 |
|
|
|
|
р = 24 |
|
Завдання групі «нейтрон»
Обчисліть число елементарних частинок (протонів, нейтронів, електронів), які входять до складу атомів:
Флуору___________________________________________________
Сульфуру_________________________________________________
Ауруму___________________________________________________
Учитель. На виконання завдання відводиться 2 хвилини. Після цього представник від групи повинен озвучити відповідь. Клас уважно слухає, виправляє, доповнює.
Слайд 13. Учитель. Машина часу відправляється у подорож, а ми з вами продовжуємо працювати. Я хочу переконатися в тому, що ваші знання міцні. Пройдіть самоперевірку (3 хв) і оцініть свої відповіді.
Учням видаються завдання за варіантами (позначені кольором).
1варіант
- Атом складається з:
а) ядра й електронної оболонки, б) електронів,
в) молекул, г) нейтронів і протонів.
- Ядро атома складається з:
а) електронів, б) електронів і протонів,
в) протонів і нейтронів, г) нейтронів.
- Кількість протонів у ядрі дорівнює:
а) порядковому номеру , б) номеру періоду,
в)номеру ряду, г) номеру групи.
- Електрони заряджені:
а) позитивно, б)не заряджені, в) додатньо, г) негативно.
- Число протонів в атомі Фосфору:
а) 31, б) 15, в) 17, г) 46.
- Число електронів в атомі Бору:
а) 5, б) 6, в) 11, г) 22.
- Число нейтронів в атомі Калію:
а) 19,б) 39, в) 58, г) 20.
- Основний внесок у масу атома роблять:
а) протони й електрони, б) протони і нейтрони,
в) нейтрони й електрони, г) електрони.
- Вкажіть характерну властивість нейтронів:
а) має заряд -1, б) має заряд +1,
в) не має маси, г) не має заряду.
- Вкажіть номер групи, в якій міститься елемент, заряд ядра якого дорівнює 17:
а) VI, б) II, в) VII, г) I.
2 варіант
- Із порядковим номером елемента збігається:
а) значення відносної атомної маси, б) значення електронегативності,
в) кількість електронів в атомі, г) кількість нейтронів у ядрі.
- Протонне число дорівнює:
а) номеру періоду, б) номеру групи,
в) відносній атомній масі, г) порядковому номеру елемента.
- Заряд ядра атома Феруму дорівнює:
а) 26, б) 8, в) 56, г)4.
- На масу атома в основному не впливає:
а) протон, б) нейтрон, в) електрон, г) ядро.
- Вкажіть елемент, в ядрі якого міститься 7 електронів:
а) Нітроген, б) Карбон, в) Літій, г) Натрій.
- В ядрі Флуору міститься:
а) 19 протонів, б)10 протонів, в) 9 протонів, г) 9 електронів.
- Маса атома зосереджена в:
а) електронах, б) протонах, в) нейтронах, г) ядрі.
- Вкажіть характерну властивість електронів:
а) має заряд -1, б) має заряд +1,
в) не має маси, г) не має заряду.
- Число нейтронів в атомі Магнію становить:
а) 24, б) 2, в) 12,г) 0.
- Вкажіть номер періоду, в якому міститься елемент, заряд ядра якого дорівнює 7:
а) VI, б) II, в) VII, г) I.
Тестування з самоперевіркою за допомогою перфокарт.
Учитель. У кожного з вас є по 4 кольорові картки, які позначають рівень знань: чорна – низький, синя – середній, жовта – достатній, червона – високий. Підніміть відповідну картку. Молоді, я бачу, що в основному, тему ви засвоїли добре, а, значить, мети уроку досягли.
- Підсумки
Учитель. Прийшов час підводити підсумки.
Слайд 14. Складання сенкану
Це японське слово, що означає в буквальному перекладі «емоційне ставлення». Сенкан буде складатися з 5 рядків.
1. Одним словом (іменником) висловіть тему сьогоднішнього уроку.
2. Підберіть до цього слова 2 прикметники.
3. Підберіть до цього слова 3 дієслова.
4. Складіть фразу, в якій буде відображена значимість цього слова.
5. Підберіть синонім до цього слова.
(Учні записують і зачитують результат.)
Учитель.
- Який матеріал уроку був важким для розуміння?
- Який матеріал був цікавим?
- Про що б хотілося дізнатись більше?
- Які враження від уроку?
Свій емоційний стан покажіть за допомогою сонечок і хмарок, які прикріпите на наше уявне небо (плакат), виходячи з кабінету.
- Домашнє завдання
Слайд 15. Конспект вивчити – середній рівень
Скласти тестові запитання або кросворд –достатній рівень
«Здивуй!» - підготувати цікаві матеріали, які містять співвідношення розмірів атома, ядра, електронної оболонки – високий рівень
Я дякую вам за урок і ті знання, які ви сьогодні показали. І нехай по життю вас веде мудра приказка: «Не соромно не знати, соромно не вчити». Урок закінчено. До побачення!
Додаток 2
Лист самооцінювання
|
Прізвище, м.’я |
Складання пазлів |
Усні відповіді |
Тестування |
Сенкан |
Всього |
|
|
|
|
|
|
|
Додаток 3
Пазли




Додаток 4
Картки для відображення психологічного настрою


Додаток 5
Учительська презентація до уроку















про публікацію авторської розробки
Додати розробку
