Урок "Відносна молекулярна та відносна формульна маса"
Тема: Відносна молекулярна та відносна формульна маса
Мета: сформувати вміння розраховувати відносні молекулярні маси речовин та масові частки елементів у речовині за хімічною формулою, складати умову задачі, складати алгоритми розв'язування задач із хімії; закріпити й розширити вміння характеризувати речовини за хімічними формулами; продовжити знайомство з вимогами до оформлення задач із хімії; розвивати основні операції мислення та пізнавальні процеси, математичні здібності, вміння складати алгоритм та діяти за ним; виховувати вміння працювати самостійно; уважно слухати та спостерігати за діями інших; використовувати набутий раніше досвід для розв’язання нових завдань; оцінювати один одного; допомагати один одному; виховувати любов і повагу до природи, до процесів, що відбуваються в ній, формувати ціннісне ставлення до навколишнього середовища.
Обладнання і матеріали: періодична система хімічних елементів, лото-білети
Базові поняття: відносна молекулярна маса, відносна формульна маса, атом, молекула, хімічний елемент, відносна атомна маса.
Методи та прийоми: словесні (бесіда, евристична бесіда, побудова алгоритму, інформаційне повідомлення), наочні (демонстраційне пояснення, виконання вправи за зразком), інтерактивні вправи.
Тип уроку: вивчення нового матеріалу
Структура уроку
- Організаційний етап………………………………………………….2 хв
- Мотивація навчально-пізнавальної діяльності ………….………….2 хв
- Актуалізація опорних знань…………………………………………..4 хв
- Вивчення нового матеріалу…………………………………………16 хв
- Узагальнення й систематизація набутих знань……………………15 хв
- Підсумок уроку………………………………………………………3 хв
- Виставлення оцінок та їх мотивація………………………………..1 хв
- Інструктаж з домашнього завдання……………………………….2хв
ХІД УРОКУ
І. Організаційний момент
- Привітання з учнями класу.
- Відмітити відсутніх.
- Створити організаційно-методичні умови для проведення уроку.
- Формування в учнів позитивного ставлення один до одного (Поверніться один до одного, посміхніться один одному)
ІІ. Мотивація навчально-пізнавальної діяльності
(кросворд)

ІІІ. Актуалізація опорних знань
(мозковий штурм, робота в групах)
- Що таке молекула?
- З яких частинок складаються молекули?
- Як ви гадаєте, з якою кількістю інших атомів може сполучатися атом?


- Що називається валентністю елементів?
- Назвіть елементи, які проявляють постійну валентність.
- Які з відомих вам елементів можуть проявити змінну валентність?
ІІ рівень
- Що необхідно знати, щоб визначити валентність елементів в готовій формулі.
- Визначте валентність елемементів:
|
1, 2 група |
3,4 група |
|
а) за Гідрогеном(І) PH3; SiH4; HCl; H2O б) за Сульфуром (ІІ) Аl2S3; CS2; FeS; Na2S; MgS (сульфіди) |
а) за Хлором (І) FeCl3; NaCl; CaCl2; CCl4 (хлориди) б) за Оксигеном (ІІ) FeO; Fe2O3; BaO; Na2O; Mn2O7 (оксиди) |
- Що необхідно знати, щоб визначити валентність елементів в готовій формулі.
- Складіть формули речовин за валентністю:
|
1, 2 група |
3, 4 група |
|
Оксидів за валентністю: Fe(III); N (I); P (V); C(IV); Ag(I); |
Оксидів Нітрогену, валентність якого дорівнює І, ІІ, ІІІ, ІV, V |
|
II I II II I II III I I I BaCl; ZnS; CuS; PCl; NaCl |
IV I I I II II III I IV II SiCl; AgI; FeS; CrCl; CO |
ІІІ рівень
- Визначте валентність елементів у сполуках: HgS; Cl2O7; N2O4; TiCl4; AlN; WO3; SF6; CaI2; CHCl3
- Складіть формули барій хлориду, станум (IV) сульфіду, алюміній фториду, бор оксиду, селен (VI) оксиду.
ІV. Вивчення нового матеріалу
(розповідь, бесіда, робота з підручником)
Маси молекул, як і маси атомів, дуже малі. Тому для їх обчислення, як і для обчислення мас атомів, використовують порівняння з атомною одиницею маси.
Молекулярна маса — це маса однієї молекули певної речовини.
А якщо для визначення молекулярної маси використовувати наведені в таблиці відносні атомні маси?
Відносна молекулярна маса— це фізична величина, що показує, у скільки разів маса певної молекули більша за 1/12 маси атома Карбону — 12.
Одиниця вимірювання: [Мr.] = а.о.м.
Відносна молекулярна маса = сумі відносних атомних мас усіх хімічних елементів, що входять до складу молекули з урахуванням числа атомів кожного елемента.
Наприклад, для молекули кисню, що складається з двох атомів Оксигену, маємо:
Мr(О2) = 2Аr(О) = 2*16 = 32
Обчислимо відносні молекулярні маси для наведених речовин.
Н2О, Н2SO4 та Ca(OH)2 (Слайд 12)
Мr(Н2O)=2Аr(H)+Ar(O)=2×1+16=18
Мr(Н2SO4)=2Аr(H)+Ar(S)+4Ar(O)=2×1+32+4×16=98
Мr(Са(ОН)2)= Аr(Са)+(Ar(O)+ Аr(H))×2=40+(16+1)×2=74
Отже, хімічна формула речовини дозволяє обчислити відносну молекулярну масу речовини. Та для цього потрібно враховувати індекси, або кількість атомів елемента в молекулі.
Завдання. Складіть за валентністю формули й обчисліть відносну молекулярну масу речовин:
АІО, СаО, К.
Самостійно учні працюють у зошитах, потім називають Мr, виписують усі одержані результати, вибирають правильну відповідь, аналізують помилки.
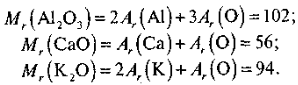
Для речовин не молекулярної будови замість терміна «відносна молекулярна маса» використовують термін «відносна формульна маса» але позначення й спосіб обчислення для цих величин є однаковими.
Відносна формульна маса – це відносна маса формульної одиниці речовини.
Відносні формульні маси простих речовин не молекулярної будови, до складу яких входять атоми тільки одного хімічного елемента прийнято вважати такими що дорівнюють їхній відносній атомній масі.
Наприклад, Мr(Fе) = Ar(Fе) = 56
V. Узагальнення й систематизація набутих знань
(виконання тренувальних вправ, розв’язування задач)
Завдання 1.
Визначте відносну молекулярну масу
- Fe (56)
- CaCO3 (100)
- K2O (94)
- O2 (32)
- CuO (80)
- Na2SO4 (142)
Завдання 2.
А зараз я пропоную вам пограти у хімічне лото. Перед вами барабан, який буде вказувати нам на хімічні формули. У вас будуть лото білети, у яких зазначені числа. Серед них є і відносні молекулярні маси запропонованих речовин. Знайдіть їх. Переможцем стане той, у кого на ігровому полі буде закреслена одна горизонталь.
- (Сполуки Na2O, NaI, H2O, HI, KCl, NH4OH, NaOH)
(Додаток 2)
VІ. Підсумок уроку
Молекулярна маса — це маса однієї молекули певної речовини.
А якщо для визначення молекулярної маси використовувати наведені в таблиці відносні атомні маси?
Відносна молекулярна маса— це фізична величина, що показує, у скільки разів маса певної молекули більша за 1/12 маси атома Карбону — 12.
Одиниця вимірювання: [Мr.] = а.о.м.
Відносна формульна маса – це відносна маса формульної одиниці речовини.
VІІ. Виставленя оцінок та їх мотивація
VІІІ. Інструктаж з домашнього завдання
- § 9 ст. 64-66
- Виконати завдання 1, 3, 7 ст. 68-69 (письмово)
- *Виконати завдання з карток (письмово в зошитах) (Додаток 3)
Додаток 2
Білети для хімічного лото



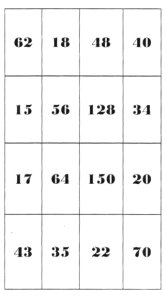
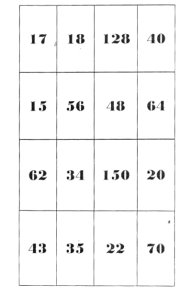
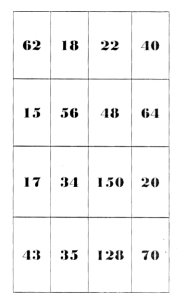
Додаток 3
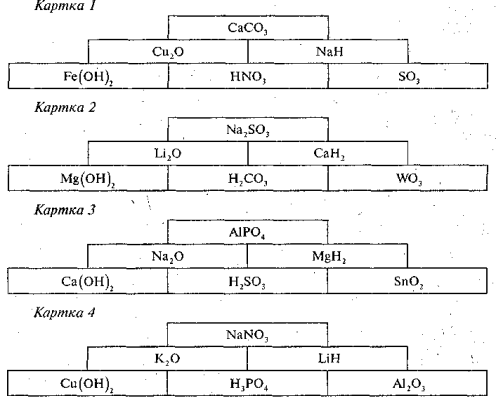









про публікацію авторської розробки
Додати розробку
