Урок "Властивості оксидів"
Щоб зробити урок формування вмінь і навичок цікавим для учнів використовується різноманітні методи- інтерактивні, репродуктивні, дослідницькі, наочні, пояснювально- ілюстративні тощо.
Урок « Властивості оксидів».
Мета: освітня – ознайомити учнів з фізичними й хімічними властивостями оксидів; сформувати поняття «індикатори» ;
розвиваюча – розвивати увагу , пам’ять, логічне мислення, хімічну мову, навички складання рівнянь хімічних реакцій, формувати вміння аналізувати інформацію, виділяти головне;
виховна – продовжити формування світогляду,прищеплювати любов до предмету.
Тип уроку: формування вмінь і навичок.
Методи навчання : пояснювально-ілюстративні, словесні, наочні, інтерактивні, практичні, репродуктивні, дослідницькі, метод контролю.
Обладнання: хімічні реактиви, таблиця Д. І. Менделєєва ,кольорові квадрати.
Хід уроку:
I. Організація класу.
II. Перевірка домашнього завдання.
Мотивація навчальної діяльності:
Сьогодні ми продовжуємо працювати з неорганічними речовинами.
- Згадайте, які класи неорганічних сполук ви знаєте? ( Оксиди, кислоти, основи, солі )
- Знайдіть відповідність між назвою та загальною формулою речовин:
оксиди HxR
основи MexRy
кислоти ЄxOy
солі Me(OH)n ( робота на дошці)
- Що собою уявляють оксиди? ( визначення,класифікація )
- Гра «Хрестики – нулики». Визначити виграшний шлях :
а) кислотні оксиди б) основні оксиди
Fe2O3 K2O CO2 SO2 ZnO CaO
Na2O SO3 CaO H2O Al2O3 Na2O
N2O5 MgO CO P2O5 CO2 CuO
* В світі цікавого: «Собача печера».
В Італії, поблизу Неаполя є Собача печера. Дорослі люди можуть знаходитись в ній скільки завгодно, а от собаки, коти та інші низькорослі тварини задихаються й гинуть. Чому?
З вулканічного грунту місцевості виділяється СО2, який осідає на дні печери шаром 80-100 см. Тому тварини в печері гинуть.
- Як розрізняють класи сполук ? ( За складом )
- А якщо формула речовини не відома ? ( Розпізнати за хімічними властивостями )
Вчитель повідомляє тему уроку, визначає мету й завдання уроку .
III . Формування вмінь і навичок .
- Фізичні властивості оксидів. Будова оксидів.
Прослідкувати взаємозв’язок між будовою та фізичними властивостями речовин.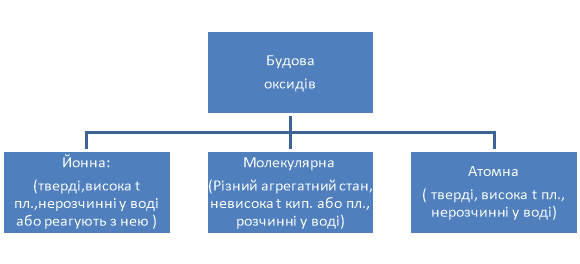
Дослід 1. Зразки оксидів.
Аналіз таблиці ( Див. «Хімічний рятівник»).
2) Хімічні властивості оксидів.
Дослід 2. Взаємодія кислотних і основних оксидів із водою.
|
Речовини |
Дослід |
Результат/ хімічне рівняння |
|
CaO , H2O |
CaO + H2O + метиловий оранжевий |
CaO + H2O= Ca(OH)2 Розчин - жовтий( лужне середовище) |
|
P2O5, H2O |
P2O5 + H2O + метиловий оранжевий |
P2O5 + 3 H2O=3 H3PO4 Розчин - червоний (кисле середовище) |
Висновок: При взаємодії з водою кислотний оксид дає кислоту; основний оксид – основу.
Індикатори – це речовини- визначники, які реагують на різне середовище зміною забарвлення ( лакмус, фенолфталеїн, метиловий оранжевий).
*Взаємодія з кислотами:
CaO + 2 HCl = CaCl2 + 2 H2O – реакція обміну
P2O5 + HCl = не взаємодіє
Висновок: основні оксиди взаємодіють з кислотами з утворенням солі й води.
*Взаємодія з основами:
CaO + KOH = не взаємодіє
P2O5 + 6 KOH = 2 K3PO4 + 3 H2O
Висновок: кислотні оксиди взаємодіють з основами , утворюють солі й воду.
*Взаємодія між собою:
3 CaO + P2O5 = Ca3(PO4)2
Додатково:
* Розклад деяких оксидів при t :
2H2O = 2 H2 + O2
2 SO3 = 2 SO2 + O2
* Взаємодія з простими речовинами:
CuO + H2 = Cu + H2O
2 Fe2O3 + 3 C = 4 Fe + 3 CO2
IV. Закріплення вивченого матеріалу:
Керована практика.
- Записати опорну схему у зошит. ( Див. « Хімічний рятівник»)
2) Розв’язати задачу:
Учень восьмого класу Яблоков Ваня випадково впустив у воду шматок MgO масою 80 г. Яку речовину та якою масою отримав необережний Яблоков?
( Відповідь: 116 г Mg(OH)2 )
- індивідуальні завдання –картки
|
№ варіанту |
Речовини |
|
I |
H3PO4, Cu(OH)2, Na2O, HNO3, P2O5, Al2(SO4)3, KOH, SO3 |
|
II |
Fe(OH)3, CaO, SO2, H2SiO3, MgCl2, NaOH, K2O, NH3 |
|
III |
BaO, Fe(OH)2, CO2, HCl, Zn(NO3)2, Ba(OH)2, HNO3, Al2O3 |
|
IV |
Al(OH)3, MgO, Cl2O7, H2SO4, CaCl2, KOH, Na2O, H2SO3 |
|
V |
ZnO, HBr, P2O5, Cu(OH)2, Ca3(PO4)2, Ba(OH)2, SO2, H2SO4 |
- Виберіть із списку речовин формули оксидів.
- Розташуйте ці оксиди в ряд у міру зростання їх відносної молекулярної маси.
- Напишіть рівняння одержання цих оксидів із простих речовин.
V. Рефлексія. Підсумок уроку.
Вчитель : Скажіть, будь ласка, що сьогодні було найбільш цікавим? Найскладнішим?
Підніміть зелений квадрат, якщо ви сьогодні зрозуміли матеріал і працювали на високому рівні.
Підніміть жовтий квадрат, якщо ви сьогодні зрозуміли матеріал і працювали на достатньому рівні.
Підніміть червоний квадрат, якщо ви майже нічого не зрозуміли.
VI .Домашнє завдання: опрацювати відповідний параграф підручника,
виконати вправи, підготувати повідомлення
« Оксиди в природі», « Застосування оксидів».


про публікацію авторської розробки
Додати розробку
