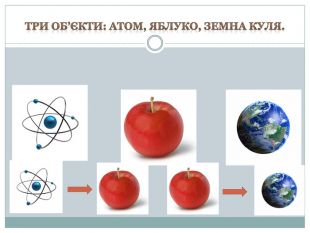
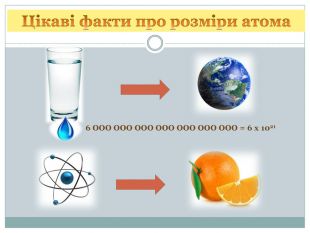
Урок з фізики "Історія атома. Будова атома"
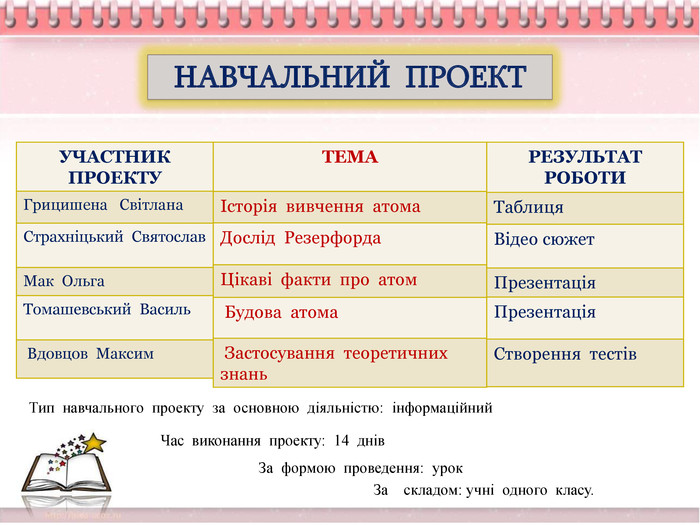
Папка містить розробку уроку, презентацію та деякі відео. Під час уроку учні демонструють свій результат роботи над навчальним проектом. У кожного учня було індивідуальне завдання, хоча працювали над одним проектом
- π᫬π.docx docx
- πτ¡∩.docx docx
- âα¿µ¿ΦÑ¡«⌡.docx docx
- 1.mp4 mp4
- Показати всі файли
|
ОСНОВНІ ЕТАПИ РОЗВИТКУ АТОМНОЇ ФІЗИКИ
|
||||
|
№ |
Період |
Вчений |
Досягнення науки
|
|
|
І етап . Гіпотеза про існування атома як неподільної частинки.
|
||||
|
1. |
2,5 тис. років тому |
Демокріт і Левкіпп |
Перші ідеї про існування атомів. Вони вважали, що речовини утворюються в результаті зіткнення атомів і появи зв'язків між ними. Вони вважали, що атоми мають форму правильних багатогранників: куба («атоми землі»), тетраедра («атоми вогню»), октаедра («атоми повітря»), ікосаедра («атоми води»). Але не всі філософи, вчені підтримували ідею існування атома. Наприклад, Арістотель вважав, що світом керують чотири «начала»: вода, земля, повітря і вогонь. А «началом» всіх «начал» є Бог. Історичний факт: під тиском церкви у 1626 р. Паризький парламент під загрозою страти заборонив атомістичну теорію (теорію про існування атома). |
|
|
ІІ етап . Експериментальне підтвердження існування атома. (початок 19 ст.)
|
||||
|
2. |
1808 р. |
Англійський хімік і математик Джон Дальтон |
Першим, хто розвинув наукову теорію атома.Припустив, що всі атоми певного хімічного елемента в точності однакові. Він вирахував відносні маси для атомів відомих йому елементів. І встановив , що атоми різних елементів мають різні властивості і різні маси.). |
|
|
3. |
18 ст. |
М.В. Ломоносов |
Заклав основи молекулярно-кінетичної теорії (МКТ) газів, які пізніше були підтверджені експериментально |
|
|
4. |
1869 р. |
Дмитрій Іванович Менделєєв |
Cистематизував знання про атоми в таблиці періодичних елементів хімічних елементів. |
|
|
5. |
1889р. |
Російськиій фізик О. Г. Столєтов |
Явище фотоефекту |
|
|
ІІІ етап . Дослідження будови атома ( кінець 19 ст. , а точніше з 1987р.)
|
||||
|
6. |
1895р. |
Німецький фізик Вільгельм Конрад Рентген та український фізик Іван Пулюй |
Працюючи з «катодними променями», виявив випромінювання, здатне проникати через матеріальні перешкоди. Рентген назвав його «Х-променями», нам же воно відоме тепер як «рентгенівське випромінювання». |
|
|
7. |
1896р. |
Французький вчений Анрі Беккерель |
Відкрив явище природної радіоактивності – самовільного розпаду ядер атомів важких металів
|
|
|
8. |
1897 р. |
Амереканський інженер Джозеф Джон Томсон |
Відкриття електрона, як складової частини атома і носія найменшого заряду.
|
|
|
9. |
1899р. |
Ернест Резерфорд і його послідовники |
Вчені встановили, що під впливом магніту випромінювання, що випускається ураном, розділяється на три потоки, тобто, що існує, щонайменше, три види радіації. азвали їх альфа-, бета - і гамма-випромінюванням. |
|
|
10. |
1859 р. |
Кірхгоф і Бунзен |
Проаналізували результати тривалої роботи багатьох вчених по різним виглядам спектрів від різних речовин і прийшли до висновку, що кожен атома має свій спектральний рисунок і цей рисунок пов’язаний саме з будовою атома. (Метод спектрального аналізу) |
|
|
11. |
1902р. |
Французькі вчені Марія і П'єр Кюрі |
Вперше виділила з уранової руди природний радіоактивний елемент - радій. |
|
|
12. |
1903р. |
Дж. Дж. Томсоном |
Перша достатньо розроблена модель атома. Згідно цієї моделі речовина в атомі несе позитивний заряд і рівномірно заповнює весь об'єм атома. Електрони "вкраплені" в атом. |
|
|
13. |
1909р. |
Американський вчений Міллікен |
Визначив заряд електрона е = - 1,6 * 10 -19 Кл. |
|
|
14. |
1911 р. |
Англійський фізик Ернест Резерфорд |
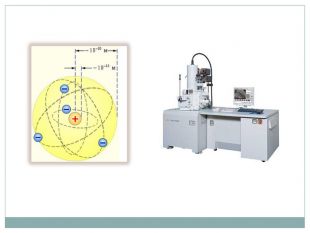
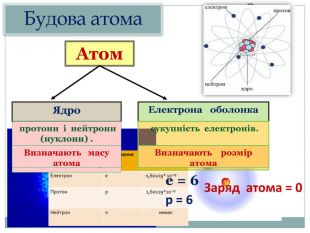
Резерфорд експериментально перевірив модель Томсона і довів ,що Атом складається з позитивно зарядженого ядра, яке займає мізерно малий обсяг атома. Навколо ядра розташовані електрони. Електрони обертаються навколо ядра на досить великих відстанях від нього. Таку модель назвали планетарною або ядерною. |
|
|
15 |
1913р. |
Ернест Резерфорд |
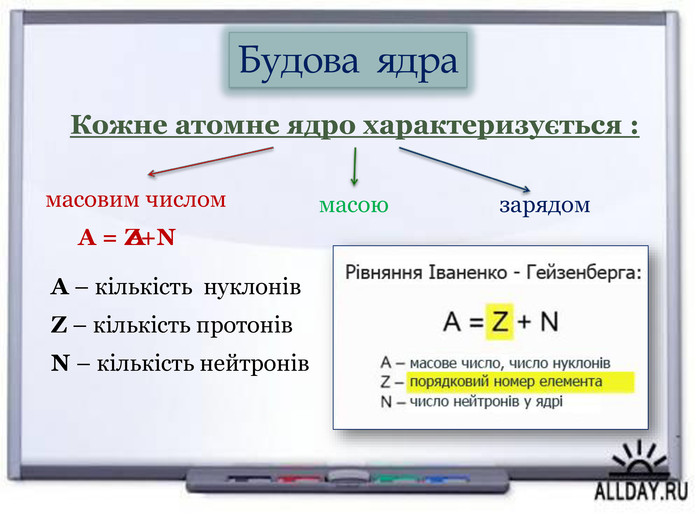
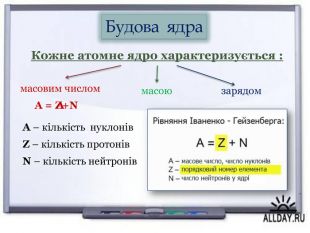
Висунув гіпотезу по те, що однією із частинок, які входять до складу ядра хімічних елементів, є ядро атома гідрогену, тобто протон |
|
|
16 |
|
Датський фізик Нільсом Бор |
Розвинув теорію квантових уявлень про процеси в природі. Він сформулював у вигляді постулатів основні положення нової теорії. Згідно постулатам Бора електрон може знаходитися на декількох визначених орбітах. Кожній орбіті електрона відповідає певна енергія. |
|
|
17 |
1917 р. |
Німецький вчений Альберт Ейнштейн |
Передбачив можливість переходу атома з вищого енергетичного стану в нижче під впливом зовнішнього впливу. Таке випромінювання називається вимушеним випромінюванням і лежить в основі роботи лазерів. |
|
|
18 |
1919р. |
Ернест Резерфорд |
Бомбардуючи альфа-частинками ядра азоту, перетворив їх в ядра оксигену, здійснивши таким чином першу в історії ядерну реакцію |
|
|
19 |
1932р. |
Англійський фізик Джеймс Чедвік |
Відкрив нейтрон - частку, рівну за масою протону, але не має заряду. Було створено нейтронно-протонну модель атомного ядра. У результаті відбулося виділення з атомної фізики самостійного напрямку - ядерної фізики. |
|
|
20 |
1934 р. |
Французькі фізики Фредерік та Ірен Жоліо-Кюрі |
Отримали перший штучний ізотоп фосфор-30 (природний фосфор на 100 % складається з фосфору-31).Це стало своєрідним стартом: починаючи з цього часу і далі, у фізичних лабораторіях різних країн були отримані тисячі ізотопів, не існуючих в природі. |
|
|
IV. Застосування знань про будову атома |
||||
ВИСТУП УЧЕНИЦІ
В історії розвитку фізики одна з найбільш цікавих і захоплюючих сторінок - це історія відкриття складної будови атома. Тому сьогодні я хочу ознайомити вас з деякими відомостями про вивчення атома.
Саме слово походить від грецького «atomos» - неподільний.
Щоб найкраще донести до вас інформацію, я вирішила зробити таблицю «Основні етапи розвитку атомної фізики». В ній я показала, як тисячоліттями вчені намагалися зрозуміти, що таке атом. І через деякий час їм це вдалося. Червоним кольором я відмітила найважливіші продії.
Перші ідеї про існування атомів ще 2,5 тис. років тому висловили давньогрецькі вчені філософи Демокріт і Левкіпп. Саме вони назвали атомом дрібну неподільну частинку, що утворює речовину. У 1626 р. Парижський парламент під загрозою страти заборонив атомістичну теорію. Згодом її все ж таки було визнано, але до середини ХІХ ст. вважалося, що атом є не подільним.
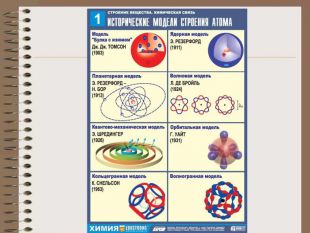
Першу модель атома в 1903 р. запропонував Джозеф Джон Томсон. Він запропонував.. (читаєш з підручника, ст..267, п.70,14 стрічка саме так написано; читаєш до кінця абзац, Однак … ІІ абзац починається читаєш дві стрічки …. Але читаєш не 1906 рік, а 1911 рік) . Тобто моделі атома Томсона був нанесений удар дослідженнями Резерфорда і його учнів. Як саме це відбувалось пропоную переглянути фільм
|
ОСНОВНІ ЕТАПИ РОЗВИТКУ АТОМНОЇ ФІЗИКИ
|
||||
|
№ |
Період |
Вчений |
Досягнення науки
|
|
|
І етап . Гіпотеза про існування атома як неподільної частинки.
|
||||
|
1. |
2,5 тис. років тому |
Демокріт і Левкіпп |
Перші ідеї про існування атомів. Вони вважали, що речовини утворюються в результаті зіткнення атомів і появи зв'язків між ними. Вони вважали, що атоми мають форму правильних багатогранників: куба («атоми землі»), тетраедра («атоми вогню»), октаедра («атоми повітря»), ікосаедра («атоми води»). Але не всі філософи, вчені підтримували ідею існування атома. Наприклад, Арістотель вважав, що світом керують чотири «начала»: вода, земля, повітря і вогонь. А «началом» всіх «начал» є Бог. Історичний факт: під тиском церкви у 1626 р. Паризький парламент під загрозою страти заборонив атомістичну теорію (теорію про існування атома). |
|
|
ІІ етап . Експериментальне підтвердження існування атома. (початок 19 ст.)
|
||||
|
2. |
1808 р. |
Англійський хімік і математик Джон Дальтон |
Першим, хто розвинув наукову теорію атома.Припустив, що всі атоми певного хімічного елемента в точності однакові. Він вирахував відносні маси для атомів відомих йому елементів. І встановив , що атоми різних елементів мають різні властивості і різні маси.). |
|
|
3. |
18 ст. |
М.В. Ломоносов |
Заклав основи молекулярно-кінетичної теорії (МКТ) газів, які пізніше були підтверджені експериментально |
|
|
4. |
1869 р. |
Дмитрій Іванович Менделєєв |
Cистематизував знання про атоми в таблиці періодичних елементів хімічних елементів. |
|
|
5. |
1889р. |
Російськиій фізик О. Г. Столєтов |
Явище фотоефекту |
|
|
ІІІ етап . Дослідження будови атома ( кінець 19 ст. , а точніше з 1987р.)
|
||||
|
6. |
1895р. |
Німецький фізик Вільгельм Конрад Рентген та український фізик Іван Пулюй |
Працюючи з «катодними променями», виявив випромінювання, здатне проникати через матеріальні перешкоди. Рентген назвав його «Х-променями», нам же воно відоме тепер як «рентгенівське випромінювання». |
|
|
7. |
1896р. |
Французький вчений Анрі Беккерель |
Відкрив явище природної радіоактивності – самовільного розпаду ядер атомів важких металів
|
|
|
8. |
1897 р. |
Амереканський інженер Джозеф Джон Томсон |
Відкриття електрона, як складової частини атома і носія найменшого заряду.
|
|
|
9. |
1899р. |
Ернест Резерфорд і його послідовники |
Вчені встановили, що під впливом магніту випромінювання, що випускається ураном, розділяється на три потоки, тобто, що існує, щонайменше, три види радіації. азвали їх альфа-, бета - і гамма-випромінюванням. |
|
|
10. |
1859 р. |
Кірхгоф і Бунзен |
Проаналізували результати тривалої роботи багатьох вчених по різним виглядам спектрів від різних речовин і прийшли до висновку, що кожен атома має свій спектральний рисунок і цей рисунок пов’язаний саме з будовою атома. (Метод спектрального аналізу) |
|
|
11. |
1902р. |
Французькі вчені Марія і П'єр Кюрі |
Вперше виділила з уранової руди природний радіоактивний елемент - радій. |
|
|
12. |
1903р. |
Дж. Дж. Томсоном |
Перша достатньо розроблена модель атома. Згідно цієї моделі речовина в атомі несе позитивний заряд і рівномірно заповнює весь об'єм атома. Електрони "вкраплені" в атом. |
|
|
13. |
1909р. |
Американський вчений Міллікен |
Визначив заряд електрона е = - 1,6 * 10 -19 Кл. |
|
|
14. |
1911 р. |
Англійський фізик Ернест Резерфорд |
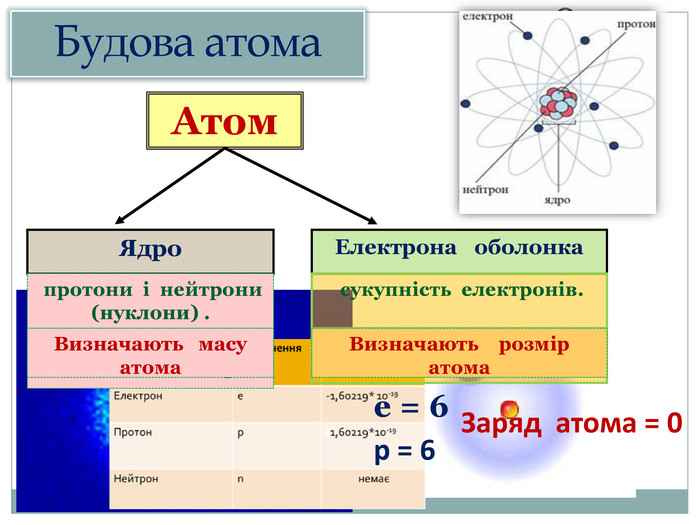
Резерфорд експериментально перевірив модель Томсона і довів ,що Атом складається з позитивно зарядженого ядра, яке займає мізерно малий обсяг атома. Навколо ядра розташовані електрони. Електрони обертаються навколо ядра на досить великих відстанях від нього. Таку модель назвали планетарною або ядерною. |
|
|
15 |
1913р. |
Ернест Резерфорд |
Висунув гіпотезу по те, що однією із частинок, які входять до складу ядра хімічних елементів, є ядро атома гідрогену, тобто протон |
|
|
16 |
|
Датський фізик Нільсом Бор |
Розвинув теорію квантових уявлень про процеси в природі. Він сформулював у вигляді постулатів основні положення нової теорії. Згідно постулатам Бора електрон може знаходитися на декількох визначених орбітах. Кожній орбіті електрона відповідає певна енергія. |
|
|
17 |
1917 р. |
Німецький вчений Альберт Ейнштейн |
Передбачив можливість переходу атома з вищого енергетичного стану в нижче під впливом зовнішнього впливу. Таке випромінювання називається вимушеним випромінюванням і лежить в основі роботи лазерів. |
|
|
18 |
1919р. |
Ернест Резерфорд |
Бомбардуючи альфа-частинками ядра азоту, перетворив їх в ядра оксигену, здійснивши таким чином першу в історії ядерну реакцію |
|
|
19 |
1932р. |
Англійський фізик Джеймс Чедвік |
Відкрив нейтрон - частку, рівну за масою протону, але не має заряду. Було створено нейтронно-протонну модель атомного ядра. У результаті відбулося виділення з атомної фізики самостійного напрямку - ядерної фізики. |
|
|
20 |
1934 р. |
Французькі фізики Фредерік та Ірен Жоліо-Кюрі |
Отримали перший штучний ізотоп фосфор-30 (природний фосфор на 100 % складається з фосфору-31).Це стало своєрідним стартом: починаючи з цього часу і далі, у фізичних лабораторіях різних країн були отримані тисячі ізотопів, не існуючих в природі. |
|
|
IV. Застосування знань про будову атома |
||||
ВИСТУП УЧЕНИЦІ
В історії розвитку фізики одна з найбільш цікавих і захоплюючих сторінок - це історія відкриття складної будови атома. Тому сьогодні я хочу ознайомити вас з деякими відомостями про вивчення атома.
Саме слово походить від грецького «atomos» - неподільний.
Щоб найкраще донести до вас інформацію, я вирішила зробити таблицю «Основні етапи розвитку атомної фізики». В ній я показала, як тисячоліттями вчені намагалися зрозуміти, що таке атом. І через деякий час їм це вдалося. Червоним кольором я відмітила найважливіші продії.
Перші ідеї про існування атомів ще 2,5 тис. років тому висловили давньогрецькі вчені філософи Демокріт і Левкіпп. Саме вони назвали атомом дрібну неподільну частинку, що утворює речовину. У 1626 р. Парижський парламент під загрозою страти заборонив атомістичну теорію. Згодом її все ж таки було визнано, але до середини ХІХ ст. вважалося, що атом є не подільним.
Першу модель атома в 1903 р. запропонував Джозеф Джон Томсон. Він запропонував.. (читаєш з підручника, ст..267, п.70,14 стрічка саме так написано; читаєш до кінця абзац, Однак … ІІ абзац починається читаєш дві стрічки …. Але читаєш не 1906 рік, а 1911 рік) . Тобто моделі атома Томсона був нанесений удар дослідженнями Резерфорда і його учнів. Як саме це відбувалось пропоную переглянути фільм
|
ОСНОВНІ ЕТАПИ РОЗВИТКУ АТОМНОЇ ФІЗИКИ
|
||||
|
№ |
Період |
Вчений |
Досягнення науки
|
|
|
І етап . Гіпотеза про існування атома як неподільної частинки.
|
||||
|
1. |
2,5 тис. років тому |
Демокріт і Левкіпп |
Перші ідеї про існування атомів. Вони вважали, що речовини утворюються в результаті зіткнення атомів і появи зв'язків між ними. Вони вважали, що атоми мають форму правильних багатогранників: куба («атоми землі»), тетраедра («атоми вогню»), октаедра («атоми повітря»), ікосаедра («атоми води»). Але не всі філософи, вчені підтримували ідею існування атома. Наприклад, Арістотель вважав, що світом керують чотири «начала»: вода, земля, повітря і вогонь. А «началом» всіх «начал» є Бог. Історичний факт: під тиском церкви у 1626 р. Паризький парламент під загрозою страти заборонив атомістичну теорію (теорію про існування атома). |
|
|
ІІ етап . Експериментальне підтвердження існування атома. (початок 19 ст.)
|
||||
|
2. |
1808 р. |
Англійський хімік і математик Джон Дальтон |
Першим, хто розвинув наукову теорію атома.Припустив, що всі атоми певного хімічного елемента в точності однакові. Він вирахував відносні маси для атомів відомих йому елементів. І встановив , що атоми різних елементів мають різні властивості і різні маси.). |
|
|
3. |
18 ст. |
М.В. Ломоносов |
Заклав основи молекулярно-кінетичної теорії (МКТ) газів, які пізніше були підтверджені експериментально |
|
|
4. |
1869 р. |
Дмитрій Іванович Менделєєв |
Cистематизував знання про атоми в таблиці періодичних елементів хімічних елементів. |
|
|
5. |
1889р. |
Російськиій фізик О. Г. Столєтов |
Явище фотоефекту |
|
|
ІІІ етап . Дослідження будови атома ( кінець 19 ст. , а точніше з 1987р.)
|
||||
|
6. |
1895р. |
Німецький фізик Вільгельм Конрад Рентген та український фізик Іван Пулюй |
Працюючи з «катодними променями», виявив випромінювання, здатне проникати через матеріальні перешкоди. Рентген назвав його «Х-променями», нам же воно відоме тепер як «рентгенівське випромінювання». |
|
|
7. |
1896р. |
Французький вчений Анрі Беккерель |
Відкрив явище природної радіоактивності – самовільного розпаду ядер атомів важких металів
|
|
|
8. |
1897 р. |
Амереканський інженер Джозеф Джон Томсон |
Відкриття електрона, як складової частини атома і носія найменшого заряду.
|
|
|
9. |
1899р. |
Ернест Резерфорд і його послідовники |
Вчені встановили, що під впливом магніту випромінювання, що випускається ураном, розділяється на три потоки, тобто, що існує, щонайменше, три види радіації. азвали їх альфа-, бета - і гамма-випромінюванням. |
|
|
10. |
1859 р. |
Кірхгоф і Бунзен |
Проаналізували результати тривалої роботи багатьох вчених по різним виглядам спектрів від різних речовин і прийшли до висновку, що кожен атома має свій спектральний рисунок і цей рисунок пов’язаний саме з будовою атома. (Метод спектрального аналізу) |
|
|
11. |
1902р. |
Французькі вчені Марія і П'єр Кюрі |
Вперше виділила з уранової руди природний радіоактивний елемент - радій. |
|
|
12. |
1903р. |
Дж. Дж. Томсоном |
Перша достатньо розроблена модель атома. Згідно цієї моделі речовина в атомі несе позитивний заряд і рівномірно заповнює весь об'єм атома. Електрони "вкраплені" в атом. |
|
|
13. |
1909р. |
Американський вчений Міллікен |
Визначив заряд електрона е = - 1,6 * 10 -19 Кл. |
|
|
14. |
1911 р. |
Англійський фізик Ернест Резерфорд |
Резерфорд експериментально перевірив модель Томсона і довів ,що Атом складається з позитивно зарядженого ядра, яке займає мізерно малий обсяг атома. Навколо ядра розташовані електрони. Електрони обертаються навколо ядра на досить великих відстанях від нього. Таку модель назвали планетарною або ядерною. |
|
|
15 |
1913р. |
Ернест Резерфорд |
Висунув гіпотезу по те, що однією із частинок, які входять до складу ядра хімічних елементів, є ядро атома гідрогену, тобто протон |
|
|
16 |
|
Датський фізик Нільсом Бор |
Розвинув теорію квантових уявлень про процеси в природі. Він сформулював у вигляді постулатів основні положення нової теорії. Згідно постулатам Бора електрон може знаходитися на декількох визначених орбітах. Кожній орбіті електрона відповідає певна енергія. |
|
|
17 |
1917 р. |
Німецький вчений Альберт Ейнштейн |
Передбачив можливість переходу атома з вищого енергетичного стану в нижче під впливом зовнішнього впливу. Таке випромінювання називається вимушеним випромінюванням і лежить в основі роботи лазерів. |
|
|
18 |
1919р. |
Ернест Резерфорд |
Бомбардуючи альфа-частинками ядра азоту, перетворив їх в ядра оксигену, здійснивши таким чином першу в історії ядерну реакцію |
|
|
19 |
1932р. |
Англійський фізик Джеймс Чедвік |
Відкрив нейтрон - частку, рівну за масою протону, але не має заряду. Було створено нейтронно-протонну модель атомного ядра. У результаті відбулося виділення з атомної фізики самостійного напрямку - ядерної фізики. |
|
|
20 |
1934 р. |
Французькі фізики Фредерік та Ірен Жоліо-Кюрі |
Отримали перший штучний ізотоп фосфор-30 (природний фосфор на 100 % складається з фосфору-31).Це стало своєрідним стартом: починаючи з цього часу і далі, у фізичних лабораторіях різних країн були отримані тисячі ізотопів, не існуючих в природі. |
|
|
IV. Застосування знань про будову атома |
||||
ВИСТУП УЧЕНИЦІ
В історії розвитку фізики одна з найбільш цікавих і захоплюючих сторінок - це історія відкриття складної будови атома. Тому сьогодні я хочу ознайомити вас з деякими відомостями про вивчення атома.
Саме слово походить від грецького «atomos» - неподільний.
Щоб найкраще донести до вас інформацію, я вирішила зробити таблицю «Основні етапи розвитку атомної фізики». В ній я показала, як тисячоліттями вчені намагалися зрозуміти, що таке атом. І через деякий час їм це вдалося. Червоним кольором я відмітила найважливіші продії.
Перші ідеї про існування атомів ще 2,5 тис. років тому висловили давньогрецькі вчені філософи Демокріт і Левкіпп. Саме вони назвали атомом дрібну неподільну частинку, що утворює речовину. У 1626 р. Парижський парламент під загрозою страти заборонив атомістичну теорію. Згодом її все ж таки було визнано, але до середини ХІХ ст. вважалося, що атом є не подільним.
Першу модель атома в 1903 р. запропонував Джозеф Джон Томсон. Він запропонував.. (читаєш з підручника, ст..267, п.70,14 стрічка саме так написано; читаєш до кінця абзац, Однак … ІІ абзац починається читаєш дві стрічки …. Але читаєш не 1906 рік, а 1911 рік) . Тобто моделі атома Томсона був нанесений удар дослідженнями Резерфорда і його учнів. Як саме це відбувалось пропоную переглянути фільм


про публікацію авторської розробки
Додати розробку