Урок з хімії "Алюміній як хімічний елемент і проста речовина. Фізичні та хімічні властивості алюмінію"
Мета: розширити та поглибити знання про метали на прикладі Алюмінію — представника головної підгрупи III групи; розглянути положення Алюмінію в Періодичній таблиці, його фізичні та хімічні властивості. Актуалізувати знання по іншим темам, показати учням зв'язок науки та життя, підтримувати інтерес до хімії, розвивати вміння логічно мислити, працювати з підручником та додатковим матеріалом.
10 клас – хімія
Урок 26
Тема: Алюміній як хімічний елемент і проста речовина. Фізичні та хімічні властивості алюмінію.
Мета: розширити та поглибити знання про метали на прикладі Алюмінію — представника головної підгрупи III групи; розглянути положення Алюмінію в Періодичній таблиці, його фізичні та хімічні властивості. Актуалізувати знання по іншим темам, показати учням зв'язок науки та життя, підтримувати інтерес до хімії, розвивати вміння логічно мислити, працювати з підручником та додатковим матеріалом.
Тип уроку: засвоєння нових знань і вмінь.
Методи навчання: бесіда, розповідь, робота з підручником, з наочним матеріалом, роздатковий матеріалом.
Обладнання: комп’ютер, мультимедійний проектор, презентація, періодична система хімічних елементів Д.І.Менделєєва; алюмінієві таблетки, алюмінієвий посуд, хлорид на кислота, пробірки, відео – хімічні властивості алюмінію, картинки «Застосування Алюмініюю», «Алюміній, поширення у природі».
Хід уроку
І. Організаційний момент – 1 хв
1.1. Привітання учнів.
1.2. Перевірка присутності учнів: кількість за списком _______, кількість присутніх на уроці _________, відсутніх ___________.
1.3. Перевірка готовності учнів до уроку.
ІІ. Перевірка д/з
Самостійна робота – 7 хв
Усне опитування
III. Актуалізація опорних знань і мотивація навчальної діяльності – 3 хв
Ми з вами знаємо, що у кожного хімічного елемента є «своя кімната» у великому будинку – періодичній системі Д.І.Менделєєва. Сьогодні ми з вами познайомимося ще із одним мешканцем цього будинку – це метал, який добре відомий вам з дитинства.
Для того, щоб визначити вам, що це за метал, спробуйте відповісти на питання:
- Який метал найпоширеніший в земної корі серед металевих елементів?
- Який метал займає третє місце за поширеністю у земної корі серед всіх хімічних елементів?
- Цей метал колись був дорожче золота, одного разу імператор Наполеон ІІІ, дав банкет, де найпочесніші гості отримали посуд з цього метала, а решта гостей їла із звичайного золотого посуду. Про який метал йде мова?
- Цей метал майже 100 років тому був названий «металом соціалізму».
Я сріблястий, я криластий,
Високо люблю літати.
А корозії не знаю,
Плівкою себе вкриваю.
На опорах через ліс
То дротами я повис.
Можу двері змайструвати,
Посудом на кухні стати.
А народжуюсь із глини.
Чи мене назвеш ти нині?
Які асоціації виникають у вас при слові «Алюміній»?
(відповіді учнів)
Учитель. Чи знаєте ви …
- Яким способом вперше добутий даний метал?
- Чи зустрічається алюміній в природі у чистому виді?
- Чому алюміній називають «Срібло з глини»?
- Чи можна варити кислі компоти або квасити капусту в алюмінієвому посуді?
- Якщо вам потрібно налити воду в алюмінієву каструлю, то буде проходити хімічна реакція?
І зараз ми з вами зробимо подорож, щоб познайомитися з незвичайним хімічним елементом – алюмінієм, будовою його атому, з фізичними та хімічними властивостями алюмінію як простої речовини.
Повідомлення теми і мети уроку – 1 хв.
ІV. Вивчення нового матеріалу – 25 хв з них 4 хв відео
Усім знайомі вироби з алюмінію: фольга, посуд, дріт. Але колись він був дуже рідкісним і дорогим металом. На алюмінієвий злиток, виставлений у 1855 р. на Всесвітній Паризькій виставці, дивилися як на найрідшу коштовність. У ті часи 1 кг алюмінію коштував дорожче золота й у 1500 разів дорожче заліза.
«Історія відкриття алюмінію».
В «Естественной истории» римського історика Плінія Старшого є така легенда «Одного разу до римського імператора Тиберія прийшов незнайомець. В дар імператору він приніс виготовлену їм чашу із блискучого, як срібло, але занадто легкого металу. Майстер розповів, що добув цей метал із «глинястої землі». Але імператор, боячись, що знеціняться його золото та срібло, наказав стратити майстра, а його майстерню зруйнувати». Це лише легенда. А як же був відкритий алюміній?
Вперше алюміній був добутий датським фізиком Ерстедом у 1825 році. Назва елементу утворена від латинського «алюмен», так в давнину називали галуни, їх використовували для фарбування тканини. Німецький вчений Велер у 1827 році добув алюміній при нагріванні алюмінію хлориду із лужними металами . А в 1855 році Сент-Клер Девіль вперше добув алюміній промисловим способом.
В період відкриття алюміній був дорожче за золота. Англійці хотіли показати високу повагу до великого російського хіміка Д.І.Менделєєва и подарували йому хімічні терези, в яких одна чашка була виготовлена із золота а друга – з алюмінію. Чашка із алюмінію стала дорожче золотої.
Поширеність у природі
Алюміній – найпоширеніший металічний елемент на Землі, займає 3 місце серед усіх хімічних елементів: 8 % земної кори. Алюміній - це активний метал,тому в природі він міститься тільки у вигляді сполук, він входить до складу алюмосилікатів, до яких належать: глини, слюди, польові шпати, зокрема каолін. Промислово важливою алюмінієвою рудою є боксит Алюміній входить до складу мінералу корунду, який є кристалічним алюміній оксидом. Різні домішки здатні надавати корундові різних кольорів. зеленого, жовтого, жовтогарячого, фіолетового та інших кольорів й відтінків. Його синій різновид називають сапфіром, а червоний — рубіном. І рубіни, і сапфіри є коштовними каменями
Алюміній як хімічний елемент.
Цей хімічний елемент у періодичній системі має порядковий номер 13.
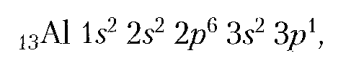 Як свідчить електронна формула атома Алюмінію:
Як свідчить електронна формула атома Алюмінію:
його 13 електронів розташовані па трьох енергетичних рівнях, з них 3 містяться на зовнішньому енергетичному рівні. Зверніть увагу на те, що в одному з Алюмінієм періоді зліва розташований металічний елемент Магній, справа — неметалічний елемент Силіцій. Таке положення Алюмінію, а також наявність на зовнішньому енергетичному рівні трьох електронів визначили характер хімічних властивостей металу алюмінію, оксиду та гідроксиду Алюмінію.
Алюміній — металічний хімічний елемент, оксид і гідроксид якого наділені амфотерними властивостями.
Алюміній входить до трійки найпоширеніших хімічних елементів на Землі (після неметалічних елементів Оксигену і Силіцію). Серед металічних елементів за поширенням у природі він на першому місці, проте у вільному стані не трапляється. Алюміній входить до складу гірських порід і мінералів, серед яких найпоширенішими є польовий шпат, каолін, або біла глина (рис. 79а), корунд (рис. 79б), боксит (рис. 79в).
Алюміній як проста речовина.
Алюміній — сріблясто-білий з виразним металевим блиском метал. Має густину 2,7 г/см3 і температуру плавлення 660 °С. Легкий, м'який, ковкий, легко піддається прокату й штампуванню. З нього виготовляють дроти, тоненьку плівку (алюмінієву фольгу), яку застосовують у харчовій і фармацевтичній галузях для пакування продуктів і пігулок. Проте основне застосування алюмінію пов'язане з його високою електро - і теплопровідністю, здатністю до утворення легких, міцних і корозійностійких сплавів
1. Взаємодія алюмінію з киснем.
На повітрі алюміній окиснюється, покривається тонкою оксидною плівкою АІ2Оз і набуває матового кольору. Ця плівка завтовшки всього 5-10 нм надійно захищає метал від подальшої взаємодії з киснем і водою, що завжди є в повітрі.
У кисні порошок або стружка алюмінію згорають при високій температурі з утворенням оксиду:
4АІ + 302 = 2А1203 - відео
2. Взаємодія алюмінію з іншими неметалами.
За різних температурних умов, у деяких випадках із застосуванням каталізаторів, алюміній реагує з більшістю неметалів (виняток становлять водень та інертні гази):
2АІ + 3S = А12S3
2А1 + ЗСІ2 = 2АІСІ3 - відео
2А1 + ЗІ2 = 2А1І3
Назвіть продукти розглянутих реакцій.
Взаємодія алюмінію з йодом відбувається за кімнатної температури й каталізується водою. Для її проведення порошок алюмінію змішують із подрібненим йодом і додають кілька крапель води (рис. 80а). Відразу розпочинається бурхлива реакція (рис. 806).
3. Взаємодія алюмінію з кислотами.
Алюміній, позбавлений оксидної плівки, активно реагує з хлоридною кислотою (рис. 81а) і дещо повільніше з розбавленою сульфатною кислотою (рис. 816) з виділенням водню:
2АІ + 6 НСІ = 2АІСІ3 + Н2↑ - дослід
Здійснити взаємодію алюмінію з концентрованою нітратною та сульфатною кислотами на холоді практично неможливо.
4. Взаємодія алюмінію з водою:
2АІ + 6Н20 = 2АІ(ОН)3 + ЗН2 | - відео
Для того щоб відбулася ця взаємодія, треба спочатку зняти з поверхні алюмінію захисну оксидну плівку. Це можна зробити, наприклад, за допомогою наждачного паперу.
5. Взаємодія алюмінію з оксидами металічних елементів.
Алюміній відновлює багато металів з їх оксидів. Реакції екзотермічні, температура становить 1200-3000 °С:
2АІ + Сг203 →А1203 + 2Сг
2А1 + W03 = А1203 + W
Цю властивість алюмінію застосовують у промисловості для добування деяких металів.
Відновлення металів з їх оксидів за допомогою алюмінію дістало назву алюмотермія (алюмінотермія).
Відкриття алюмотермії належить хіміку М. М. Бекетову. З його біографічними даними ви ознайомилися у 8 класі, вивчаючи ряд активності металів, установлений вченим експериментально та названий на його честь.
Алюміній – за фізичними властивостями – типовий метал. За хімічними властивостями – алюміній – амфотерна сполука, так як реагує і з кислотами, і з лугами.
Значення Алюмінію
Алюміній дуже добре проводить електричний струм – за електропровідністю він іде після срібла та міді. Тому з чистого алюмінію виготовляють електропроводи.
Алюмінієве покриття добре захищає стальні та чавунні вироби від корозії. Для цього поверхню таких виробів насичують алюмінієм – алітують.
Сплавам алюмінію з міддю, магнієм, силіцієм властиві легкість та висока міцність, тому вони використовуються в авіації, суднобудуванні, залізничному транспорті, у будівництві, приладобудуванні.
Алюміній застосовують для одержання металів і неметалів - картинки
V. Закріплення набутих знань – 2 хв
1. Електронна конфігурація атома Аl:
а) 1s22s22p3; б) 1s22s22p63s23p1;
в) 1s22s22p63s23p3; г) 1s22s22p63s23p2.
2. Ступінь окиснення яку має алюміній в складних сполуках:
а) - 3; б) +1;
в) +2; г) + 3.
3. Період періодичної системи, в якому розташований алюміній:
а) І ; б) ІІ ;
в) ІІІ; г) ІV
4. Тип хімічного зв’язку в простій речовині алюмінію:
а) йонний; б)ковалентний полярний;
в) ковалентний полярний; г) металевий.
5. Група і підгрупа періодичної системи, в якій розташований алюміній:
а) ІІІ, головна; б) ІІІ, побічна;
в) ІІ, головна; г)ІІ, побічна.
6. Алюміній стійкий до корозій через те, що:
а) має оксидну плівку; б) твердий;
в) теплопровідний; г) електропровідний.
7. Алюміній має:
а) 13 протонів, 13 електронів, 13 нейтронів;
б) 13 протонів, 14 електронів, 13 протонів;
в) 14 протонів, 13 електронів, 13 протонів;
г) 13 протонів, 13 електронів, 14 протонів.
8. Знайти відповідність між реагентами та продуктами реакції
(взаємоперевірка на індивідуальних картках)
|
1 варіант |
2 варіант |
||
|
A.Al2S3 Б.2AlI3 В.2Al(OH)3 Г.2Na3AlO3+3H2 Д.2Al(OH)3+3H2 |
1.4Al+3O2 2.2Al+6HCl 3.2Al+3Br2 4.2Al + Fe2O3 |
А.2AlCl3 + 3H2 Б.2AlBr3 В.2Fe+Al2O3 Г. 2Al2O3 Д.AlCl3+3H2 |
VІ. Домашнє завдання – 1 хв
1. §21 ст. 172 – 175, впр.3 перетворення
2. Вивчити конспект.
3. Творчі завдання:
а) при зберіганні в алюмінієвому посуді борщу з кислої капусти він набуває неприємний «металевий» присмак. З яким хімічним процесом ця пов’язано?
б) поясніть, чому алюміній не піддається пайці на повітрі?
в) чи можна спостерігати процес горіння алюмінію в повсякденному житті?
4. Підготувати повідомлення або презентацію «Алюміній і здоров’я людини»
VІІ. Підбиття підсумків уроку
Пояснення питань, які виникли у учнів. Виставлення оцінок за урок.
1

про публікацію авторської розробки
Додати розробку
