Урок з хімії "Амоніак"
Тема уроку. Амоніак: властивості, використання. Солі амонію. Якісна реакція на іон амонію
Мета уроку:
- ознайомити зі складом, особливостями будови молекули й фізичними властивостями амоніаку, розчинністю амоніаку у воді й дією індикаторів на розчин, особливостями взаємодії амоніаку з водою й кислотами;
-розповісти про застосування амоніаку; розширити уявлення про солі та їх загальні властивості на прикладі солей амонію;
- ознайомити учнів зі специфічними властивостями солей амонію; дати уявлення про способи одержання солей амонію;
- розвивати вміння складати іонно-молекулярні рівняння відповідних реакцій на прикладі хімічних властивостей амоніаку;
-удосконалювати вміння проводити хімічний експеримент, спостерігати за перебігом реакцій і робити узагальнюючі висновки.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: навчальна лекція, лабораторний і демонстраційний експерименти, робота з опорною схемою.
Обладнання: _______________________________________________
Демонстрація. ____________________________________________
Лабораторний дослід 2. Визначення іонів амонію в розчині.
ХІД УРОКУ
Вправа «Рефлексія» , розпочнемо підготовку до уроку , закрийте очі та повторюйте за мною :- я спокійний , - пам'ять моя зростає, -увага моя міцнішає, -зараз я почну навчатися, -я працюю…
II. Актуалізація опорних знань, перевірка домашнього завдання
- Напишіть рівняння одержання амоніаку, укажіть окисник і відновник.
У лабораторії амоніак одержують дією лугів на солі амонію при нагріванні. У посудині необхідно змішати рівні об’єми (по чайній ложці) кристалічного амоній хлориду і кальцій гідроксиду(гашеного вапна) і трохи нагріти. Амоніак , що виділяється , зібрати в пробірку і закрити пробкою.
NH4CL+ Ca(OH)2=___________________________
2. Охарактеризуйте цю реакцію, назвіть умови, необхідні для перебігу цієї реакції/ Це реакція обміну, яка відбувається при нагріванні суміші,а аміак легкий газ , і тому пробірку необхідно перевернути , а волога лакмусова бумажка синіє в присутності аміаку.
ІІІ. Мотивація до уроку. Тема сьогодні нашого уроку( на дошці) Амоніак: властивості, використання. Солі амонію. Якісна реакція на іон амонію. І тому , я хочу провести маленький експеримент «РОЗА І АМІАК», який допоможе продемонструвати вам властивості амоніака для живих організмів на планеті Земля. ( експеримент провести із розою, чашкою петрі, підносом скляним, стаканом та банкою, аміаком чи нашатирним спиртом), результат цього експерименту ми зможемо побачити вкінці нашого уроку , та переконаємося що амоніак в має велике значення для живих організмів на Землі.
III. Вивчення нового матеріалу (розповідь учителя)
- Амоніак — будова молекули й фізичні властивості.
«ХІМІЧНА АБЕТКА» ( А3)( і в учнів на столі, на листочку , треба заповнити, я буду заповнювати на дошці , а учні в листочку)
Амоніак – одна з найважливіших сполук Нітрогену, яка має важливе практичне значення . Життя на Землі пов’язане із здатністю деяких бактерій перетворювати азот повітря на амоніак. Запах амоніаку знайомий кожному , варто лише відкрити склянку із нашатирним спиртом .
H H
1) NH3 2) H :N: H 3) H-N-H
Молекулярна Електронна Структурна
формула формула формула
4)Наявність трьох ковалентних зв’язків зумовлює валентність Нітрогену в молекулі аміаку- ІІІ, проте за певних умов валентність Нітрогену може збільшуватися ІV .
5)ступінь окиснення -3 ,
6)Мr(NH3) = 17
7)М(NH3) = 17г/моль
8) безбарвний газ із різким запахом, Цей запах має і його 10% водний розчин - нашатирний спирт. легший за повітря в 1,7 разів.
9)добре розчинний у воді (до 700 л амоніаку в 1 л води).
10)Температура плавлення дорівнює —77,7 °С,
11)температура кипіння 33,4 °С.
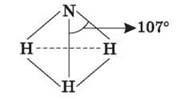
12) молекула NH3 має структуру трикутної піраміди з атомом Нітрогену у вершині.
13) Хімічні зв’язки між атомами Нітрогену і Гідрогену в молекулі аміаку – ковалентні полярні. 107°. Молекула аміаку являє собою диполь.
МАЛЮНОК НА ДОШЦІ.
2. Хімічні властивості амоніаку . Для аміаку характерні реакції окиснення і приєднання.
І. Реакції окиснення:
а) аміак горить в кисні ,на повітрі не горить, але в атмосфері кисню згоряє жовтим полум’ям:
![]() (1)
(1)
ІІ. Реакції приєднання:
а) амоніак може розчинятися я у воді, й взаємодіє з нею, реакція з водою відбувається за такою сумарною схемою:
![]() (3)
(3)
ДОСЛІД1. ( демонструю на комп’ютері і коментую) Круглодонну колбу заздалегідь наповнюємо амоніаком. Потім колбу отвором занурюємо в посудину з водою, в яку попередньо додаємо кілька крапель фенолфталеїну і під водою відкриваємо отвір. При температурі 20 градусів, 700 обємів аміака розчиняється в 1 обємі води. Тому при контакті аміака з водою відбувається його швидке розчинення, тиск у колбі падає і вода з добавленим фенолфталеїном під дією різниці тиску піднімається у колбу заповнену аміаком, середовище в колбі лужне, тому із за добавленого фенолфталеїну колір його стає малиновим.
Реакція взаємодії амоніаку з водою є оборотною. У водному розчині амоніаку більше молекул NH3,ніж йонів амонію і гідроксид –йонів. Тому формулу амоній гідроксиду записуємо не ![]() , а
, а ![]() . Отже, молекули
. Отже, молекули ![]() не існує. Водний розчин аміаку називають нашатирним спиртом.
не існує. Водний розчин аміаку називають нашатирним спиртом.
б) ДОСЛІД 2. реакція аміаку з кислотами відбувається теж за донорно-акцепторним механізмом. Донором в них, як в реакції з водою, виступають атоми Нітрогену молекули аміаку, а акцепторами - йони Гідрогену, які утворюються при дисоціації кислот.
Наприклад, взаємодія аміаку з хлоридною кислотою відбувається за такими рівняннями:
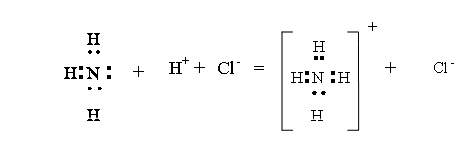
![]()
(Показую дослід « Дим без вогню» та коментую)В пробірці розчин аміака,це нашатирний спирт, який часто використовують у медецині,волога лакмусова бумажка стає синього кольру , тому що водний розчин аміаку – це основа,фенолфталеїн підтверджує це , так як стає в розчині малинового кольору,підносимо склянну паличку, змочену у концентрованій хлорид ній кислоті, зявляється густий білий дим, це виділяється хлорид амонія, так можна стверджувати про наявність аміаку.
Хлорид амонію тверда, кристалічна речовина білого кольору.
Якщо поставити поряд склянки з розчином аміаку і концентрованої хлоридної кислоти, можна спостерігати появу білого диму. Білий дим - це найдрібніші частки хлориду амонію, який утворився між газоподібним аміаком NH3 і хлороводнем HCl.
Висновок: розчин амоніаку NH3 — основа, оскільки взаємодіє з кислотами, а розчин має лужну реакцію.
IV. Первинне застосування отриманих знань
1. Напишіть рівняння реакцій, з допомогою яких можна здійснити перетворення:
1)________________________________________________________
2)_______________________________________________________
3)_______________________________________________________
4. Якісною реакцією на іон амонію є реакція взаємодії з лугами. При цьому утворюється слабка основа NH4OH, що легко розкладається на амоніак і воду, при цьому з’являється запах амоніаку. Усі солі й розчини, що містять іон амонію, мають слабкий запах амоніаку.
Лабораторний дослід 5. Якісна реакція на іон амонію
Здійсніть якісну реакцію й визначте наявність у розчині іона амонію, запишіть іонно-молекулярне рівняння взаємодії амоній хлориду з лугами:
NH4Cl + KOH ![]() KCl + NH4ОH
KCl + NH4ОH ![]() KCl + NH3 + H2О
KCl + NH3 + H2О
NH4+ + Cl- + K+ + OH- ![]() K+ + Cl- + NH3 + H2О
K+ + Cl- + NH3 + H2О
NH4+ + OH- ![]() NH3 + H2О
NH3 + H2О
V. Самостійна робота ( 3 учня роблять письмо, а 3 усно)
ЗАВДАННЯ 1 (письмово)Яка валентність Нітрогену в молекулі аміаку?
а) 1 в) 3
б) +3 г) -4
Яка ступінь окиснення Нітрогену в молекулах аміаку?
а) 0 в) -3
б) +3 г) -4
Молекули яких перерахованих речовин є диполями:
а) кисню в) води
б) водню г) азоту
Аміак легший за повітря. Підрахуйте, у скільки разів:
а) 2,5 в) 1,3
б) 1,7 г) 3,3
ЗАВДАННЯ2. «КУБИК»(усні запитання)
1)_У скільки разів аміак легший за повітря? ( у 1,7 разів)
2) Який ступінь окиснення Нітрогену в молекулах аміаку? ( -3)
3) Якщо поставити поряд склянки з розчином аміаку і концентрованої хлоридної кислоти, можна спостерігати появу….( білого диму.)
4) Що собою являє молекула аміаку( являє собою диполь.)
5)Чи може аміак горіти у повітрі? ( ні, горить у кисні)
6)Яку структуру має молекула NH3(трикутної піраміди з атомом Нітрогеном у вершині).
ПОВІДОМЛЕННЯ УЧНІВ
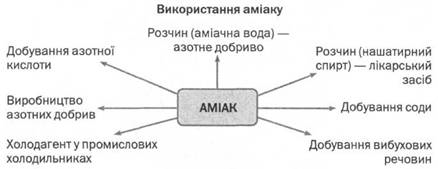
Застосування аміаку
Амоніак - важливий продукт хімічної промисловості. Сучасна промисловість використовує десятки мільйонів тонн амоніаку на рік. Основна кількість якого переробляється в нітратну кислоту. Частково амоніак використовують для добування вибухових речовин, сечовини як мінерального добрива, обробки силосу він є сировиною для синтезу пластмас та штучних волокон, наприклад капрону. 10% водний розчин аміаку - нашатирний спирт використовують в медицині. Коли людина втратила свідомість, до її носу підносять ватку, змочену нашатирним спиртом. Різкий запах аміаку може привести людину до тями. Але давати нюхати такий розчин потрібно в міру. В великій кількості аміак уражує дихальні шляхи і слизові оболонки очей, викликає задуху, запаморочення, біль у шлунку.
Аміак широко використовують у різних галузях.
VI. Підбиття підсумків уроку.
Учні уявіть себе ведучими новин на відому телеканалі, в рубриці «КОРОТКО ПРО ГОЛОВНЕ» Гру ми розпочнемо моїми словами : А зараз рубрика Амоніак має певні властивості, а саме:
- Валентність Нітрогену у молекулі аміаку дорівнює ІІІ.
- 10відсотковий водний розчин аміаку- нашатирний спирт.
- Реакція аміаку з хлоридною кислотою відбувається з утворенням білого диму.
- Амоніак добре розчинний у воді.
- Аміак – безбарвний газ із різким запахом.
- Молекулярна формула амоніаку - NH3
- Результат експерименту «РОЗА ТА АМІАК» ( аміак проникає в рослину____________________________________________________________________________________________________________________
VII. Домашнє завдання
Опрацювати матеріал параграфа_____, відповісти на запитання до нього, виконати вправи_____

про публікацію авторської розробки
Додати розробку
